一株瘤胃黄曲霉毒素B1降解菌的分离鉴定及特性研究
张志敏,王 燕,毛 勇,李 胜,田西学,赵 毅,李 宏,杨汉卿,赵光明
(1.陕西省微生物研究所,陕西西安710043;2.陕西省饲料监测所,陕西西安710016;3.陕西省动物疫病预防控制中心,陕西西安710061)
黄曲霉毒素主要是由黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)等真菌在生长过程中产生的一类剧毒、强致癌性的次级代谢产物,包括B和G两族20余种衍生物,其中黄曲霉毒素B1(Aflatoxin B1,AFB1)分布最广、结构最稳定且毒性最强,因而AFB1被世界卫生组织癌症研究机构划定为Ⅰ类致癌物质[1]。黄曲霉毒素广泛存在于农产品和食品中,据联合国粮农组织(FAO)估计,全世界每年有25%的谷物受到霉菌毒素的污染,平均有2%不能食用;加上因毒素污染导致动物中毒引起的疾病和死亡,霉菌毒素给粮食工业和畜牧业造成巨大的经济损失[2]。2012年上海百奥明公司对全球范围内的4 000余份饲料及原料样品进行霉菌毒素的调查[3],结果发现,黄曲霉毒素阳性检出率达到25%,用作动物营养的大多数原料及饲料至少受到一种霉菌毒素的污染。霉变的饲料被动物采食后,霉菌及其代谢产生的毒素可残留在畜产品及其加工制品中,通过食物链进入人体,这些具有极强致病及致癌作用的毒素严重威胁人类健康。研究发现,肝癌高发区的地理分布与该地区食物被黄曲霉毒素污染程度呈正相关[4]。中国有多个肝癌高发区,如江苏启东县及广西扶绥县,肝癌的平均发病率分别为61/10万和130.8/10万。由此可见,有效控制和解决霉菌毒素对粮食和饲料的污染,对改善动物生产性能和提高人类食品安全以及维护人类健康有非常重要的意义。
目前,国内外专家学者对霉菌毒素的脱毒处理进行了大量研究,如采用物理或化学方法,先后开发出4代黄曲霉毒素的脱毒产品,但该类产品在去除霉菌毒素中存在诸多固有的缺陷,如脱毒过程中容易破坏饲料的营养成分、吸附饲料中的微量元素或营养成分、脱毒剂可能难以被机体消化吸收等,因此物理化学脱毒剂也较难广泛用于生产实践。与物理化学方法相比,生物脱毒具有效率高、特异性强、对饲料和环境无污染等特点和优势,备受研究者的关注[5-6]。国外学者对黄曲霉毒素生物降解的研究较早,有关真菌、细菌及其代谢产物、植物提取物等降解黄曲霉毒素方面的报道较多。近几年,国内在黄曲霉毒素的生物降解研究方面已有很大进展,但是由于微生物生物酶产量低、分离纯化过程复杂、酶不稳定性和酶作用条件苛刻性等原因,有关黄曲霉毒素生物降解在实际生产应用的研究很少。因此,筛选高活性的霉菌毒素降解菌仍然是霉菌毒素生物降解的重点。本研究以秦川牛瘤胃内容物为研究对象,旨在分离筛选出能够降解AFB1的菌株,并对其鉴定及降解特性进行初步研究,为AFB1的生物降解积累数据。
1 材料与方法
1.1 材料
1.1.1 样品采集 采集秦川牛瘤胃内容物30份,每份200g。
1.1.2 主要试剂和仪器 黄曲霉毒素B1标准品为Sigma公司产品;香豆素为北京恒业中远化工有限公司产品;黄曲霉毒素B1ELISA试剂盒为北京华安麦科生物技术有限公司产品;DG5033A型酶联免疫检测仪为北京鸿苑鑫仪科技有限公司产品;PCR仪为Applied Biosystems公司产品;DNA提取试剂盒、DNA胶回收试剂盒、DNA Marker为TaKaRa公司产品。
1.1.3 培养基
1.1.3.1 初筛培养基 KH2PO40.25g,MgSO4·7H2O 0.25g,KNO30.50g,(NH4)2SO40.50g,CaCl20.005g,FeCl3·6H2O 0.003g,琼脂粉18g,超纯水1 000mL,pH 7.0;121℃灭菌20min。用沸水溶解香豆素后按1∶3比例加入香豆素溶液使其最终作用浓度为1.0g/L。
1.1.3.2 发酵培养基 牛肉膏3.00g,蛋白胨10.00g,葡萄 糖 2.00g,NaCl 8.50g,KH2PO41.00g,超 纯 水 1 000mL,pH 7.0,121 ℃ 灭 菌20min。
1.2 方法
1.2.1 黄曲霉毒素B1标准品的配制 将10mg AFB1溶解于1mL的苯∶乙腈(98∶2),浓度为10 000μg/mL,作为母液,置-20℃存储备用;用苯∶乙腈(98∶2)溶解稀释母液至200μg/mL作为工作液。
1.2.2 菌株初筛 称取5.0g样品放置于含有45mL生理盐水的丝口瓶中(1∶10),37℃振荡2h,从中吸取1mL置于含9mL生理盐水的试管中,梯度稀释;吸取稀释液0.1mL涂布于初筛培养基平板上37℃培养7d。选取生长良好的菌株,连续3次划线于初筛培养基平板,纯化并保存菌株。
1.2.3 菌株复筛 取初筛菌株分别接种于5mL种子培养基中,37℃、150r/min摇床培养24h,取50μL菌株种子液接种于含有947.5μL发酵培养液的1.5mL发酵管 中,加入 2.5μL 浓 度 为200mg/mL AFB1使其终浓度为500μg/L,37℃、150r/min摇床培养72h,12 000r/min离心5min,吸取上清液,用甲醇∶水(1∶9)溶解并稀释1 000倍,待测AFB1的含量。
1.2.4 AFB1含量测定 用酶联免疫检测仪检测AFB1的含量,具体步骤见ELISA试剂盒说明书。计算AFB1的降解率,AFB1降解率(%)=(对照组AFB1含量-试验组AFB1含量)/对照组AFB1含量×100%。
1.2.5 菌种鉴定
1.2.5.1 形态及生理生化特征的鉴定 观察能降解AFB1菌株菌落形态特征,革兰染色,生理生化鉴别试验,参照《常见细菌系统鉴定手册》和《伯杰细菌系统鉴定手册》(8版)进行属和种的鉴别[7-8]。
1.2.5.2 16SrRNA序列分析 将纯化分离菌接种于营养肉汤培养基,摇床37℃过夜培养,12 000r/min离心10min收集菌体。按TaKaRa公司DNA提取试剂盒操作说明提取分离菌基因组DNA。用细菌16SrRNA通用引物以基因组DNA为模 板 进 行 PCR 扩 增。扩 增 引 物27F (5′-AGAGTTTGATCCTGGCTCAG-3′和1 492R(3′-TGCGGCTGGATCACCTCCTT-5′)由北京华大基因生物技术有限责任公司合成。PCR反应体系为50μL,反应条件为:94℃5min;94℃30s,56℃1min,72℃45s,30个循环;72℃10min。RCR扩增产物进行10g/L琼脂糖凝胶电泳检测,并回收PCR扩增产物送到北京华大生科技术有限责任公司完成测序。
1.2.5.3 基于16SrRNA序列的系统发育分析将PCR扩增得到的16SrRNA序列用NCBI的Blast程序进行序列同源性比对,用ClustalW-1.83和MEGE4.1软件进行UPGMA分析并构建基于16SrRNA序列的系统发育树,用Bootstrap法(1 000次重复)检验。
1.2.6 不同因素对分离菌降解AFB1效率的影响当培养温度分别为20、25、30、35、40、45℃时,按1.2.3方法培养72h后,测定各个培养上清液中AFB1的含量,计算AFB1降解率。当起始pH分别为5.0、6.0、6.5、7.0、7.5、8.0、9.0时,培养 72h后,测定各个培养上清液中AFB1的含量,计算AFB1降解率。当接种量分别为2%、5%、10%、15%、20%时,培养72h后,测定各个培养上清液中AFB1的含量,计算AFB1降解率。
2 结果
2.1 降解AFB1菌株的分离鉴定
经过多次分离和纯化,得到一株以香豆素为唯一碳源和能量生长并且对AFB1有降解作用的菌株,标记为WZ-2,菌株的菌落形态、革兰染色如图1所示。菌株WZ-2的菌落、菌体的形态特征和生理生化指标分别见表1和表2。

图1 菌株WZ-2形态特征Fig.1 The morphological characteristics of strain WZ-2

表1 菌株WZ-2的形态特征Table 1 Morphological characteristics of the WZ-2strain

表2 菌株WZ-2的生理生化特性Table 2 Physiological and biochemical characteristics of the WZ-2strain
2.2 基于16SrRNA基因序列系统发育分析
以WZ-2基因组DNA为模板,用细菌16S rRNA通用引物进行扩增,得到长度为1 430bp的PCR扩增产物(图2)。从数据库中调取有效发表的模式菌株序列,构建系统发育树(图3)。分析结果显示菌株WZ-2为Bacillus sp.,该菌株与巨大芽胞杆菌相聚于同一个系统发育分支,两株菌之间的系统发育关系非常密切。根据系统发育分析结果,结合生理生化及形态学特征,将该菌鉴定为Bacillus megaterium。
2.3 不同培养温度对菌株WZ-2降解AFB1的影响
结果见图4。由图4可知,在温度为25℃~30℃度范围内,菌株WZ-2对AFB1的降解能力呈现上升趋势,且降解菌在30℃时对AFB1的降解率最高,为79.23%,由此确定30℃为降解菌的最佳生长温度。但是随着温度的再次升高,当到达40℃时,降解率就下降至56.22%,当温度为45℃,降解率就更低,为35.27%,说明降解AFB1的活性物质在40℃及更高温度时,其降解活性受到影响。
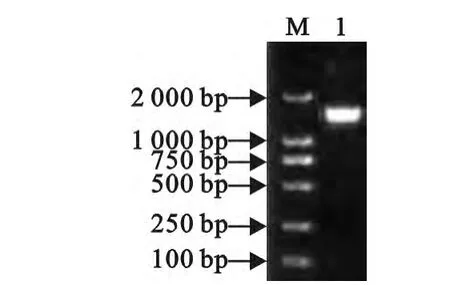
图2 16Sr RNA琼脂糖电泳检测Fig.2 Agarose gel electrophoresis of 16SrRNA gene

图3 WZ-2菌株的系统发育分析Fig.3 Phylpgenetic analysis of the WZ-2strain

图4 温度对菌株WZ-2降解AFB1的影响Fig.4 Effect of different temperature on the degrading AFB1of WZ-2strain
2.4 不同起始pH对菌株WZ-2降解AFB1的影响
结果见图5。由图5可知,起始pH在6.5~7.0范围内,菌株 WZ-2对AFB1的降解能力均在70%以上。当pH为7.0时,降解率达到最大值,为79.97%;当起始pH为7.5时,降解率又有所下降,为60.33%;之后随着起始pH从7.5到8.0再到9.0的升高,降解率又由60.33%变为64.45%再变为70.54%,呈上升趋势。可能因为该菌株在pH为6.5~7.0时生长较好,分泌的降解物质较多,降解率较高。当起始pH升至7.5时,该菌生长减慢,降解率下降。当起始pH在8.0~9.0时,菌体已经不再生长代谢,但是在强碱的环境下,AFB1的内酯键容易受到羟基的攻击,将其内酯环打开,从而造成AFB1的化学降解。

图5 pH对菌株WZ-2降解AFB1的影响Fig.5 Effect of different pH on the degrading AFB1of WZ-2strain
2.5 不同接种量对菌株WZ-2降解AFB1的影响
结果见图6。由图6可知,当接种量为5%~10%时,菌株WZ-2对AFB1的降解率在60%以上,而且当接种量为5%时,降解率达到最大值,为76.45%。之后随着接种量的增加,降解率开始下降,可能因为接种量较少时,菌体分泌的降解物质较少,降解作用不明显;而接种量过多时,菌体之间存在营养竞争,多数菌株在营养匮乏的情况下只能维持自身生长需求不会进行降解物质的分泌,所以降解率有所下降;当5%的接种量时,菌体浓度和营养到达最佳配比,所以降解率也最大。
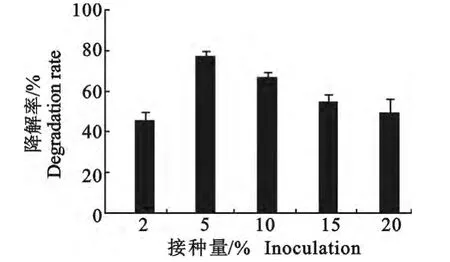
图6 接种量对菌株WZ-2降解AFB1的影响Fig.6 Effect of inoculation biomass on the degrading AFB1of WZ-2strain
3 讨论
霉菌毒素污染范围广泛,危害程度严重,如何有效防控和降解饲料和食品中的霉菌毒素始终是畜牧业和食品工业亟待解决的科学难题。微生物是自然界的分解者,几乎能够分解自然界所有的物质。生物降解脱毒法就是通过微生物发酵或者其产生的酶将霉菌毒素降解为低毒或者无毒的物质,达到脱毒的目的。国外报道的对AFB1有降解作用的微生物较多,主要有根霉(R.arrhizus)、绿色毛霉(Mucor mabiguus)、树状指孢霉(Dactylium dendroide)、寄生曲霉(Aspergillus parasiticus)、黑曲霉(Aspergillus niger)、橙色黄杆菌(Flacobacterium aurantiacum)、分支杆菌(Mucobacteroum)和红串红球菌(Rhodococcus erythropolis)等[9-14]。国内报道的关于AFB1降解菌主要有嗜麦芽窄食单胞菌(Stenotrophomonas sp.)、施假单胞菌(Pseudomonas stutzeri)、枯草芽胞杆菌、乳酸菌和醋酸菌等[15-16]。
反刍动物瘤胃中富含大量的微生物,每克瘤胃内容物中有109~1010个细菌。瘤胃微生物对饲料的发酵是造成反刍动物与非反刍动物消化特点不同的原因。反刍动物与其体内的瘤胃微生物在长期进化过程中形成相互制约、相互依赖的微生物系统,它与畜禽的免疫、营养、肿瘤、生物拮抗、急性与慢性感染等都有着非常密切的联系。饲料中普遍存在霉菌毒素,为了减少毒素在动物体内的积累,畜禽体内的正常菌群除了对毒素产生耐受性外,体内还会存在具体降解毒素能力的菌株,动物才能适应环境生存下来。因此,长期接触霉菌毒素的反刍动物瘤胃内容物中可能存在能降解霉菌毒素的细菌。
本研究以秦川牛瘤胃内容物为筛选样品,成功地分离到一株以香豆素为碳源和能量生长、能够降解AFB1的菌株,命名为 WZ-2。通过形态学、生理生化特征和16SrRNA序列同源性及种系进化关系分析,鉴定WZ-2菌株为巨大芽胞杆菌(Bacillus megaterium)。通过不同温度、pH、菌株接种量等因素对该菌株降解AFB1效率的影响试验证明,当培养温度为30℃、pH为7.0、接种量为5%时,该菌株在含有500μg/L的AFB1发酵培养基中培养72h,其降解效果最好,降解率达79%。
本研究分离、鉴定的巨大芽胞杆菌作为生长发育正常的秦川牛瘤胃内的一种微生物菌,既具有对AFB1的降解除毒作用,同时具有益生作用。因此,本研究结果对该分离菌耐热、耐酸和对AFB1的降解条件、降解特性、降解机理等的进一步深入研究,在AFB1生物降解的微生物新型饲料开发等方面具有极大潜力及良好的经济和环境效益。
[1]计 成.饲料中霉菌毒素生物降解的研究进展[J].中国农业科学,2012,45(1):153-158.
[2]Zjalic S,Reverberi M,Ricelli A,et al.Trametes versicolor:a possible tool for aflatoxin control[J].Int J Food Microbiol,2006,107(3):243-249.
[3]王金勇,刘颖莉,关 舒.2012年中国饲料和原料霉菌毒素检测报告[J].百奥明通讯,2013,33(2):1-2.
[4]孙桂菊,钱耕荪,金锡鹏,等.肝癌高发地区人群黄曲霉毒素暴露水平的评估[J].东南大学学报:医学版,2002,21(1):118-122.
[5]Liang Y S,Yuan X Z,Zeng G M,et al.Biodelignification of rice straw by Phanerochaete chrysosporiumin the presence of dirhamnolipid[J].Biodegradation,2010,21:615-624.
[6]Dinis M J,Bezerra R M,Nunes F,et al.Modification of wheat straw lignin by solid fermentation with white-rot fungi[J].Bioresour Technol,2009,100:4829-4835.
[7]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:43-273.
[8]中国科学院微生物研究所.伯杰氏细菌鉴定手册[M].8版.北京:科学出版社,1981.
[9]Sardjono E S R,Raharjo S,Rahayu K.Detoxification of aflatoxin B1by extracellular enzymes of Aspergillus oryzae KKB4[J].Indonesian Food and Nutrition Progress,2004,11(1):30-34.
[10]Wang J,Ogata M,Hirai H,et al.Detoxification of aflatoxin B1by manganese peroxidase from the white-rot fungus Phanerochaete sordida YK-624[J].FEMS Microbiol Lett,2011,314(2):164-169.
[11]Lillehoj E B,Ciegler A,Hall H H.Aflatoxin B1uptake by Flavobacterium aurantiacumand resulting toxic effects[J].J Bacteriol,1967,93(1):464-471.
[12]Hormisch D,Brost I,Kohring G W,et al.Mycobacterium fluoranthenivorans sp.nov,a fluoranthene and aflatoxin B1 degrading bacterium from contaminated soil of a former coal gas plant[J].System Appl Microbiol,2004,27(6):653-660.
[13]Teniola O D,Addo P A,Brost I M,et al.Degradation of alatoxin B1by cell-free extracts of Rhodococcus erythropolis and Mycobacterium fluoranthenivorans sp.nov.DSM44556T[J].Int J Food Microbiol,2005,105(2):111-117.
[14]李俊霞,梁志宏,关 舒,等.黄曲霉毒素B1降解菌株的筛选及鉴定[J].中国农业科学,2008,41(5):1459-1463.
[15]李超波,李文明,杨文华,等.黄曲霉毒素B1降解菌的分离鉴定及其降解特性[J].微生物学报,2012,52(9):1129-1136.
[16]朱新贵,林 捷.几种食品微生物降解黄曲霉毒素作用的研究[J].食品科学,2001,22(10):65-68.

