天竺葵花色苷的稳定性及其在压花保色中的应用1)
刘晓东 闫 颖 高东菊
(东北林业大学,哈尔滨,150040) (上海农林职业技术学院)
压花(平面干燥花)是利用物理和化学处理方法,将植物的花、茎、叶、果实等压制成保持自然形态和颜色(或增加颜色)的平面花材的过程。将压制好的平面花材,经设计构思粘贴在各衬物上制成精美的艺术品,就是压花艺术。随着社会的发展,人们越来越崇尚自然,因此,干燥花的自然姿色更受人们的青睐,回归自然、走向自然是人们的生活目标,干燥花保持原有颜色不变,作为室内装饰已经成为了一种消费趋势[1-2]。压花饰品的色彩,主要依靠植物体内的天然色素,而它们的稳定性差,极易受到外界不利条件如氧气、紫外线、潮湿等的破坏,使压花饰品的寿命受到很大的影响[3]。目前,国内关于压花保色的研究也开始逐渐增多,如月季、珍珠梅花材的研究就已经取得很大的进步[4-6],非洲菊也有了很大进展[7],但由于检测方法的限制,还有很多机理尚不清楚。
天竺葵(Pelargonium hortorum)为牻牛儿苗科天竺葵属植物,多年生草本花卉,原产南非,世界各地均有栽培。其花色艳丽、花期长、产花量大、适应性强,具有较高的观赏价值。天竺葵花中含有大量花色苷,是一种重要的天然色素资源。花色苷是一种水溶性的色素,是花青素与糖通过糖苷键结合而形成的一类化合物[8],具有很强的着色能力,但其稳定性较差,是压花保色研究的主要对象。
由于天竺葵的花型美丽、色泽艳丽是压花画用材的适宜花材,研究以天竺葵花为试验材料,对其花色苷的稳定性进行初步研究,为天竺葵干燥花瓣资源在平面压花应用中保持其花色稳定性的研究提供科学依据。
1 材料与方法
天竺葵供试品种为特出系列紫罗兰,于2012年4月份购于哈尔滨花卉市场,于2012年5月—2013年4月份进行相关试验。选择第1 d 盛开的天竺葵花朵为供试材料,随采随做。所用化学试剂均为分析纯。
天竺葵花色苷吸收光谱的测定:取一定量的天竺葵花色苷提取液,用VARIAN Cary 100 UV-VIS紫外—可见分光光度计在波长200 ~800 nm 扫描获得其吸收光谱。
不同温度、作用时间对天竺葵花色苷稳定性的影响:天竺葵花色苷提取液分别置于温度30 ~90 ℃水浴锅中密闭条件下加热,对照组置于室温23 ℃,分别于30、60 min 取样,用紫外—可见分光光度计测定其最大吸收波长(A530)处的吸光度值,重复3次,求平均值。
不同光照对天竺葵花色苷稳定性的影响:天竺葵花色苷提取液于室温23 ℃,室内自然光照,日均光照强度250 lx;40 W 紫外灯照射,光源置于高40 cm 上方;室内黑暗条件;组培室内昼夜连续1 个灯管光照(光照强度1 770 lx)、组培室内昼夜连续2 个灯管光照(光照强度2 420 lx)、组培室内昼夜连续3个灯管光照(光照强度3 520 lx)条件下进行稳定性的研究,试验处理后,将提取液分别于特定时间取样用紫外—可见分光光度计测定其最大吸收波长(A530)处的吸光度值,重复3 次,求平均值,计算其保存率。保存率=(A1/A0)×100%(式中:A1表示加入添加剂后的吸光度值;A0表示色素原液的吸光度值)。
不同pH 值对天竺葵花色苷稳定性的影响:以0.3 mol·L-1HCl—乙醇溶液为天竺葵花色苷提取液,其pH 值小于1。用其提取液及2 mol·L-1的NaOH 溶液配置1 ~12 不同pH 值的天竺葵花色苷溶液,比较其颜色变化。再将pH 值为1 ~4 的花色苷溶液各配三等份,分别放置在室内23 ℃自然条件下,水浴锅30、40 ℃中,分别于特定时间取样用紫外—可见分光光度计测定其最大吸收波长(A530)处的吸光值,重复3 次,求平均值,计算其保存率。
不同金属离子Na+、K+、Zn2+、Ca2+对天竺葵花色苷稳定性的影响:将天竺葵花色苷提取液分别与不同浓度的金属离子(Na+、K+、Zn2+、Ca2+)以体积比1∶ 1 的比例配成溶液,放置在23 ℃室内自然条件下,分别于特定时间取样用紫外—可见分光光度计测定其最大吸收波长(A530)处的吸光值,重复3 次,求平均值。
蔗糖、葡萄糖、苹果酸、柠檬酸处理对天竺葵花色苷稳定性的影响:将天竺葵花色苷提取液分别与不同质量分数糖或有机酸以体积比1∶ 1 的比例配成溶液,放置在室内23 ℃自然环境下,分别于特定时间取样用紫外—可见分光光度计测定其最大吸收波长(A530)处的吸光值,重复3 次,求平均值,计算其保存率。
根据前期试验结果,将天竺葵花色苷提取液与组合优化保色剂配方分别以体积比1∶ 1 的比例配成溶液,放置在室内23 ℃自然条件下,分别于特定时间取样,用紫外—可见分光光度计测定其最大吸收波长(A530)处的吸光值,重复3 次,求平均值,计算其保存率。
取4 等份新鲜天竺葵花瓣,每份花瓣30 瓣,颜色及形状大小相同,花瓣直径1.5 cm。分别浸没于30 mL 最优保色剂中0.5、1、1.5、2 h,取出,吸水纸上放24 h 后微波压花,与新鲜花瓣对比并记录颜色,选出最佳浸泡时间。再将最佳保色后的压花分成5 份(确保每份花瓣数大于3)分别放于温度均为23 ℃的室内自然光照(日均光照强度250 lx)、室内黑暗条件、组培室内昼夜连续1 个灯管光照(光照强度1 770 lx)、组培室内昼夜连续2 个灯管光照(光照强度2 420 lx)和组培室内昼夜连续3 个灯管光照(光照强度3 520 lx)下处理1 个月,观察并记录花瓣颜色变化。
2 结果与分析
2.1 天竺葵花色苷提取液紫外—可见光光谱特征
天竺葵花色苷提取液的紫外—可见光光谱如图1所示,图1显示,在可见光区530 nm 处有明显的吸收峰,故在稳定性试验中采用530 nm 处波长吸光值作为参考值。

图1 天竺葵花色苷提取液的紫外—可见光光谱
图2为花色苷母核结构[9],是2-苯基苯并吡喃阳离子,属于类黄酮化合物[9]。B-环的R1和R2基团主要是—H、—OH 和—OCH3取代基不同决定着花色素的种类和颜色。花色苷结构上的基团可与多种结构反应,改变原花色苷的结构类型,从而改变其稳定性。
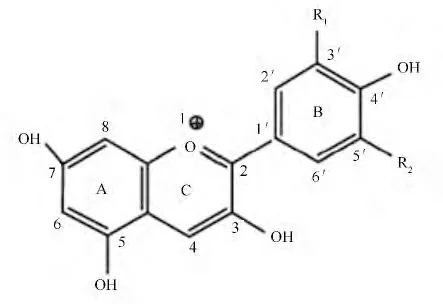
图2 花色苷母核结构
2.2 不同光、温度、pH 值、金属离子、糖和有机酸因子处理对天竺葵花色苷稳定性的影响
2.2.1 不同温度、作用时间对天竺葵花色苷稳定性的影响
将等量初始吸光度值为0.769 5 的天竺葵花色苷提取液分别置于水浴锅中30、40、50、60、70、80、90 ℃密闭条件下加热,对照组置于室温23 ℃,分别于30、60 min 取样测定其吸光度值(表1),从表1中可以看出,在30 min 短时间内,随温度的增加,吸光度值先增大后减小,且70 ℃时吸光度值升到最高;当持续加热60 min 时,随温度的增加吸光度值依次减小,且60 ℃前吸光度值减小缓慢,60 ℃后减小幅度增大。这说明天竺葵花色苷的稳定性与作用时间和温度有关。在30 min 短时间内,温度低于70 ℃时对天竺葵花色苷有一定的增色效果,70 ℃以前吸光度值随温度上升而增大,70 ℃时最大为0.790 1,80、90 ℃时吸光度值分别下降为0.766 3、0.761 7,均小于室温组。当时间达到60 min,温度达到60 ℃时,时间越长、温度越高天竺葵花色苷分解越迅速。Laleh et al.[10]推测,花色苷对温度的不稳定性可能是由高温下C3位上的糖基丢失引起的,糖基对于花色苷稳定性具有重要的作用,稳定性一般会随着糖基化程度的增加而增加。在以后的压花保色环节中可以利用其具有一定的耐热性这一特性,使天竺葵花材在短时间的加热条件下与保色剂发生很好的化学反应,以达到较好的保色效果。
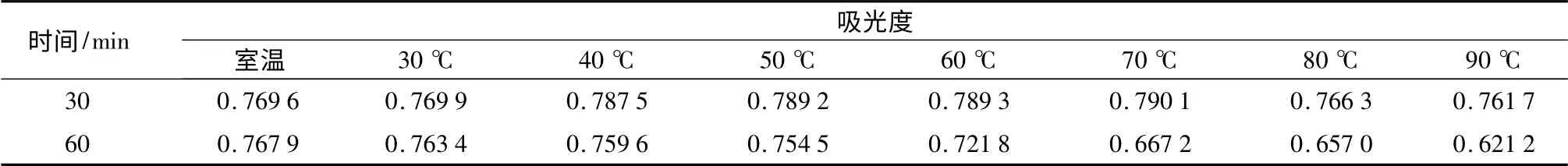
表1 不同温度、作用时间对天竺葵花色苷吸光度值的影响
2.2.2 不同光照对天竺葵花色苷稳定性的影响
光照对天竺葵花色苷稳定性的影响如表2所示,除紫外光照射在8 h 时吸光度值有一定程度的增大外,其他情况均随着光照时间的延长,吸光度值越来越小,保存率越来越低。室内黑暗条件下的保存率最高,第7 d 时还为95.73%,比室内自然光照保存率86.23%高9.50%,其次,紫外光照射保存率为89.84%,比室内自然光照保存率高3.61%,3 个灯管照射保存率最低,仅0.46%,褪色最快。且光照强度(不同个数灯管照射)与天竺葵花色苷的降解速率之间无线性关系。由此可见,光照是导致天竺葵花色苷降解的一个很重要原因。据分析,光照引起花色苷降解的途径可能为:花色苷首先降解生成C4羟基的中间产物,此中间产物在C2位上水解开环,最后生成查尔酮,查尔酮又快速降解成苯甲酸及2,4,6-三羟基苯甲醛等产物[11]。在今后的压花保色中,要达到预期保色效果必须解决这一难题。而紫外灯照射对天竺葵花色苷有一定增色作用的机理还需进一步研究。
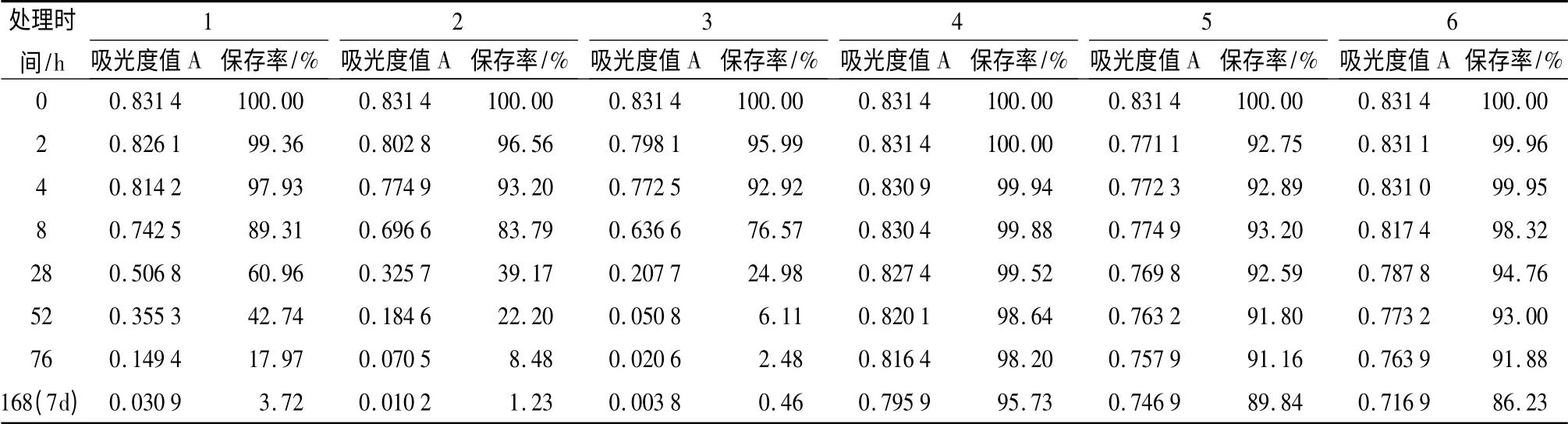
表2 不同光照对天竺葵花色苷稳定性的影响
2.2.3 不同pH 值对天竺葵花色苷稳定性的影响
2.2.3.1 不同pH 值下天竺葵花色苷颜色比较
将溶液调成固定pH 值,30 min 后测定其吸光度值,并记录颜色,结果见表3。
在溶液介质中,花色苷随pH 值的变化而发生结构上的转换,这几种结构分别为:Ionized quinonoidal anhydrobase(蓝色)、Neutral quinonoidal anhydrobase(紫色或浅紫色)、Flavylium cation(红色)、Carbinol pseudobase(无色)及Chalcone pseudobase(无色)[13]。从表3中可知,天竺葵花色苷随酸性的降低颜色变浅,在pH 值为5 ~7 时,几乎无色。随着碱性的增加,颜色逐渐由墨绿加深,pH 值为12 时,变为黄绿。可见,在较低的pH 值时(pH 值<2),据花色苷存在形式推测天竺葵花色苷主要以红色的花色烊阳离子形式存在;当pH 值为3 ~7 时,主要以无色的甲醇假碱和查酮假碱的形式存在,当pH 值继续上升时,以蓝色离子化的醌式碱存在形式越来越多。
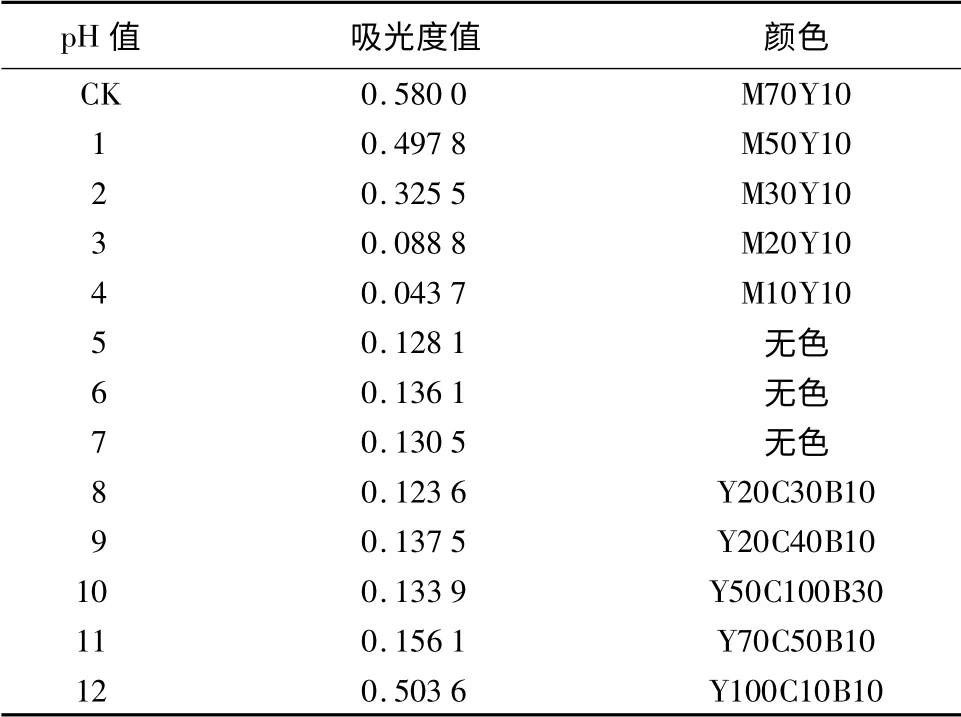
表3 经不同pH 值处理的天竺葵花色苷色彩差异
2.2.3.2 不同pH 值处理对天竺葵花色苷保存率的影响
分别在室温23,30、40 ℃下测定pH 值为1、2、3、4 时不同时间天竺葵花色苷的A530值,并计算保存率,结果如表4所示。天竺葵花色苷在不同温度、不同时间、不同pH 值条件下,降解速度有差异:同一pH 值不同温度条件下,随温度的升高保存率降低,但不存在线性关系,且随温度的升高降解速率加快。同一温度不同pH 值条件下,随pH 值的增加保存率减少,降解速率加快。
图3是室温(约23 ℃)条件下不同pH 值对保存率的影响。由图3可发现,天竺葵花色苷在pH 值小于1(ck)时,保存率下降速度开始平缓,以后速率加大。其他不同pH 值的保存率均在前8 h 下降迅速,以后趋于平缓。再据表4中23 ℃室温条件下1 个月后各pH 值的保存率可看出,pH 值为1 时,天竺葵花色苷降解速度最慢,保存时间最长。因此,在以后的保色剂配方优化中要充分利用天竺葵花色苷这一特性,以便选出最优保色剂,达到最好的保色效果。
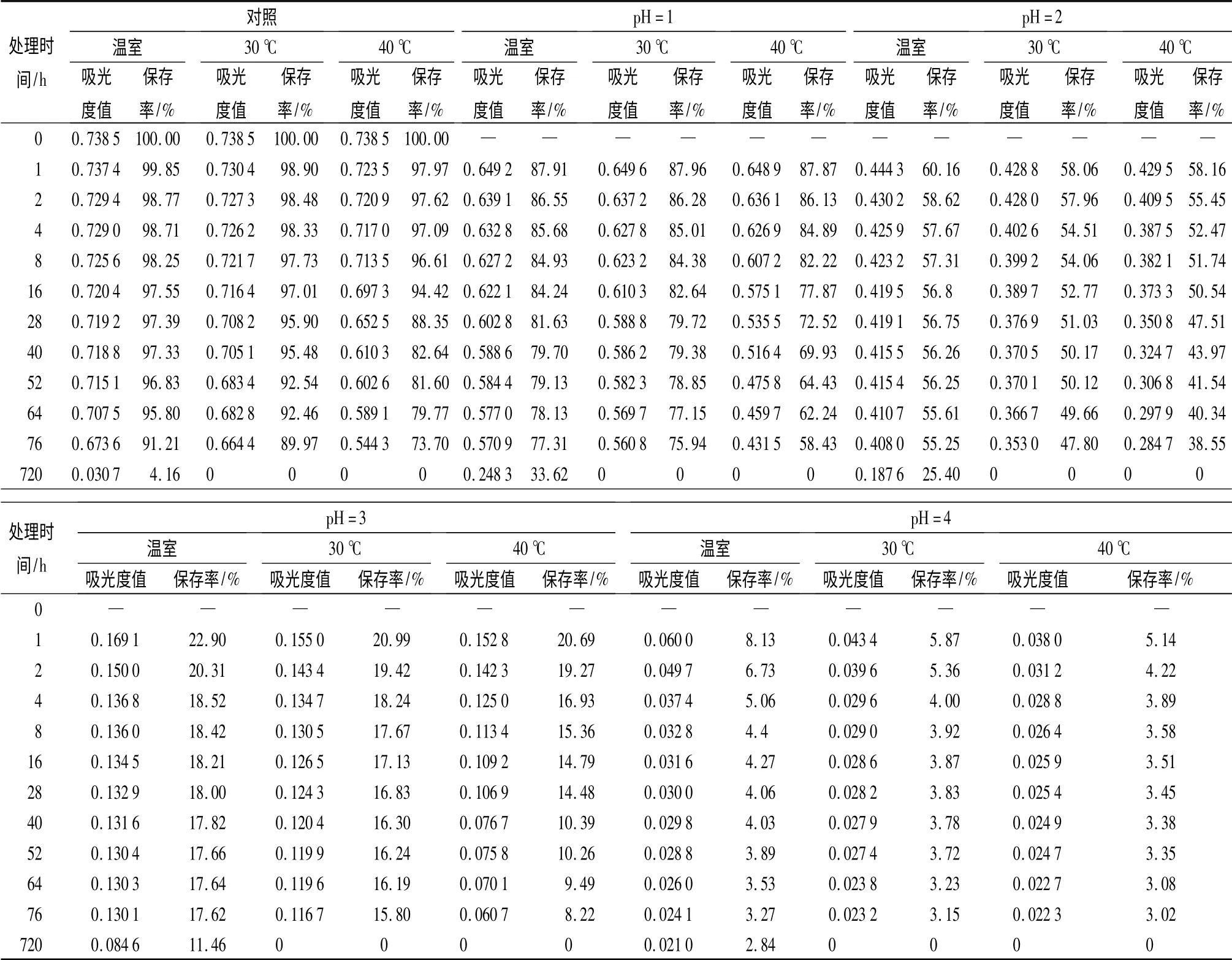
表4 不同pH 值、作用时间处理对天竺葵花色苷在A530下吸光度、保存率的影响
2.2.4 不同金属离子Na+、K+、Zn2+、Ca2+对天竺葵花色苷稳定性的影响
金属离子对天竺葵花色苷稳定性的影响结果如表5所示,不同金属离子对天竺葵花色苷溶液在A530下的影响各不相同。由表5可以看出,刚加入钠离子后,各吸光度值除0.050 mol·L-1浓度略低于对照外,其他各浓度的均有增加,以后又不同程度地降低,只有0.500 mol·L-1钠离子在所测定的时间内所测吸光度值始终高于对照,其余最后与对照几乎无差异。说明低浓度钠离子对天竺葵花色苷稳定性基本无影响。不同浓度的钾离子均使天竺葵花色苷溶液的吸光度值降低,且0.100 mol·L-1钾离子对其影响最大,说明钾离子对天竺葵花色苷稳定性起破坏作用。加入锌离子后前48 h,各浓度的吸光度值均小于对照,当72 h 时0.300、0.400、0.500 mol·L-1锌离子吸光度值高于对照,说明锌离子对天竺葵花色苷稳定性的影响随时间和浓度的不同而有很大变化。与对照相比,不同浓度的钙离子均使天竺葵花色苷溶液的吸光度值增加,且0.300 mol·L-1钙离子吸光度值增加最明显。说明钙离子对天竺葵花色苷有增色作用。钙离子的这一特性可以应用到以后天竺葵花材的保色中,以期达到更好的保色效果。
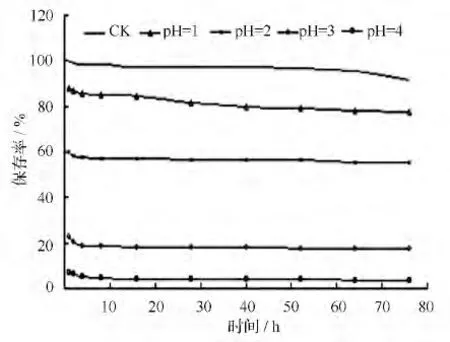
图3 室温(约23 ℃)条件下不同pH 值对保存率的影响
2.2.5 蔗糖、葡萄糖、苹果酸、柠檬酸处理对天竺葵花色苷稳定性的影响
由表6可以看出,随时间的推移(4 h 以后),各质量分数的蔗糖均可以明显地增加天竺葵花色苷的吸光度值,且当时间长达7 d 时,质量分数为10%的效果最明显,天竺葵花色苷的保存率最高达99.50%,质量分数为7%的次之,保存率为99.12%,分别高出对照12.71%和12.33%,说明蔗糖对天竺葵花色苷有很好的增色作用。葡萄糖质量分数为1%时吸光度值与对照最接近,第7 d 时保存率仅比对照低0.19%,但随着葡萄糖质量分数的增加吸光度值减小,说明葡萄糖对天竺葵花色苷的稳定性有破坏作用。在所测时间内,所有加入柠檬酸的天竺葵花色苷保存率均比对照高,质量分数为10%时效果最明显,第7 d 时天竺葵花色苷的保存率最高,达93.17%,质量分数为12% 时的次之,保存率为93.15%,分别高出对照6.38%和6.36%,说明柠檬酸能提高天竺葵花色苷的稳定性。低浓度的苹果酸(质量分数1% ~5%)对天竺葵花色苷的稳定性有破坏作用,高浓度(质量分数7% ~12%)有保护作用,应用中要注意质量分数的控制。
在试验的糖和有机酸中通过测定结果可以得出,蔗糖和柠檬酸是应用到天竺葵花材保色中的最适合保色剂。
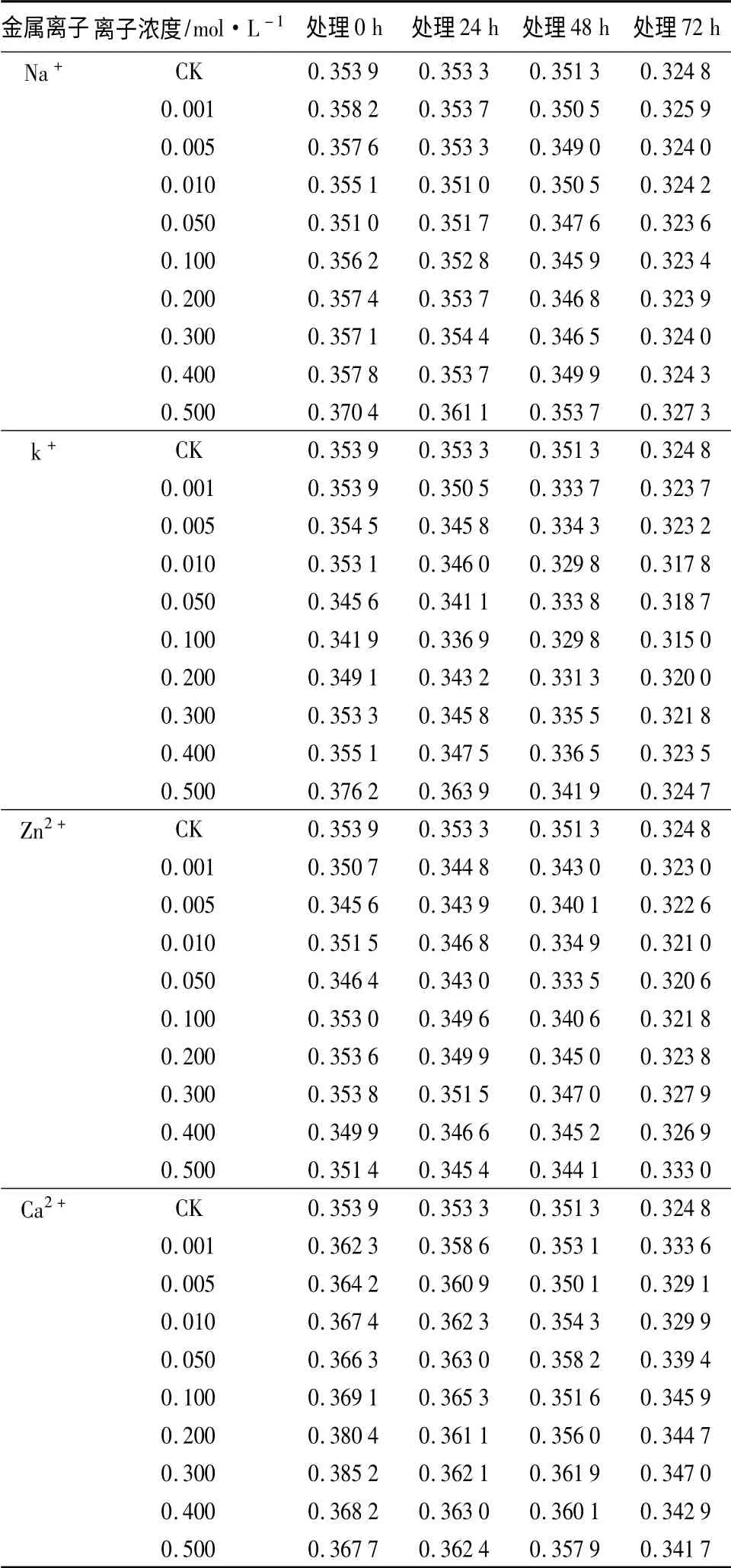
表5 不同浓度金属离子、作用时间处理对天竺葵花色苷在A530下吸光度的影响
2.3 天竺葵花瓣干燥保色剂优化配方的选择
根据前期的单因子试验,分别从糖、酸和金属离子中选出最佳试剂,然后将不同浓度组合调到最佳pH 值(pH=1)得到表7结果。由表7可知,在试验时间内,经组合后的保色剂均有很明显的保色效果,在试验中各组合吸光度值均先在短时间内增大,再随时间的延长逐渐减小。其中最好的组合为5%蔗糖+7%柠檬酸+0.01 mol·L-1Ca2+,在试验中6个月后保存率仍为87.20%,在天竺葵花材保色中有很好应用前景。值得一提的是,单因子试验中的最佳试剂浓度,组合后效果并不是最好,反应机理有待进一步研究。
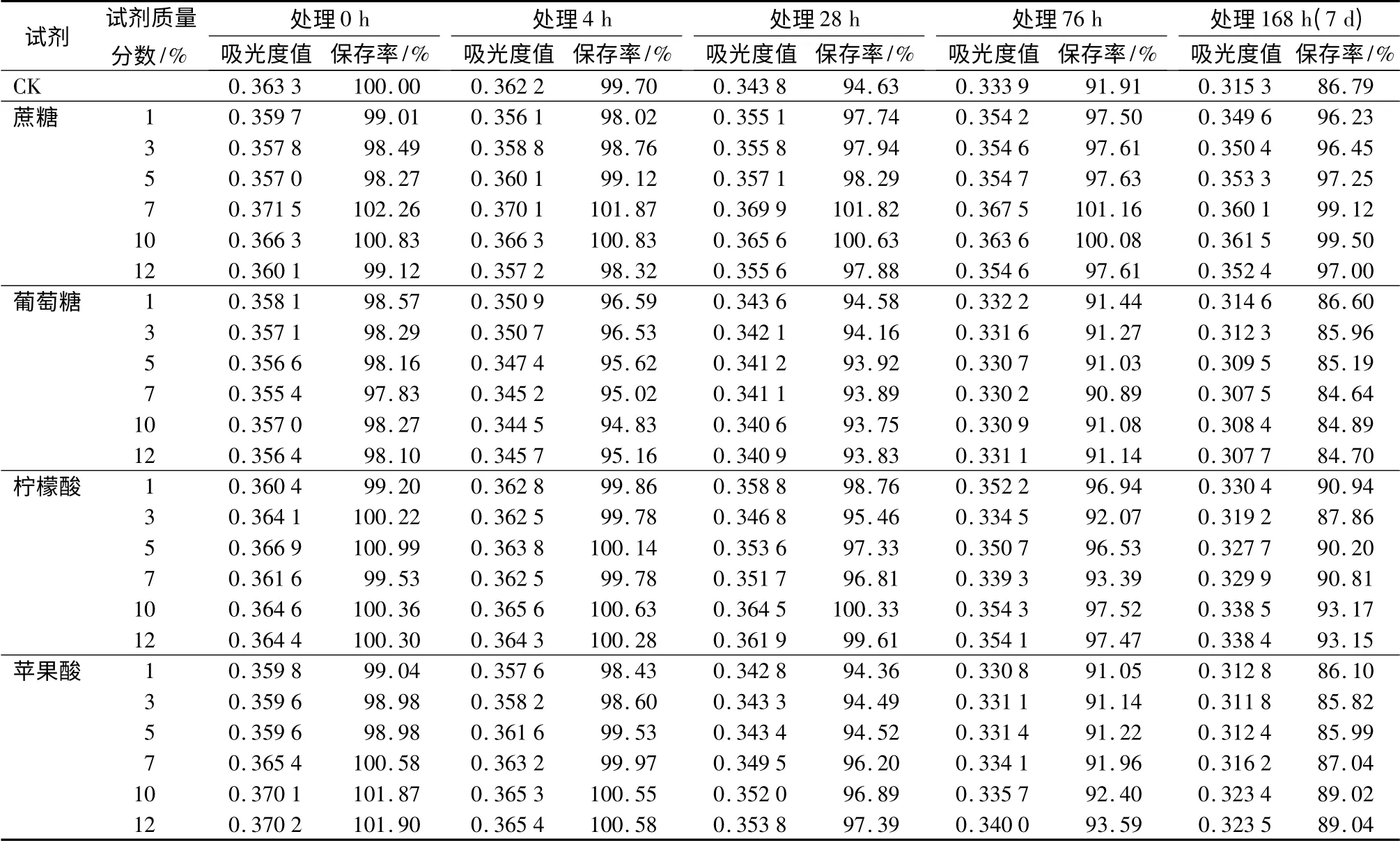
表6 不同质量分数蔗糖、葡萄糖、苹果酸、柠檬酸处理对天竺葵花色苷稳定性的影响

表7 不同质量分数蔗糖与柠檬酸添加0.01 mol·L -1Ca2+保色剂配方对天竺葵花色苷稳定性的影响
2.4 最优保色剂配方在压花保色中的应用
取4 等份新鲜天竺葵花瓣,每份花瓣30 瓣,颜色及形状大小相同,花瓣直径1.5 cm。分别浸没于30 mL 最优保色剂中0.5、1、1.5、2 h 取出,吸水纸上放24 h 后微波压花,其色彩经比色卡对比分别为M100B10、M100B10、M100、M90,新鲜天竺葵花瓣的颜色为M100。结果表明:浸泡时间为1.5 h 时保色效果最佳。分析其原因,可能与短时间(0.5、1 h)内花瓣对保色剂的吸收不充分、不能形成稳定的络合物有相关性。时间太长(2 h)时保色剂改变了花瓣细胞膜的透性,使部分花色苷渗出,减淡了天竺葵花瓣原有的色泽。
表8是对保色后天竺葵压花进行不同光照处理试验后的结果。由表8可以看出未经保色的天竺葵压花变色严重,而经过保色的天竺葵压花基本没有改变颜色,说明保色剂起到了很好的保色效果,可以在以后的天竺葵压花中进行应用。
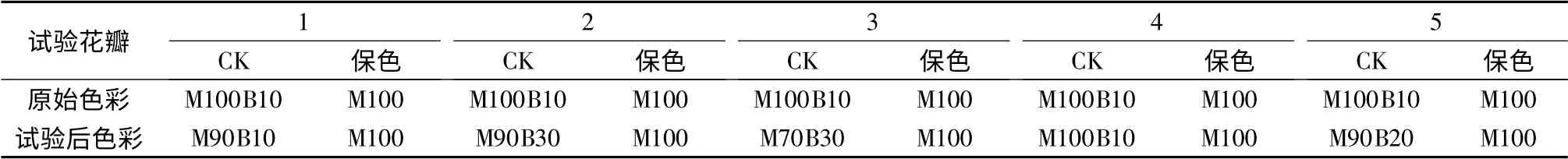
表8 天竺葵平面压花花材在不同光照条件下的色彩差异
3 结束语
天竺葵花材丰富,其花色苷水溶性、醇溶性好,易提取,醇酸水溶液中的λmax=530 nm。该花色苷具有一定的耐热性,耐光性较差,其中高温可导致天竺葵花色苷分子的几何异构化,光对花色苷影响较为复杂,有待进一步研究;不同的pH 值下天竺葵花色苷会呈现不同的颜色,酸性条件下随酸性的降低颜色变浅至无色,随着碱性的增大,颜色由墨绿加深,最后变为黄绿色(pH 值=12)。不同的pH 值对天竺葵花色苷的保存率构成很大影响。在以后的保色试验中应注意消除以上因素对天竺葵花色苷稳定性的影响。
在试验浓度、时间范围内,钠离子、钾离子对天竺葵花色苷影响不明显;锌离子随浓度和时间的增加有一定增色作用;钙离子增色效果明显;葡萄糖对天竺葵花色苷的稳定性有破坏作用;蔗糖、柠檬酸有显著的增色作用;低浓度(质量分数1% ~5%)的苹果酸有破坏作用,高浓度(质量分数7% ~12%)的有增色作用。
通过保色剂配方的优化选出最好的保色组合:pH 值为1 时,5%蔗糖+7%柠檬酸+0.01 mol·L-1Ca2+。经破坏性试验表明,其可以应用于天竺葵花材保色中,以延长压花艺术品中花色的保存时间,提高压花画的观赏效果。
[1] 徐玉安.押花画的制作[J].花卉园艺,2006(5):16-19.
[2] 赵国防,宗晶莹.试论压花艺术及发展前景[J].天津农林科技,2002,5:21-23.
[3] 洪波.干燥花制作工艺与应用[M].北京:中国林业出版社,2009:58-60.
[4] 洪波,刘香环.红色月季花瓣平面干燥技术与机理研究[J].园艺学报,2002,29(6):561-565.
[5] 兰伟,蔡建,胡庆菊.玫瑰花瓣干燥保色技术与机理研究[J].安徽农学通报,2007,12(4):71-72.
[6] 刘峄,刘占海,刘慧芹,等.珍珠梅压花花材染色与保色效果的研究[J].北方园艺,2011(12):145-147.
[7] 刘晓东,李鹏.非洲菊黄色素稳定性[J].东北林业大学学报,2012,40(5):67-70.
[8] 庞志申.花色苷研究概况[J].北京农业科学,2000,18(5):37-42.
[9] 孙建霞,张燕,胡小松,等.花色苷的结构稳定性与降解机制研究进展[J].中国农业科学,2009,42(3):996-1008.
[10] Laleh G H,Frydoonfar H,Heidary R,et al.The effect of light,temperature,pH and species on stability of anthocyanins pigments in four Berberis species[J].Pakistan Journal of Nutrition,2006,5(1):90-92.
[11] 陈健初.杨梅汁花色苷稳定性、澄清技术及抗氧化特性研究[D].杭州:浙江大学,2005.
[12] 姚根发,张洪德.四色配色手册[M].上海:上海科学技术文献出版社,2001:1-57.
[13] Brouillard R.Flavonoids and flower color[C]//Harborne J B.The flavonoids:advances in research since 1980.London:Chapman & Hall,1988:525-538.
——压制花材

