右美托咪定诱导睡眠平衡术治疗慢性原发性失眠症患者的护理
(第三军医大学大坪医院野战外科研究所 神经内科三病区,重庆400042)
流行病学调查[1]表明,成年人的慢性原发性失眠症的患病率大约为3%~5%,其危害甚大[2]。目前研究[1,3]认为,慢性原发性失眠症患者可表现出脑皮质过度觉醒状态。右美托咪定可作用于肾上腺素能相关受体,调节蓝斑-去甲肾上腺素能系统、上行网状激活系统等其他睡眠-觉醒通路的活动状态,降低患者的脑皮质过度觉醒水平,实现睡眠-觉醒系统的平衡稳定,改善患者的临床症状。我科采用右美托咪定睡眠诱导平衡术(dexmedetomidine induce sleep balance treatment,DISBT)治疗原发性失眠症患者,临床疗效较满意,现介绍如下:
1 临床资料
1.1 一般资料 2012年2-12月间,第三军医大学大坪医院野战外科研究所神经内科共收治了62例慢性顽固性原发性失眠患者。按入院时间先后将其分为观察组和对照组,每组31例。观察组男12例、女19例;年龄36~75岁,平均(48.2±9.8)岁。对照组男11例、女性20例;年龄32~76岁,平均(49.6±7.5)岁。纳入标准:(1)符合《美国精神障碍诊断和统计手册》中慢性原发性失眠症的诊断标准[4]。(2)患者入院前均按照《中国失眠定义、诊断及药物治疗共识》[5]接受常规治疗,治疗药物多于两类,治疗时间>3个月,但临床疗效差或无效。(3)自愿参加治疗,已签订临床知情同意书。排除标准:(1)存在严重心、肝、肾功能不全或其他严重躯体疾病。(2)血压异常(收缩压>150mmHg或<110 mmHg,1mmHg=0.133kPa);心率<60次/分;血糖控制欠佳(空腹血糖>7.0mmol/L)。(3)呼吸紊乱指数>30。(4)有头部严重外伤史、癫痫病史及异常脑电图表现者。(5)右美托咪定过敏的患者。(6)无法理解相关量表内容者。(7)妊娠期、哺乳期及短期内有怀孕计划者。两组患者在年龄、性别、受教育年限、病程、失眠严重程度等一般资料上的差异均无统计学意义(均P>0.05)。
1.2 治疗方案 对照组患者按照《中国失眠定义、诊断及药物治疗共识》给予综合治疗,具体内容如下:(1)尽可能寻找失眠病因,进行睡眠卫生教育,纠正患者不良的睡眠卫生习惯;(2)苯二氮艹卓类受体激动剂治疗;(3)认知-行为治疗。观察组患者在对照组综合治疗的基础上,给予DISBT治疗,每天9:00~10:00进行,1h/次,共3次。
1.3 评价指标 (1)匹兹堡睡眠质量指数[6]。主要包括睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、睡眠药物及日间功能等。(2)过度觉醒量表评分[3]。(3)睡眠结构[4]。(4)不良反应。
1.4 统计学处理 采用SPSS 15.0统计软件,计量资料以¯x±s表示,采用t检验;计数资料以百分比表示,采用描述性统计,以P<0.05或P<0.01表示差异有统计学意义。
1.5 结果
1.5.1 两组患者治疗前后匹兹堡睡眠质量指数的比较 治疗前,两组患者各因子分数的差异均无统计学意义(均P>0.05)。治疗后,观察组患者各因子评分均大幅度降低,差异均有统计学意义(均P<0.05)。治疗前后相比,两组患者匹兹堡睡眠质量指数总分、入睡时间、睡眠时间、睡眠效率均较治疗前下降,差异均有统计学意义(均P<0.05);观察组患者睡眠质量、睡眠障碍及日间功能分数较治疗前下降,差异有统计学意义(P<0.05),对照组患者相应因子分数较治疗前相比,差异无统计学意义(P>0.05)。具体情况见表1。
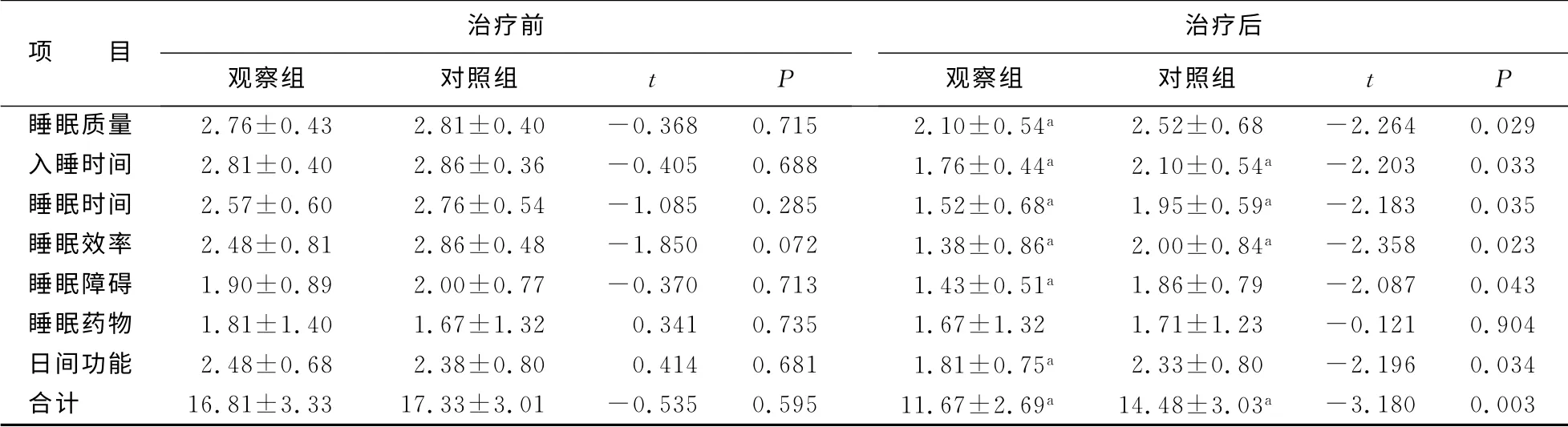
表1 两组患者治疗前后匹兹堡睡眠质量指数的比较(¯x±s,分)
1.5.2 两组患者治疗前后过度觉醒量表评分的比较 治疗前,两组患者过度觉醒量表评分的差异无统计学意义(P>0.05)。治疗后,观察组患者过度觉醒量表总分下降幅度较大,差异有统计学意义(P<0.05)。治疗前后,两组患者总评分均较治疗前有所下降,差异均有统计学意义(均P<0.05)。观察组患者极限个数总和、自省因子、反应因子均较治疗前下降,差异有统计学意义(均P<0.05);对照组患者相应因子分数,与治疗前相比,差异无统计学意义(P>0.05)。具体情况见表2。
1.5.3 两组患者治疗前后睡眠结构的对比 治疗前,两组患者脑电频谱各频段、各期睡眠比例的差异无统计学意义(P>0.05)。治疗前后,观察组患者Delta频段相对功率值及3期睡眠比例较治疗前上升,差异有统计学意义(P<0.05);Theta、Alpha、Beta、Gamma频段相对功率值及2期睡眠比例较治疗前下降,差异有统计学意义(P<0.05)。对照组患者Delta频段相对功率值、3期睡眠及快眼动期睡眠比例较治疗前下降,差异有统计学意义(P<0.05),Sigma、Beta、Gamma频段相对功率值及2期睡眠比例较治疗前上升,差异有统计学意义(P<0.05)。具体情况见表3。

表2 两组患者治疗前后过度觉醒量表评分的比较(¯x±s,分)
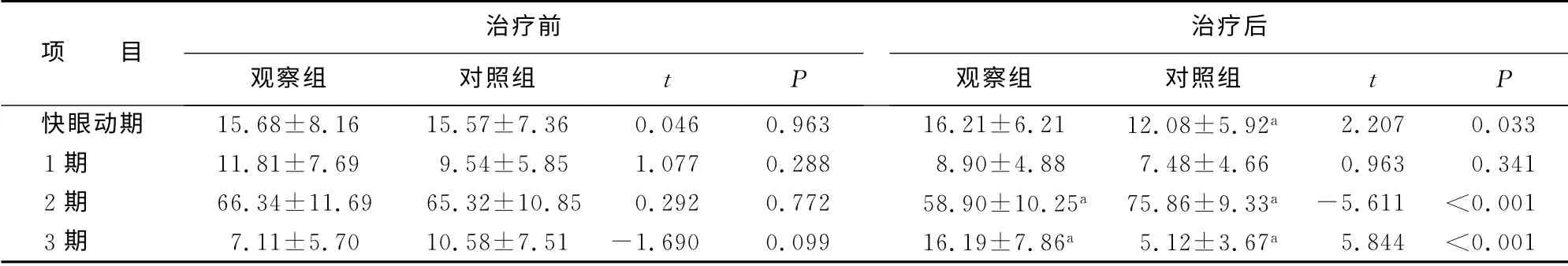
表3 两组患者治疗前后睡眠结构的对比(¯x±s,%)
1.5.4 两组患者出现的不良反应情况 对照组患者治疗中出现鼾声呼吸25例(40.3%)、呼吸道分泌物过多2例(3.2%)、心率减慢6例(9.7%)、血压降低3例(4.8%),经对症处理后均恢复正常,按预期完成治疗。1例(1.6%)因持续性心率、血压异常退出治疗。观察组患者治疗后出现头昏2例(3.2%)、胸闷1例(1.6%)、药物泵注部位痛疼不适3例(4.8%),经对症处理后迅速缓解,余无其他不良反应。
2 护理
2.1 治疗前护理
2.1.1 心理护理 患者失眠病史长,已接受过多种催眠药物治疗及相关非药物治疗,临床疗效欠佳。首次接触右美托咪定睡眠诱导平衡术,常感到好奇、期待,还可能有怀疑的心理。通过向患者详细介绍其作用机制、预期疗效、具体实施方法、可能的不良反应、患者的配合方法、重要性及注意事项,有利于患者初步了解DISBT治疗,事先做好心理准备,解除患了紧张、恐惧心理。
2.1.2 患者准备 患者入院后指导其完成匹兹堡睡眠量表测定、过度觉醒量表测定,确保测定结果的真实性及有效性,安排患者行睡眠呼吸监测及相关辅助检查。术日嘱患者着宽松病员服,取下尖锐饰物,禁食、禁水8h,防止治疗中出现呕吐和误吸,建立双通道静脉留置针,保障术中用药及时。术前排空小便。
2.1.3 用物准备 备好主要治疗药物右美托咪定,抢救药物阿托品、麻黄素等,床旁备心电监护仪、多导睡眠监测仪、脑电涨落测量仪、麻醉深度监测仪等监测仪器及微量注射泵,吸痰、吸氧装置,以及常规注射、输液用品等。保障患者治疗顺利进行。
2.2 治疗中护理
2.2.1 DISBT治疗实施及观察 患者用药前连接心电监护仪、脑电图电位涨落监测仪、麻醉深度监测仪等仪器,做好原始记录,以利术中对照。常规开放静脉通道,持续低流量吸氧,于上午9:00开始治疗,采用微量注射泵泵注右美托咪定,调节初始剂量为0.5μg/(kg·h),时间为10min,后调节维持剂量为0.2μg/(kg·h),时间为50min;用药期间密切观察患者情况,每5min监测记录1次各项指标,每隔15min唤醒患者询问其感受。根据患者反应调节药物剂量,患者无法进入睡眠状态或脑电图电位涨落、麻醉深度监测显示患者处于浅睡眠状态提示药物剂量不足,应适当增加药物剂量;患者出现鼾声呼吸、血压下降、心率减慢或脑电图电位涨落、麻醉深度监测显示患者处于深睡眠状态提示药物剂量过大,应适当减少药物剂量。
2.2.2 治疗期的安全管理 DISBT治疗由1名医师、1名麻醉医生、1名护士组成治疗小组,医生负责患者整体情况的把握,用药剂量安排;麻醉医生负责右美托咪定药物的应用及麻醉深度监测;护士按医嘱用药,调节好药物浓度、剂量。观察患者呼吸频率、节律及呼吸道通畅情况以及有无分泌物过多、鼾声呼吸情况出现,严密关注有无血压骤降、心率减慢等情况发生。如患者出现持续性心率<60次/min,给予阿托品0.5mg缓慢静脉推注以提升心率,收缩压低于100mmHg,给予麻黄素缓慢静脉推注收缩血管提升血压。鼾声呼吸可通过调整头部位置改善通气,分泌物过多时给予吸痰,给予对症处理后如患者症状仍无改善,或出现心律失常、顽固性低血压、休克症状等严重不良反应,立即停止DISBT治疗,配合医生积极抢救,确保患者安全。
2.2.3 治疗结束期的监护 诱导治疗结束后,在停止用药的1h内,患者仍可能出现安全问题,应由专人严密看护,观察患者意识状态、心率、血压情况及有无呼吸不畅、呕吐等情况,并给予对症处理。苏醒过程中患者可能出现躁动,应采取安全防护措施防坠床及拔出各种监测导线,直至患者苏醒才能撤除各种监护仪器,防止意外发生。患者苏醒后询问感受,对其主诉不适进行对症处理。
2.3 治疗后期护理 治疗期间责任护士观察患者睡眠状况,听取患者主诉,满足合理需求,为患者营造安静舒适的睡眠环境。适时做好睡眠卫生知识宣教,使患者掌握正确的睡眠卫生知识,养成良好的行为方式,纠正不良生活习惯。
2.3.1 心理和认知行为护理 失眠不只是睡眠生理紊乱的过程,还是一个心理紊乱的过程,部分患者对失眠存在认知偏差,认为失眠的病因可能主要是外界环境或自己身体的某些未知疾病。认知行为疗法主要作用于导致失眠的因素,通过纠正不良的睡眠卫生习惯,改变非适应的睡眠方式及合理睡眠信念的建立,降低自主唤醒和认知唤醒水平,根本上改正对睡眠的不合理信念和态度,从而实现治疗失眠和维持疗效的目标。其中认知干预一般由专业的心理治疗师来完成,而患者行为改变及维持效果则由护士督导完成。
2.3.2 睡眠卫生教育 具体做法包括:(1)安排合适的作息时间。顺应生物钟,每晚睡7~8h,午间小睡20~30min,以精神和体力的恢复作为睡眠的标准。(2)养成良好的睡眠习惯[8],白天参加适宜的有氧运动,睡前饮食适当,忌服引起兴奋的药物或饮料,如饮用咖啡、茶叶、酒,忌抽烟,避免睡前过度兴奋,在睡觉期间尽可能避免噪声、光线和过高的温度。(3)提高睡眠效率。只在有睡意时才上床,不能在床上阅读、看电视或工作,以提高睡眠效率。
2.3.3 提供促进睡眠的有效方法(1)指导患者运用放松技术放松全身肌肉;(2)热水浴可加速全身血液循环,放松肌肉和神经,有利于睡眠。(3)音乐疗法:入睡前听轻松柔美的音乐有助于舒缓紧张的神经,利于入睡。
2.4 出院指导 指导患者建立良好的遵医行为,确保治疗效果。(1)采取健康的生活方式,养成良好的睡眠卫生习惯,按时作息,保障充足睡眠时间;(2)指导患者按医嘱服药,定期复查,责任护士电话随访,促进患者建立良好的行为依从性;(3)保持心态平和,学会调节情绪,避免过悲、过喜等情绪剧烈变化。
3 体会
3.1 DISB治疗原发性失眠症的机制 原发性失眠症患者以入睡困难、睡眠维持障碍及睡眠质量差等为主要的临床表现[7],多导睡眠监测显示患者表现为睡眠潜伏期延长、浅睡眠增加及深睡眠减少等[8]。研究[1,3]表明,脑皮质过度觉醒是原发性失眠症的生理学特征,是其主要的发病机制。因此,若能降低患者的脑皮质觉醒水平则可能改善患者症状,从而治疗失眠[9]。目前,对于慢性原发性失眠的药物治疗主要以苯二氮艹卓类为主。苯二氮艹卓受体相关药物的作用靶点主要位于具有睡眠促进作用的下丘脑腹外侧视前叶区域[10],而对觉醒相关通路的抑制作用较弱。有报道[11]显示,右美托咪定为α2肾上腺素能受体的高选择性激动剂,可作用于肾上腺素受体,调节蓝斑-去甲肾上腺素系统的活动,从而改变机体的觉醒水平;具有独特的“易于唤醒”的特点,即患者在实现镇静催眠临床疗效的同时,患者可被迅速唤醒,刺激消失后,患者能在数秒至数分钟内很快再次入睡[12]。同时,右美托咪定还可通过对其他神经能末梢的肾上腺素能受体来发挥调节其他觉醒通路的作用[13]。本研究结果显示,DISBT治疗可使脑电频谱分析中快波比例减少,慢波比例增加,患者睡眠结构趋向正常,从而证实患者脑皮质觉醒水平下降;同时患者的过度觉醒量表分值也明显下降,匹兹堡睡眠质量指数的结果较对照组改善明显。因此,我们推断右美托咪定可作用于觉醒促进及睡眠促进系统,调节紊乱的睡眠-觉醒通路,全面降低脑皮质过度觉醒水平,从而治疗失眠。
3.2 DISBT治疗中护理管理的作用 研究[14]指出,右美托咪定可诱导出与自发性睡眠类似的睡眠期呼吸、心血管系统变化,安全性较高。但我们观察到诱导成功初始阶段,部分患者的心率、血压出现不同程度的波动。因此,严密的监护并及时调整诱导剂量显得尤为重要。因此,周密的护理是治疗顺利实施及患者安全的重要保障。
DISBT治疗纠正了患者紊乱的睡眠-觉醒通路,治疗后患者的睡眠状况得到良好改善,近期疗效确切,其远期疗效的维持与患者的遵医行为密切相关。目前认为,认知-行为治疗对慢性失眠效果确切,但起效时间慢,患者的依从性对疗效影响较大。因此,做好睡眠卫生知识指导及追踪随访使患者建立良好的依从性,是DISBT治疗后维持长期疗效的重要保障。
[1]Riemann D,Spiegelhalder K,Feige B,et al.The hyperarousal model of insomnia:A review of the concept and its evidence[J].Sleep Med Rev,2010,14(1):19-31.
[2]Le’ger D,Bayon V.Societal costs of insomnia[J].Sleep Med Rev,2010,14(6):379-389.
[3]Bonnet M H,Arand D L.Hyperarousal and insomnia:State of the science[J].Sleep Med Rev,2010,14(1):9-15.
[4]Roth T,Roehrs T,Pies R.Insomnia:Pathophysiology and implications for treatment[J].Sleep Med Rev,2007,11(1):71-79.
[5]失眠定义、诊断及药物治疗共识专家组.失眠定义、诊断及药物治疗专家共识[J].中华神经科杂志,2006,39(2):141-143.
[6]Backhaus J,Junqhanns K,Broocks A,et al.Test-retest reliability and validity of the Pittsburgh Sleep Quality Index in primary insomnia[J].J Psychosom Res,2002(53):734-740.
[7]王玥,朱国行.慢性原发性失眠的临床特点[J].中国临床神经科学,2011,19(6):601-605.
[8]张园,蒋晓江,胡银.心理生理性失眠伴发情绪障碍与抑郁性失眠多导睡眠图分析[J].中国临床神经科学,2008,16(4):361-363.
[9]Buysse D J,Germain A,Hall M,et al.A Neurobiological Model of Insomnia[J].Drug Discov Today Dis Models,2011,8(4):129-137.
[10]Saper C B,Scammell T E,Lu J.Hypothalamic regulation of sleep and circadian rhythms[J].Nature,2005,437(7063):1257-1263.
[11]Mantz J,Josserand J,Hamada S.Dexmedetomidine:New insights[J].Eur J Anaesthesiol,2011,28(1):3-6.
[12]Venn R M,Bradshaw C J,Spencer R,et al.Preliminary UK experience of dexmedetomidine,a novel agent for postoperative sedation in the intensive careunit[J].Anaesthesia,1999,54(12):1136-1142.
[13]Gilsbach R,Albarrán-Juárez J,Hein L.Preversus postsynaptic signaling byα(2)-adrenoceptors[J].Curr Top Membr,2011(67):139-160.
[14]Hsu Y W,Cortinez L I,Robertson K M,et al.Dexmedetomidine pharmacodynamics:Part I:Crossover comparison of the respiratory effects ofdexmedetomidine and remifentanil in healthy volunteers[J].Anesthesiology,2004,101(5):1066-1076.

