不同葡萄糖培养浓度对健康成人外周血白细胞G6PD活性及呼吸爆发功能的影响
曾慧妍,曹 瑛,薛耀明△
(1.广东省中医院内分泌科,广州510120;2.南方医科大学附属南方医院内分泌及代谢病科,广州510000)
糖尿病患者存在易感染的特点,既往研究显示这与白细胞功能受损密不可分[1-2]。外周血白细胞是固有免疫系统的主要组成部分,其杀菌能力在抵御外界微生物侵袭方面发挥着至关重要的作用。白细胞杀灭细菌的主要手段为呼吸爆发。因此,呼吸爆发功能正常与否决定了白细胞是否能有效实现机体免疫,减少感染发生。同时,呼吸爆发功能与糖代谢存在密切联系。葡萄糖-6-磷酸脱氢酶(G6PD)作为戊糖磷酸途径的关键酶,为呼吸爆发提供必需物质——还原型辅酶Ⅱ(NADPH)。因此,G6PD活性直接关系到呼吸爆发功能的正常发挥。作者的前期研究已发现,与健康成人相比,2型糖尿病患者外周血白细胞G6PD活性及细胞内活性氧(reactive oxygen species,ROS)水平均明显降低,存在明显的白细胞呼吸爆发功能障碍[3]。那么,正常人外周血白细胞在高浓度葡萄糖培养环境下是否也会和糖尿病患者一样出现白细胞呼吸爆发功能障碍呢?白细胞呼吸爆发改变是否与葡萄糖培养浓度有关?本实验拟以健康成人外周血离体白细胞为研究对象,探讨高糖环境培养浓度与健康成人白细胞G6PD活性及呼吸爆发功能之间的关系,为进一步研究糖尿病患者易感染的发病机制提供理论依据。
1 资料与方法
1.1 一般资料 收集健康成人外周血标本24例,其中,男14例,女10例,平均年龄(25.0±1.3)岁,为南方医院和广东省中医院健康体检者。无糖尿病家族史、无G6PD缺乏症家族史。无冠心病、肝肾功能不全等慢性病史。无恶性肿瘤、结缔组织病、器官移植术后、白血病等需使用细胞毒制剂和非选择性免疫抑制剂的病史。近期无服药史。白细胞计数在正常范围(4~10)×109/L;RPMI-1640培养基购自Gibcol公司;胎牛血清(fetalbovine serum,FBS)购自Hyclone公司;G6PD活性检测试剂盒购自中山生物工程有限公司;ROS检测试剂盒购自江苏碧云天生物技术研究所。
1.2 方法
1.2.1 细胞培养 收集健康成人外周血标本(EDTA抗凝)后,使用红细胞裂解液进行外周血白细胞的分离,离心后取管底白色沉淀,加入含有10%FBS的RPMI-1640培养液,轻轻吹打使其彻底混匀,37℃、5%CO2培养箱中静置培养,培养液中加青霉素、链霉素为1×105U/L。
1.2.2 实验分组 根据实验需要随机分为4组:5 mmol/L组(5 mmol/L D-葡萄糖培养)、15 mmol/L组(15 mmol/L D-葡萄糖培养)、25 mmol/L组(25 mmol/L D-葡萄糖培养)、高渗对照组(L-GLU组,20 mmol/L L-葡萄糖+5 mmol/L D-葡萄糖培养)。培养8 h后,每组分别取样本检测G6PD活性及ROS产量。
1.3 检测指标 四氮唑蓝定量测定法检测G6PD活性、荧光探针法检测细胞内ROS产量,操作均按照相关试剂盒说明书进行。各组细胞装载DCFH-DA荧光探针后,用激光共聚焦显微镜观察。每例样本随机抽取30个细胞,用Leica专用图像分析处理软件,对细胞内荧光密度进行分析。
1.4 统计学处理 采用SPSS17.0统计软件进行分析,计量资料以±s表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 4组G6PD活性及ROS产量的比较 5 mmol/L组与LGLU组的G6PD活性及ROS产量均无明显差异(均P>0.05)。与5 mmol/L组相比,15 mmol/L组及25 mmol/L组均出现不同程度的G6PD活性降低及ROS产量减少,且25 mmol/L组G6PD活性及ROS产量均显著低于15 mmol/L组(F=9.095,P<0.001),见表1。
2.2 4组G6PD活性及ROS产量变化 4组ROS荧光激光共聚焦显微镜下观察培养8 h后,5 mmol/L组及L-GLU组细胞内荧光无明显改变,保持中等强度荧光,多数细胞可见细胞核,部分细胞可见高强度荧光。15 mmol/L组及25 mmol/L组细胞内均出现荧光分布不均,荧光强度弱,个别细胞肉眼难以辨认细胞外形(图1)。
表1 4组G6PD活性及ROS产量变化(±s)

表1 4组G6PD活性及ROS产量变化(±s)
*:P<0.01,与5 mmol/L组比较;#:P<0.01,与15 mmol/L组比较。
组别 G6PD活性 ROS 产量5 mmol/L组1.37±0.14 196.73±19.79 15 mmol/L组 0.98±0.13* 130.30±17.59*25 mmol/L组 0.73±0.09*# 106.48±18.09*#L-GL U组 1.32±0.11 197.68±19.34 F 53.601 1 111.634 P 0.000 0.000
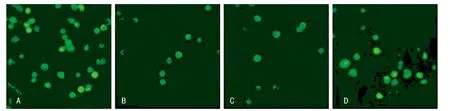
图1 各组ROS荧光变化
2.3 4组G6PD活性及ROS产量与葡萄糖培养浓度的相关性分析 培养8 h后,5 mmol/L组、15 mmol/L组及25 mmol/L组G6PD活性逐渐降低,ROS产量亦随之减少,G6PD活性、ROS产量分别与葡萄糖培养浓度呈负相关(r=-0.916,P<0.001;r=-0.951,P<0.001)。而L-GLU组ROS产量及G6PD活性与葡萄糖浓度之间无相关性。
3 讨 论
糖尿病患者易感染部分归咎于白细胞的吞噬杀菌作用降低。吞噬细胞的吞噬杀菌作用降低是糖尿病患者免疫功能紊乱的主要表现之一,这为细菌的侵入及繁殖创造了有利条件。大量研究发现,糖尿病患者血中的中性粒细胞的黏附、趋化、吞噬和杀菌能力均显著低于正常对照组,提示其易感染性与白细胞功能有一定的关系[4-5]。有学者将糖尿病患者外周血白细胞与葡萄糖和胰岛素一起培养可恢复其趋化性,提示其功能与糖代谢有关。血糖控制不良的糖尿病患者,其白细胞杀菌能力明显低于血糖控制良好者,提示白细胞内的杀菌能力与血糖控制程度有关。但高血糖改变白细胞功能的具体机制尚未有明确答案,目前关于该方面的国内外研究甚少。既往有学者研究发现,与健康成人相比,糖尿病患者中性粒细胞的吞噬能力明显下降且与血糖呈负相关关系,高糖环境是导致白细胞吞噬功能降低的重要因素[6]。
呼吸爆发是白细胞激活后行使杀菌功能的主要途径。当白细胞被激活后,能产生大量的ROS,并通过ROS杀死入侵的微生物和病原体。由于在这个过程中,白细胞的耗氧量急剧上升,甚至可达正常量的2~20倍,葡萄糖的代谢活动也明显增加,故将该现象称为“呼吸爆发”。NADPH作为呼吸爆发反应的惟一供氢体,是呼吸爆发的必需物质,其产量直接影响ROS的产生。而NADPH的生成仅仅来源于细胞内磷酸戊糖途径。因此,G6PD作为磷酸戊糖途径的限速酶,其活性对于呼吸爆发的正常发挥就显得尤为重要。前期研究发现,与健康成人比较,2型糖尿病患者存在明显的白细胞功能障碍,该结果与既往研究结果相符[4]。在本研究中,通过离体外周血白细胞培养再次验证了高糖培养环境对白细胞呼吸爆发功能的影响。本研究结果发现,在培养8 h后,15 mmol/L组和25 mmol/L组均出现G6PD活性及ROS产量显著下降,而5 mmol/L组无明显改变,L-GLU组用20 mmol/L的L-葡萄糖+5 mmol/L的D-葡萄糖联合培养细胞作为高渗对照则排除了渗透压引起各指标的改变。该结果进一步证实了上述葡萄糖浓度增高可导致白细胞呼吸爆发功能降低的观点。本研究还发现,随着培养基葡萄糖浓度的升高,健康成人白细胞的G6PD活性减弱,ROS释放量也随之下降且G6PD活性、ROS产量分别与培养基葡萄糖浓度呈负相关,提示细胞吞噬杀菌功能与其所处环境有关,高糖环境对离体培养的白细胞是一个刺激因素,糖浓度越高刺激强度越大。因此,推测高糖环境中G6PD活性降低导致细胞吞噬杀菌功能低下可能是糖尿病患者易于感染的主要原因之一。目前对两者关系的研究较少,国外仅Alba-Loureiro等[7]对此进行了研究,发现糖尿病可导致小鼠白细胞代谢与功能的明显改变,与正常小鼠相比,糖尿病小鼠的中性粒细胞、巨噬细胞和淋巴细胞G6PD活性均明显降低,提出白细胞G6PD缺乏可导致吞噬功能障碍、杀菌能力下降及过氧化物生成减少的观点,这与Moutschen[8]的观点一致。国内暂未发现类似的研究报道。本研究通过人离体细胞培养,对葡萄糖培养浓度、白细胞G6PD活性及呼吸爆发功能三者的内在联系进行了探讨,其结果与上述国外的研究结果相符[7-8]。
结合作者的前期研究,本研究从人离体细胞培养和临床研究两个层面对糖尿病血糖控制水平、白细胞G6PD活性及呼吸爆发功能三者的内在联系进行了初步探讨。然而,高糖是否单纯通过抑制G6PD活性来抑制白细胞呼吸爆发功能?是否还通过其他机制来抑制白细胞呼吸爆发呢?高糖导致G6PD活性降低的机制是什么?有待进一步的研究。
[1]Fedosova NF,Alisievich SV,Lyadov KV,et al.Mechanisms underlying diquertin-mediated regulation of neutrophil function in patients with non-insulin-diabetes mellitus[J].Bull Exp Biol Med,2004,137(2):143-146.
[2]Mc Manus LM,Bloodworth RC,Prihoda TJ,et al.Ago-nist-dependent failure of neutrophil function in diabetescorrelates with extent of hyperglycemia[J].J Leukoc Bi-ol,2001,70(3):395-404.
[3]曾慧妍,曹瑛,薛耀明,等.糖尿病患者外周血白细胞PPP途径代谢与呼吸爆发关系的初步研究[J].广东医学,2012,33(8):1136-1138.
[4]Cheadle WG.Risk factors for surgical site infection[J].Surg Infect(Larchmt),2006,7(Suppl 1):S7-11.
[5]Metha R,Petrova A.Neutrophil function in neonates bornto gestational diabetic mothers[J].J Perinatol,2005,25(3):178-181.
[6]Peleg AY,Weerarathna T,McCarthy JS,et al.Commoninfections in diabetes:pathogenesis,management and relationship to glycaemic control[J].Diabetes Metab ResRev,2007,23(1):3-13.
[7]Alba-Loureiro TC,Hirabara SM,Mendonca JR,et al.Diabetes causes marked changes in function and metabolismof rat neutrophils[J].J Endocrinol,2006,188:295-303.
[8]Moutschen M.Alterations in natural immunity and risk ofinfection in patients with diabetes mellitus[J].Rev MedLiege,2005,60(5-6):541-544.

