结直肠癌患者K-ras基因突变的表达及临床意义研究*
周 政,陈大鹏
(1.重庆三峡中心医院检验科,重庆万州404000;2.重庆医科大学附属儿童医院检验科,重庆400014)
随着人们的行为方式、饮食结构及自然环境的改变,结直肠癌发病率呈明显上升趋势。尽管作用机制仍未完全清楚,但多数研究认为K-ras基因突变是结直肠癌发生的早期事件,在结肠腺瘤癌变过程中发挥重要作用。西方人种结、直肠癌原发灶组织的K-ras基因突变率为30%~60%[1],而东方人种则为17%~28%[2]。西妥昔单抗竞争性阻断表皮生长因子受体(EGFR)和其他配体,从而抑制癌细胞的增殖,诱导癌细胞的凋亡,疗效比较明确。但研究表明K-ras基因突变可以导致对西妥昔单抗原发性耐药,检测K-ras基因点突变是保证分子靶向治疗有效的关键。
1 资料与方法
1.1 一般资料 2010年1~11月,随机选择本院初诊的212例结直肠癌患者。其中,男144例,女68例。按年龄分组:19~44岁,70例;45~59岁,52例;大于60岁,90例。按肿瘤部位分组:大肠弥散分布4例,直肠肿瘤108例,结肠肿瘤100例;按肿瘤分化程度分组:低分化肿瘤60例,中分化肿瘤144例,高分化肿瘤8例;按Dukes病理诊断分期分组:A期48例,B期72例,C期72例,D期20例。其中淋巴结转移84例。所有患者的临床诊断均由病理组织活检、临床表现、实验室检查确诊。按照2∶1的比例设对照,健康对照组由106名健康体检人员组成。
1.2 方法
1.2.1 标本处理 取受试者外周血3~5 mL乙二胺四乙酸(EDTA)抗凝,3 000 r/min离心15 min分离血浆,-80℃冷冻保存。用Hep G2细胞作为阳性对照(Hep G2细胞DNA稳定地含有K-ras 12密码子突变的SW480 DNA)。
1.2.2 DNA提取 采用Qiagen试剂提取血浆游离DNA。紫外分光光度仪测定DNA含量,应用3~5 mL外周血可获得约10μg游离DNA。
1.2.3 扩增 (1)检测基因组DNA看家基因globin:引物Globin-R:ATC AAG CGT CCC ATA GAC TCA C,Globin-F:GAT CTG TCC ACT CCT GAT GCT G,PCR产物196 bp。扩增条件:94℃3 min,然后依次94℃30 s、59℃30 s、72℃30 s,共35次循环,最后72℃10 min。反应结束后,取10μL产物进行20 g/L琼脂糖凝胶电泳,利用凝胶成像仪观察结果。(2)RE-PCR[3-4]:第1轮PCR体 系:1.5μmol/L Mg Cl2,1×PCR buffer,0.5 U Hot-Start Taq,200μmol/L d NTP,0.1 μmol/L pri mers[L-Ext(5′GCT CTT CGT GGT GTG GTG TCC ATA TAA ACT TGT GGT AGT TGG ACC T 3′),RExt(5′GCT CTT CGT GGT GTG GTG TCC CGT CCA CAA AAT GAT TCT GA 3′)]。扩增条件:95℃15 min,94℃30 s、52℃30 s,20次循环,72℃5 min 1次循环。扩增产物用Bst NI消化。1/20的消化产物进行第2轮Hot-Start PCR:1 μmol/L引物L-Bst(5′ACT GAA TAT AAA CTT GTG GTA GTT GGA CCT 3′),R-Bst(5′GTC CAC AAA ATG ATC CTG GAT TAG C 3′)。扩增条件:95℃15 min,94℃30 s、56℃30 s,40次循环,72℃5 min 1次循环。87 bp的扩增产物用Bst NI消化后进行聚丙烯酰胺凝胶电泳。K-ras阳性认定标准:终产物出现71 bp大小的片段。K-ras突变最终经DNA测序确定。
1.2.4 主要试剂及仪器 DNA提取试剂盒(组织DNA和血浆游离DNA)购自德国Qiagen公司;Premix Taq、Hot-Start Taq、Bst NI购自德国Qiagen公司;引物由上海英骏生物技术有限公司合成。紫外分光光度仪、PCR扩增仪、电泳仪及凝胶成像仪为美国BIO-RAD公司产品。
1.3 统计学处理 采用SPSS17.0软件进行分析处理,分类资料统计分析采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 血浆游离DNA提取结果 以看家基因globin扩增产物电泳作为血浆游离DNA提取物的鉴定结果。212例初诊患者标本中,血浆游离DNA均提取成功。106例健康对照组中均无血浆游离DNA提出(图1)。肿瘤中心组织均提取出DNA。

图1 血浆游离DNA PCR产物琼脂糖凝胶电泳图
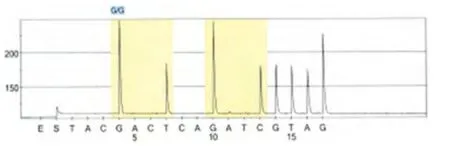
图2 K-ras野生型检测图谱
2.2 肿瘤中心病理组织K-ras突变检测结果 212例患者中发生K-ras突变(12密码子)的有33例(15.57%,33/212)。本研究共发现2个突变类型,12位密码子由GGT突变为GAT(图2、3);12位密码子由GGT突变为GTT(图2、3)。

图3 K-ras突变型检测图谱

表1 血浆游离DNA K-ras突变检测结果及与 病理组织、临床特征的关系
2.3 血浆游离DNA K-ras突变检测结果及与病理组织、临床特征的关系 212例患者同时进行活检标本和血浆游离DNA K-ras。检测结果34例患者血浆游离K-ras突变阳性(16.04%),33例患者病理活检标本阳性(15.57%),二者比较差异无统计学意义(χ2=2.31,P=0.31)。其中,1例患者肿瘤呈大肠弥散分布,2次病理组织活检结果均为阴性,而其血浆游离DNA分析结果为阳性,经多次活检后确定为黏液腺癌。K-ras基因突变与肿瘤的部位(结肠、直肠、弥散分布)无明显关系(χ2=3.34,P=0.61);与结直肠癌分化程度(高、中、低)无明显关系(χ2=2.38,P=0.29);与结直肠癌病理分期(Dukes分期)无明显关系(χ2=2.84,P=0.38);与结直肠癌有无淋巴结转移无明显关系(χ2=0.98,P=0.37);与结直肠癌患者年龄无明显关系(χ2=1.86,P=0.39)。见表1。
3 讨 论
肿瘤细胞持续释放DNA入血,导致外周血DNA增高且存在与原发肿瘤组织一致的分子生物学改变[5]。本研究结果显示肿瘤患者血液中确实存在健康人群不存在或是不能被检出的游离DNA。血浆游离DNA的检出量也与疾病进程相关。本研究在初诊患者中均检测到血浆游离DNA,而在疾病缓解期的患者中则未检出。在病情逐渐好转的情况下,患者血浆中的游离DNA浓度逐渐减低。因此,检测血浆游离DNA有助于肿瘤患者疾病进展情况的评估以及预后判断。
ras基因产物参与控制基因转录的激酶信号传导路径,因而能调节细胞的生长与分化。ras蛋白随ras基因的改变而发生变化,其结果是发生改变的ras蛋白不再具有裂解和释放GTP分子的能力,这种改变导致该信号传导路径始终处于“开通”的状态,从而导致细胞的生长和增生。ras过度表达导致持续的细胞增殖,这是肿瘤发生的关键一步,同时涉及多种肿瘤的发生,其中最常见的是结直肠肿瘤。结直肠肿瘤的治疗,外科手术是长期已确定的治疗方案,而新兴的肿瘤分子靶向治疗是一种全新的生物治疗模式[6-7]。K-ras基因是公认的癌基因,参与EGFR信号传导过程。基因突变患者抗EGFR治疗预后较差,导致不良反应,增加治疗费用;野生型患者就很可能从抗EGFR药物治疗中获益。因此,《美国国立癌症综合网络(NCCN)结直肠癌临床实践指南》(2008年第3版)明确提出检测K-ras基因。西妥昔单抗阻断K-ras蛋白的表达,将凋亡信号传递到胞核内,抑制细胞增殖,促进细胞凋亡。患者对西妥昔单抗原耐药可能与K-ras基因突变有关[8],指导分子靶向治疗的关键即是检测K-ras基因点突变的存在与否。针对K-ras基因点突变的检测,该研究发现血浆游离DNA与病理活检标本具有相同的阳性率、一致性和临床意义。其中1例患者初次病理活检未查出K-ras基因突变阳性,而其相应的血浆游离DNA查出K-ras基因突变阳性,患者经再次活检后检测出K-ras基因突变阳性。分析其原因:该例患者病变呈大肠弥散分布,造成了取材的困难。因此,在未获得病理证据时,血浆游离DNA的检测能够提供重要参考价值,为临床的早期诊断、辅助诊断提供帮助,同时也为患者的个体化治疗提供指导性的依据。全身各器官均可释放DNA入血,检测血浆游离DNA能够反映与体内肿瘤相关的异常基因,是肿瘤基因诊断的一种新方法。
本研究结果显示K-ras基因突变(12密码子)突变率为15.57%,12密码子突变有2种突变方式(12密码子由GGT突变为GAT;12密码子由GGT突变为GTT),与文献报道一致[9]。K-ras基因突变与患者年龄、Dukes分期、分化程度、肿瘤部位、有无淋巴结转移无明显相关性[10-13]。但也有文献[14]报道Dukes C期发生K-ras突变频率最高,结肠肿瘤发生突变频率比直肠高。
肿瘤组织与血浆K-ras基因突变率比较差异无统计学意义(P>0.05),血浆克服了组织标本取材困难的弊端。通过血浆游离DNA检测K-ras基因突变,方便、无创、快捷,能更好地应用于分子靶向药物的选择和临床综合治疗。
[1]Elbjeirami WM,Sughayer MA.K-RAS mutations andsubtyping in colorectal cancer in Jordanian patients[J].Oncol Lett,2012,4(4):705-710.
[2]高枫,唐卫中,李卫.中国人散发性大肠癌K-ras基因突变的研究[J].中华实验外科杂志,2010,22(1):65-67.
[3]Su YH,Wang M,Brenner DE,et al.Human urine contains small,150 to 250 nucleotide-sized,soluble DNA de-rived from the circulation and may be useful in the detection of colorectal cancer[J].J Mol Diagn,2004,6(2):101-107.
[4]Su YH,Wang M,Block TM,et al.Transrenal DNA as adiagnostic tool:important technical notes[J].Ann NYAcad Sci,2004,1022:81-89.
[5]Leon SA,Shapiro B,Sklaroff DM,et al.Free DNA in theserum of cancer patients and the effect of therapy[J].Cancer Res,1977,37(3):646-650.
[6]Fleischhacker M,Schmidt B.Circulating nucleic acids(CNAs)and cancer-a survey[J].Biochim Biophys Acta,2007,1775(1):181-232.
[7]Zavodna K,Konecny M,Krivulcik T,et al.Genetiec analysis of K-ras mutation status in metastatic ceolorectalcancer patienis[J].Neoplasma,2009,56(3):275-278.
[8]吴军.结肠癌K-ras突变与对西妥昔单抗耐药的实验研究[J].外科理论与实践,2009,14(4):396-402.
[9]Bai YQ,Liu XJ,Wang Y,et al.Correlation analysis be-tween abundance of K-ras mutation in plasma free DNAand its correlation with clinical outcome and prognosis inpatients with metastatic colorectal cancer[J].ZhonghuaZhong Liu Za Zhi,2013,35(9):666-671.
[10]Rossi L,Veltri E,Zullo A,et al.Metastatic colorectalcancer first-line treatment with bevacizumab:the impactof K-ras mutation[J].Onco Targets Ther,2013,6:1761-1769.
[11]Murray S,Karavasilis V,Bobos M,et al.Molecular predictors of response to tyrosine kinase inhibitors in patients with Non-Small-Cell Lung Cancer[J].J Exp ClinCancer Res,2012,31:77.
[12]Sameer AS.Colorectal cancer:molecular mutations andpolymorphisms[J].Front Oncol,2013,3:114[PMID:23717813 DOI:10.3389/fonc.2013.00114].
[13]Klatz,Niemeyer M,Zenker M.An unexpected new roleof mutant ras:Perturbation of human embryonic development[J].J Mol Med,2007,85(3):227-235.
[14]Deschoolmeester V,Boeckx C,Baay M,et al.K-RAS mutation detection and prognostic potential in sporadic colorectal cancer using high-resolution melting analysis[J].BrJ Cancer,2010,103(10):1627-1636.

