TGF-β1基因多态性与乙型肝炎肝硬化关系的Meta分析
薛敏敏 徐忠良 董公明 谢 芳 吴佩群 白 岚
肝硬化是一种常见的慢性肝病,在我国,乙型病毒性肝炎是引起肝硬化的主要原因[1]。肝硬化的病因和发病机制尚未完全阐明,细胞因子在其中的作用越来越受到关注。转化生长因子(TGF)-β1与多种组织或器官的纤维化性疾病密切相关。有研究表明,TGF-β1基因多态性与心肌梗死、系统性硬化、多发性硬化症、肝脏纤维化等多种疾病相关[2-3]。有关TGF-β1 509C/T、869T/C基因多态性与乙型肝炎肝硬化关系的研究较多,但是各研究结论不一致[4-7]。本研究运用Meta分析方法,对以往多个关于中国人群TGF-β1 509C/T、869T/C基因多态性与乙型肝炎肝硬化关系的病例对照研究的文献进行合并分析,旨在获得关于TGF-β1基因多态性与乙型肝炎肝硬化之间关系的可靠证据。
1 资料与方法
1.1 检索策略 以“肝纤维化或肝硬化,转化生长因子,基因”为检索词,在摘要和(或)全文中限定509或869位点,检索中国生物医学文献数据库、重庆维普中文科技期刊全文数据库、清华CNKI数据库、万方科技期刊全文数据库中自建库到2013年7月,发表的关于TGF-β1基因509位点、869位点多态性与乙肝肝硬化关系的文献,并通过Pubmed(检索词为“liver cirrhosis or hepatic fibrosis”and“TGF or transforming growth factor”and“gene”and“Chinese”)检索英文期刊或者有英文摘要的期刊上发表的关于中国人群的研究报道。并通过文献追溯的方式对该领域主要研究者的报道进一步查漏。1.2 文献的纳入与剔除 纳入标准:(1)国内或国外期刊发表的关于TGF-β1基因509位点、869位点多态性与中国人群乙型肝炎肝硬化相关性的病例对照研究。(2)病例组肝硬化标准符合中华医学会推荐标准。(3)对照组为无乙型肝炎的健康对照人群。(4)同一作者的重复文献或对同一人群的多次报道选择质量最好的一篇。排除标准:(1)文献中未提供病例与对照的来源或无对照、对照不符合要求的文献。(2)病例组未给出明确的诊断标准的文献。(3)资料收集方法不科学、分析不恰当的文献。(4)综述性文献。两名独立的文献搜集人员以互盲的形式分别对文献进行初级检索,确定初级检索内容后对文献进行纳入和剔除,对意见不一致的文献共同商讨而获得一致的意见。采用统一规范的数据提取表提取数据。
1.3 统计学方法 根据Meta分析的要求进行数据整理与合并,并与原始文献的数据进行核对,所有统计分析应用Rev⁃Man 5.1软件完成。TGF-β1基因位点多态性对乙肝肝硬化的风险采用OR及其95%CI进行描述,检验水准α=0.05。首先进行异质性检验,若纳入文献之间同质性较好,则采用固定效应模型进行分析;如果纳入文献之间异质性较大,则用随机效应模型进行分析。然后绘制漏斗图,对发表偏倚进行评估,并计算失效安全系数估计发表偏倚对结果的影响。
2 结果
2.1 纳入研究的基本特征 初检到191篇文献,根据以上纳入标准和排除标准,最终共纳入6篇病例对照研究文献。其中3篇文献同时包含509和869位点,2篇文献只包含509位点,1篇文献只包含869位点。纳入研究的TGF-β1基因509位点、869位点多态性分布见表1。
2.2 Meta分析结果
2.2.1 TGF-β1基因509位点T等位基因与乙型肝炎肝硬化的关系 异质性检验结果显示χ2=23.54,自由度为4,P<0.001,说明各研究间有异质性,采用随机效应模型进行Meta分析。乙型肝炎肝硬化病例组等位基因1 172个,健康对照组等位基因1 102个,以T等位基因为暴露因素,C等位基因为非暴露因素进行分析,结果显示OR=1.02,95%CI为(0.67~1.54),未发现509位点携带T等位基因者发生乙型肝炎肝硬化的危险性高于携带C等位基因者,见图1。
2.2.2 TGF-β1基因509位点TT和CT基因型与乙型肝炎肝硬化的关系 异质性检验结果显示χ2= 28.18,自由度为4,P<0.001,说明各研究间有异质性,采用随机效应模型进行Meta分析。乙型肝炎肝硬化病例组586例,健康对照组551例,以TT和CT基因型为暴露因素,CC基因型为非暴露因素进行分析,结果显示OR=0.80,95%CI为(0.36~1.78),未发现509位点TT和CT基因型发生乙型肝炎肝硬化的危险性高于CC基因型,见图2。

Table 1 Genetic distributions of TGF-β1 509 and 869 genes in all included studies表1 纳入文献的TGF-β1基因509位点、869位点多态性分布
2.2.3 TGF-β1基因869位点C等位基因与乙型肝炎肝硬化的关系 异质性检验结果显示χ2=11.69,自由度为3,P=0.009,说明各研究间有异质性,采用随机效应模型进行Meta分析。乙型肝炎肝硬化病例组等位基因742个,健康对照组等位基因752个,以C等位基因为暴露因素,T等位基因为非暴露因素进行分析,结果显示OR=1.05,95%CI为(0.69~1.62),未发现869位点携带C等位基因者发生乙型肝炎肝硬化的危险性高于携带T等位基因者,见图3。
2.2.4 TGF-β1基因869位点CC和TC基因型与乙型肝炎肝硬化的关系 异质性检验结果显示χ2= 12.09,自由度为3,P=0.007,说明各研究间有异质性,采用随机效应模型进行Meta分析。乙型肝炎肝硬化病例组371例,健康对照组376例,以CC和TC基因型为暴露因素,TT基因型为非暴露因素进行分析,结果显示OR=0.98,95%CI为(0.48~2.00),未发现869位点CC和TC基因型发生乙型肝炎肝硬化的危险性高于TT基因型,见图4。
2.3 发表偏倚的评估 以纳入的每个独立研究效应值OR为横坐标,标准误的倒数为纵坐标,对509T等位基因和869C等位基因绘制漏斗图。可以发现纳入Meta分析中的各独立研究效应值OR在坐标轴上围绕漏斗图的中心线散开,说明无明显的发表偏倚。同时利用失效安全系数计算公式:Nfs0.05=(∑Z/ 1.645)2-k对发表偏倚进行量化估计,经计算,509位点Nfs0.05=29,869位点Nfs0.05=12,分别需要相同病因作用且有统计学意义的各29篇和12篇新研究才能逆转本次Meta分析的结果,见图5、6。

Figure 1 Meta-analysis for association between T allele of TGF-β1 509 and liver cirrhosis图1 TGF-β1基因509位点T等位基因与乙型肝炎肝硬化关系的Meta分析

Figure 2 Meta-analysis for association between TGF-β1 509 polymorphism and liver cirrhosis图2 TGF-β1基因509位点TT和CT基因型与乙型肝炎肝硬化关系的Meta分析
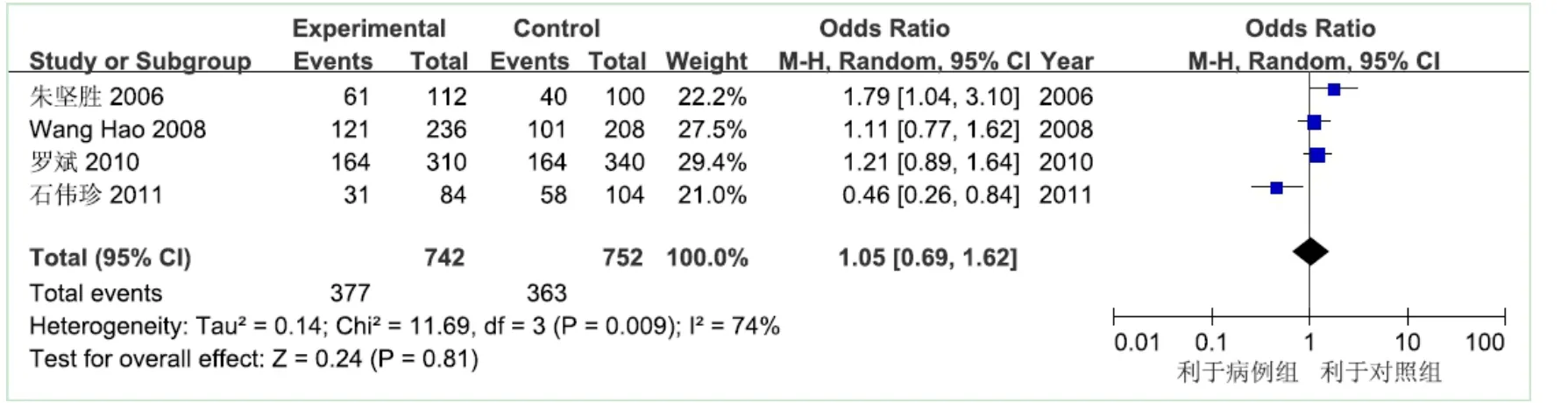
Figure 3 Meta-analysis for association between C allele of TGF-β1 869 and liver cirrhosis图3 TGF-β1基因869位点C等位基因与乙型肝炎肝硬化的关系的Meta分析

Figure 4 Meta-analysis for association between TGF-β1 869 polymorphism and liver cirrhosis图4 TGF-β1基因869位点CC和TC基因型与乙型肝炎肝硬化的关系的Meta分析

Figure 5 The funnel plots of 509 T allele publication bias图5 509T等位基因发表偏倚漏斗图

Figure 6 The funnel plots of 869 C allele publication bias图6 869C等位基因发表偏倚漏斗图
3 讨论
病例对照研究可以分析遗传因素在多因素复杂疾病中的作用,并可计算遗传因素危险性的OR值。由于单个研究中样本例数较小,常导致研究结果的不稳定,而Meta分析可以把具有相同研究目的的研究结果进行定量合并,以弥补单个研究的不足,从而提高检验效能,获得更为稳定的结果[10]。在肝脏发生病变时,TGF-β1是一种强效的促纤维化的细胞因子,可以通过刺激细胞外基质的合成并抑制其降解而促进纤维化的形成[11-12]。TGF-β1基因有多个位点具有多态性,包括:位于启动子区的-988、-800、-509,内含子区的+72,外显子区的869、code25[3]。其中509位点、869位点是研究较多的2个位点。近年来,关于TGF-β1基因多态性与乙型肝炎肝硬化的关系引起了国内外研究者的重视,但不同研究结果之间存在一定差异。本文通过检索国内外已发表的文献,对纳入的6篇不同地点、不同时间研究TGF-β1基因509位点、869位点变异与中国人群乙型肝炎肝硬化关系的数据进行分析,评价中国人群中TGF-β1基因多态性与乙型肝炎肝硬化的关联性及关联强度。
本研究表明,TGF-β1基因509位点、869位点多态性均与乙型肝炎肝硬化风险无关。这与张志强等[13]的研究结论不一致。笔者的研究也分别对509位点TT、CT基因型与CC基因型进行了对比分析,但未发现TT、CT基因型乙型肝炎肝硬化风险升高。笔者广泛搜索了TGF-β1基因与乙肝肝硬化的文献后新发现两篇509位点的研究[5,8],正是这两篇遗漏的研究造成了原研究TT基因型乙肝肝硬化风险升高的阳性结果。本次Meta分析纳入的栗华[4]与罗斌[5]的研究结论相反,其余研究为阴性结果。这也是造成本次Meta分析异质性大的原因。不同研究之间差异的原因尚不明确,但是Meta分析的思想就是搜索全面的证据来解决争议的问题,所以应纳入所有符合条件的研究而不是主观排除某一研究。关于869位点,石伟珍等[4]的研究是造成异质性的原因,但即使排除该研究,C等位基因的风险为T等位基因的1.25(95%CI:1.00~1.57)倍,CC和TC基因型的风险为TT基因型的1.33(95%CI:0.93~1.90)倍,差异仍无统计学意义。
对各种偏倚的控制从而提高结果的真实性和可靠性是Meta分析中非常重要的一个环节。为了减少Meta分析的偏倚,本研究联合使用了多种有效的文献检索途径,尽可能全面的检索相关文献,并发现了既往研究中遗漏的文献。在文献质量评估时参考英国牛津循证医学中心严格评价项目(Oxford criti⁃cal appraisal skill program,Oxford CASP,2004)的要求对纳入文献进行质量评价,剔除了无对照和重复报道的文献。本研究中引入的Wang等[8,14-16]的研究以相同的研究人群发表了4篇文章,在搜索之后笔者认真比对排除了王皓作为第一作者重复发表的2篇和杨再兴作为第一作者发表的1篇文章,只纳入了1篇质量较高的研究。另外,由于遗传因素在不同种族的作用有所不同,所以本研究限定只纳入在中国人群中进行的研究,以尽可能减少人种差异造成的偏倚。发表偏倚是影响Meta分析结果的重要因素,漏斗图的对称性可以对发表偏倚进行直观评估,本次研究中两个等位基因漏斗图未见明显不对称性,提示无明显发表偏倚。同时计算得出的509位点Nfs0.05=29,869位点Nfs0.05=12,即分别需要相同病因作用且有统计学意义的各29篇和12篇新研究才能逆转本次Meta分析的结果,说明发表偏倚的影响程度较小,可靠性较好。
本研究结果显示在中国人群中未发现TGF-β1基因509位点、869位点多态性与乙型肝炎肝硬化风险有关,但需要指出的是本次Meta分析只涉及单因素研究,未考虑到TGF-β1基因多态性与环境因素及多基因连锁的交互作用,而环境因素、多基因连锁的交互作用可能影响乙型肝炎肝硬化的易感性。
[1] 陆再英,钟南山,谢毅,等.内科学[M].北京:人民卫生出版社, 2008:446.
[2] Zhang L,Yan JW,Wang YX,et al.Association of TGF-beta1+869C/ T promoter polymorphism with susceptibility to autoimmune diseas⁃es:ameta-analysis[J].MolBiol Rep,2013,40(8):4811-4817.
[3] Bosco P,Ferri R,Salluzzo MG,et al.Role of the transforminggrowth-factor-beta1 gene in late-onset alzheimer's disease:impli⁃cations for the treatment[J].Curr Genomics,2013,14(2):147-156.
[4] 石伟珍,过建春,陈群伟,等.TGF-β1基因多态性与乙型肝炎肝硬化的相关性研究[J].医学研究杂志,2011,40(1):93-96.
[5]栗华,吴洪磊,吕卉,等.TGFβ 1和AT1R基因多态性与乙肝肝硬化遗传易感性及临床表型的关联研究[J].中华医学遗传学杂志, 2007,24(3):298-301.
[6]罗斌,王俊利,黄重敏,等.转化生长因子-β1基因单核苷酸多态性与乙型肝炎后肝硬化的相关性研究[J].中华医院感染学杂志, 2010,20(10):1389-1392.
[7] 朱坚胜,何泽宝,陈智,等.转化生长因子β1基因多态性与乙型肝炎肝纤维化的关系研究[J].中华传染病杂志,2006,24(6):410-413.
[8]Wang H,Zhao YP,Gao CF,et al.Transforming growth factor beta 1 gene variants increase transcription and are associated with liver cirrhosis in Chinese[J].Cytokine,2008,43(1):20-25.
[9] 姜在来,张玮,张辉,等.TNF-α、TGF-β1和IL-10基因多态性与乙型肝炎后肝硬化的关系[J].世界华人消化杂志,2009,17(31): 3263-3268.
[10]Evangelou E,Ioannidis JP.Meta-analysis methods for genomewide association studies and beyond[J].Nat Rev Genet,2013,14(6): 379-389.
[11]Baghy K,Iozzo RV,Kovalszky I.Decorin-TGFbeta axis in hepatic fibrosis and cirrhosis[J].J Histochem Cytochem,2012,60(4):262-268.
[12]Bi WR,Yang CQ,Shi Q.Transforming growth factor-beta1 induced epithelial-mesenchymal transition in hepatic fibrosis[J].Hepatogas⁃troenterology,2012,59(118):1960-1963.
[13]张志强,吴鸣宇,蔡兵.中国人群转化生长因子-β1基因多态性与乙型肝炎后肝硬化关系的Meta分析[J].中国医药导报,2011,8 (16):29-30.
[14]王皓,杨再兴,高春芳,等.TGF-β1基因多态性与肝炎后肝纤维化的相关性研究[J].第二军医大学学报,2004,25(12):1284-1287.
[15]Wang H,Mengsteab S,Tag CG,et al.Transforming growth factorbeta1 gene polymorphisms are associated with progression of liver fibrosis in Caucasians with chronic hepatitis C infection[J].World J Gastroenterol,2005,11(13):1929-1936.
[16]杨再兴,王皓,高春芳,等.转化生长因子β1基因多态性对乙型肝炎肝硬化的影响[J].中华医学杂志,2005,85(15):1021-1026.

