小干扰RNA阻断周期蛋白依赖激酶4对子宫内膜癌细胞生物学行为的影响
常军 刘玲芳 郑殊娟 张婵
1.四川省妇幼保健院妇科,四川 成都 610045;2.重庆市第三人民医院妇产科,重庆 400014
小干扰RNA阻断周期蛋白依赖激酶4对子宫内膜癌细胞生物学行为的影响
常军1 刘玲芳1 郑殊娟1 张婵2
1.四川省妇幼保健院妇科,四川 成都 610045;2.重庆市第三人民医院妇产科,重庆 400014
背景与目的:细胞周期蛋白依赖激酶4(cyclin-dependent kinase 4,CDK4)是调控细胞周期进程的重要激酶之一,有实验报道其在子宫内膜癌中呈高表达,但是其在子宫内膜癌细胞中的生物学功能及其可能机制还不十分明确。本研究旨在通过小干扰RNA(small interfering RNA,siRNA)沉默CDK4表达,并检测其对人子宫内膜癌HEC-1B细胞生物学行为的影响及其可能机制。方法:将化学合成的CDK4-siRNA转染至HEC-1B细胞;实时荧光定量PCR法检测转染前后细胞中CDK4的mRNA表达量变化;Western blot检测转染前后细胞CDK4、视母细胞瘤基因(retinoblastoma gene,Rb)及其下游p-Rb的蛋白表达量的变化;分别采用CCK-8法、流式细胞仪、Transwell肿瘤细胞侵袭实验检测细胞增殖、周期、凋亡以及侵袭能力的变化。结果:转染后HEC-1B细胞中CDK4 mRNA及蛋白表达均明显下降(P<0.01);抑制CDK4表达后,抑制HEC-1B细胞的增殖及侵袭,转染si-CDK4组细胞发生侵袭数为(117±21)个,而转染si-control组及未处理组分别为(269±39)个和(262±35)个,差异具有统计学意义(P<0.01);细胞转染后早期凋亡率为(21.7±3.5)%,较未处理组[(12.4±2.1)%]和si-control组[(11.8±1.9)%]明显增加(P<0.01);细胞周期分布发生变化,G1期比例增加(P<0.01),S期细胞比例降低(P<0.01);进一步的Western blot结果显示,抑制CDK4表达后,细胞内p-Rb表达下降,但是总Rb表达无明显变化。结论:针对CDK4基因的特异性小RNA干扰片段能够下调CDK4基因在子宫内膜癌细胞中的表达,抑制肿瘤生物学进程。
子宫内膜癌;RNA干扰;细胞周期蛋白依赖激酶4;视母细胞瘤基因
子宫内膜癌(endometrial carcinoma,EC)是危害女性健康的三大恶性生殖道肿瘤之一,其发病机制及治疗的研究一直是妇科肿瘤学界关注的热点。据2011年资料统计,在我国北京、上海等发达城市,EC的发病率已经跃居妇女生殖道恶性肿瘤的首位[1]。
细胞周期的紊乱是肿瘤发生的基本特性之一,近年多项实验证实,与周期调控相关的基因的表达异常介导了肿瘤的发生,如细胞周期蛋白D(cyclin D,CCND)、细胞周期蛋白激酶(cyclin dependent kinase,CDKs)、p53、p16、p27以及视母细胞瘤基因 (retinoblastoma,Rb)等[2]。CDK4是一类丝/苏氨酸激酶,是细胞周期重要调控分子之一,它能够特异地与周期蛋白D结合形成复合物,磷酸化下游的Rb,介导细胞周期由G1期向S期转化[3-4]。Berthet等[5]的实验证实,同时敲除CDK2和CDK4基因的小鼠具有胚胎致死性,并且心脏发育结构异常,将获得的胚胎成纤维细胞体外培养,发现其增殖能力明显受到抑制。目前,多项研究证实在EC组织中存在CDK4异常激活[6],并且与肿瘤组织的临床分期呈正相关,提示CDK4在EC的发生、发展中可能发挥着重要的作用。本实验通过靶向CDK4的RNA干扰(RNA interference,RNAi)技术阻断细胞中该基因的表达,进一步探讨CDK4对EC细胞的生物学行为影响及其可能机制,为EC的分子生物治疗提供一个新的分子靶点。
1 材料和方法
1.1材料
人EC细胞株HEC-1B购自中国科学院上海生命科学研究院;新生胎牛血清购于美国PAA公司;DMEM培养基、0.25%胰酶购买自美国Hyclone公司;实时荧光定量PCR试剂盒购自北京全式金生物技术有限公司;DharmaFECT 1转染试剂、si-CDK4/sicontrol干扰片段购自美国Thermo公司,为了提高转染效率,该公司提供的是4段CDK4干扰片段的混合体,其基因序列分别为:si-CDK4(1):5’-GCAAAGACCUACUUCU GAA-3’,si-CDK4(2):5’-GAAGAAGACUGG CCUAGAG-3’;si-CDK4(3):5’-UAACAGAU A U C G A U G A A C U-3’,s i-C D K 4(4):5’-GGCCUUGCCCGCAUCUAUA-3’;CCK-8试剂盒购自日本株式会社同仁化学研究所Dojindo;凋亡试剂盒PE Annexin V Apoptosis Detection Kit Ⅰ购自美国BD Biosciences公司;PI购自美国Sigma-Aldrich公司;RNasA购自美国Boehringer Mannheim公司;Transwell小室(8.0 μm孔径)以及Matrigel胶均购自美国BD公司;CDK4、Rb、p-Rb以及GAPDH的一抗,辣根过氧化物酶标记的山羊抗鼠、山羊抗兔HRP标记的二抗购于北京中杉金桥生物技术有限公司;X线片为柯达公司产品。
1.2 方法
1.2.1 细胞培养与转染
由于约80%的EC患者属于子宫内膜样腺癌(Ⅰ型EC),故本实验选用子宫内膜样腺癌组织分离出的永生细胞株HEC-1B进行实验(http://www.atcc.org)。HEC-1B细胞用含10%胎牛血清、10 U/mL青霉素和100 μg/mL链霉素的DMEM培养基中,37 ℃、CO2体积分数为5%的培养箱中培养,细胞呈贴壁生长。0.25%胰酶消化、传代。转染前1 d,以适合的密度传代细胞,取对数生长期的细胞进行转染。将化学合成的CDK6的siRNA按照Dhamafect 1转染试剂说明书分别转染至HEC-1B细胞中。根据处理方式的不同,细胞分为3组:si-CDK4组(细胞转染si-CDK4);si-con组(细胞转染si-control片段);untreated组(细胞仅转染转染试剂)。
1.2.2 实时定量PCR检测转染前后CDK4表达量的变化
转染换液后48 h,运用TRIzol法分别提取3组细胞的总RNA,根据逆转录试剂盒使用说明将RNA逆转录成cDNA,再以cDNA为模板,应用PRISM 7000型定量PCR仪(Applied Biosystemss)进行定量PCR检测,以GAPDH作为内参。检测引物设计CDK4顺义链:5’- ACCAGATGGCACTTACACCC-3’,CDK4反义链:5’-TCCACAGAAGAGAGGCTT TCG-3’;GAPDH顺义链:5’-TCAACGACCACT TTGTCAAGCTCA-3’;GADPH反义链:5’-GCTGGTGGTCCAG GGGTCTTACT-3’。PCR反应条件为95 ℃变性30 s,95 ℃退火5 s,60 ℃延伸20 s,循环40次,PCR扩增结束后绘制熔解曲线,对目的基因的表达采用 2-ΔΔCt法行相对定量分析。
1.2.3 CCK-8法检测细胞增殖活性
取转染后24 h的HEC-1B细胞,离心(1000 r/ min,半径10 cm,5 min)后重悬于新鲜完全培养基,铺于96孔板中,每个处理组设置5个复孔,每孔铺5 000个细胞(100 μL/孔),采用CCK-8试剂盒分别检测0、24、48和72 h时间点的细胞活性,在检测前2 h在每孔加入10 mL CCK-8液,37 ℃温育2 h后,用自动酶标平板阅读仪于450 nm波长处读取吸光值。
1.2.4 流式细胞仪检测细胞周期变化
转染换液后16 h,更换为无血清培养基,将细胞饥饿24 h后加入完全培养基,培养36 h后胰酶消化收集细胞,用预冷的磷酸盐缓冲液(PBS)洗2次。再将细胞重悬于100 μL PBS中,缓慢加入400 μL预冷的无水乙醇,室温固定1 h后离心(1000 r/min,半径10 cm,5 min)去乙醇。PBS洗涤细胞2次后再次重悬于100 μL PBS,分别加入50 μg/mL的PI和100 μg/mL的RNase A,4 ℃避光温育30 min,补加400 μL PBS过滤后480 nm波长进行流式检测。
1.2.5 流式细胞仪检测细胞凋亡变化
细胞转染后48 h (3%血清培养),用不含EDTA的胰酶消化贴壁细胞,PBS洗涤细胞2次。将5×105个细胞重悬于100 μL结合缓冲液中。加入5 μL PE标记的 Annexin-V和5 μL 7AAD染料,轻轻混匀后室温避光反应15 min。补加200 μL结合缓冲液,1 h内进行流式细胞仪检测。注意设置阴性对照和单阳对照,利用阴性对照组圈定细胞群,利用单阳对照调节补偿。Annexin-V(+)/7AAD(-)代表早期凋亡,Annexin-V(+)/7AAD(+)代表晚期凋亡和坏死,AnnexinV(-)/7AAD(-)代表阴性未凋亡,AnnexinV(-)/7AAD(+)代表机械损伤。本实验中选取AnnexinV(+)/7AAD(-)的细胞,计算凋亡细胞比例,绘制统计图。
1.2.6 体外侵袭实验检测细胞侵袭能力变化
将冻存于-20 ℃的Matrigel胶4 ℃过夜融化,用4 ℃预冷的无血清培养基稀释Matrigel至1 mg/mL,冰上操作。将40 μL稀释后的Matrigel胶包被小室多聚碳酸酯膜的上室面,37 ℃温育3~5 h,胶凝固后备用;细胞转染后24 h,取4×105个细胞重悬于400 μL无血清的培养基中,将细胞混合液加入到Matrigel胶的上层;小室的下层中加入含20% FBS的培养基作为趋化因子。37 ℃,CO2体积分数为5%条件下培养24 h后,取出小室,吸出小室中培养基,小心擦去上层细胞,PBS洗2次,甲醇室温固定10 min,0.5%结晶紫染色5 min,清水轻轻浸洗数次,倒置晾干,刀片揭膜,中性树胶封片。显微镜下随机计数6个视野穿膜细胞并进行统计。
1.2.7 Western blot检测细胞中相关蛋白水平变化
提取各组细胞中的总蛋白并用BCA法测蛋白浓度,取30 μg蛋白行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),湿转硝酸纤维膜(PVDF膜)后5%脱脂牛奶封闭1 h,分别与CDK4、Rb、p-Rb(1∶1 000)、GAPDH(1∶20 000)蛋白特异性一抗稀释液4 ℃温育过夜,TBST缓冲液漂洗5次,每次5 min,加入相应浓度的辣根过氧化物酶标记的二抗稀释液,室温1 h,TBST缓冲液漂洗5次,每次5 min,用ECL化学发光剂反应,暗室下显影。
1.2.8 统计学处理
所有研究均设3份平行试验,采用SPSS 15.0软件进行统计学处理。所有数据以均数±标准差 ()表示,两组间数据比较,采用t检验分析,两组以上数据比较采用方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 转染后CDK4及其下游基因在HEC-1B细胞中的表达
转染后48 h,运用实时荧光定量PCR技术检测HEC-1B细胞中CDK4的mRNA表达情况。结果如图1A所示,si-CDK4组HEC-1B细胞中CDK4的mRNA表达水平与untreated组及si-con组相比,分别下降约35% (P<0.001)和40% (P<0.001);而HEC-1B细胞的si-con组和untreated组CDK4表达量之间差异无统计学意义(P>0.05),表明转染干扰片段si-CDK4后,明显抑制了CDK4在HEC-1B细胞中表达。同时,我们运用Western blot法检测了转染后CDK4及其下游基因Rb及p-Rb蛋白表达变化。结果如图1B所示,拮抗CDK4表达后,细胞中CDK4及p-Rb表达量均明显降低,但是总的Rb表达无明显变化(图1B)。

图1 HEC-1B转染后细胞内CDK4及其下游基因表达Fig. 1 The expression of CDK4 and its downstream genes in HEC-1B cells upon transfection.
2.2 si-CDK4抑制HEC-1B细胞增殖
运用CCK-8法,我们分别检测了0 、24 、48及72 h时各组细胞的增殖活性,并绘制了细胞生长曲线。结果如图2所示,转染48 h后,si-CDK4组细胞的增殖能力较untreated组和si-con组细胞明显下降,差异有统计学意义(P<0.01),而untreated组和si-con组间细胞的增殖能力差异无统计学意义(P>0.05)。
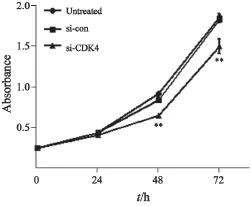
图2 si-CDK4对HEC-1B细胞增殖活性的影响Fig. 2 Effects of CDK4 siRNA on the proliferation of HEC-1B cells.
2.3 低表达CDK4后HEC-1B细胞周期分布发生改变
为了进一步检测转染CDK4干扰质粒后对细胞周期的影响,我们运用流式细胞术分析了转染后细胞周期的分布情况。如图3所示,si-CDK4组细胞中G1期比例为(64.9±4.1)%,较untreated组[(52.1±1.6)%]和si-con组[(51.4±1.3)%]明显升高(P<0.001),而S期细胞[(25.7±2.1)%]较untreated组[(37.2±3.3)%]和si-con组[(38.5±2.8)%]则明显减少(P<0.001),untreated组与si-con组细胞间差异无统计学意义(P>0.05)。表明si-CDK4能明显抑制HEC-1B细胞从G1期进入S期,阻滞细胞的周期进程。
2.4 低表达CDK4促进HEC-1B细胞的凋亡
HEC-1B细胞中si-CDK4组细胞的早期凋亡率为(21.7±3.5)%,较untreated组[(12.4±2.1)%]和si-con组[(11.8±1.9)%]明显增加(P<0.01),而untreated组和si-con组间差异无统计学意义(P>0.05)。表明抑制细胞中CDK4的表达能够明显促进HEC-1B细胞中的早期凋亡的发生。
2.5 si-CDK4抑制HEC-1B细胞的侵袭
运用Transwell侵袭实验进一步检测CDK4对肿瘤细胞侵袭能力的影响。结果显示,si-CDK4组平均穿膜细胞细胞数(117±25)个明显少于untreated组(269±39)个和si-control组(262±35)个,差异有统计学意义(P<0.01)。而si-con组和untreated组间差异无统计学意义(P>0.05),表明si-CDK4能抑制HEC-1B细胞的体外侵袭。

图3 si-CDK4对HEC-1B细胞周期分布的影响Fig. 3 Effects of si-CDK4 on the cell cycle distribution of HEC-1B cells.

图4 CDK4表达抑制对HEC-1B细胞凋亡的影响Fig. 4 Effects of CDK4 suppression on the HEC-1B cell apoptosis.

图5 转染si-CDK4后对HEC-1B细胞侵袭能力的变化Fig. 5 Effects of si-CDK4 on the invasion of HEC-1B cells(crystal violet staining, ×100)
3 讨 论
2001年,Elbashir等[7]将体外合成的siRNA片段运用于哺乳动物体内,抑制其体内特异基因的表达,之后越来越多的学者将siRNA运用于人类疾病治疗实验中。Kosciolek等[8]发现siRNA瞬时转染实验中,RNA干扰的效应呈现明显的剂量和时间依赖性的,具有分子药物代谢动力学特点,这将为肿瘤的分子治疗提供新的平台。本实验将CDK4-siRNA片段经脂质体转染法成功地转染至人ECHEC-1B细胞中,RT-PCR法及免疫印迹法检测发现细胞中CDK4的mRNA及蛋白表达水平均明显下降,表明干扰片段在EC细胞中成功发挥作用,有效抑制细胞内CDK4的表达。
细胞周期的有序调控是保证细胞进行生命活动的基本过程,细胞无限增殖将导致肿瘤的发生。G1/S期及G2/M期转化位点是细胞周期进行自控性调控的关键位点,当细胞受到损伤,细胞周期将停滞于限制点内,完成细胞内DNA损伤的自我修复,一旦这一调控失控,有可能导致细胞不断的自我增殖而介导恶性转化[9]。其中CDK4介导了细胞周期由G1期向S期转化,细胞中CDK4表达上调,将加速细胞周期进程,促进细胞增殖,导致肿瘤发生。李洪国等[10]的实验证实,运用米非司酮处理人EC细胞HHUA,能够明显抑制细胞内CDK4以及环氧合酶2(cyclooxygenase,Cox-2)的表达,抑制肿瘤细胞的增殖及裸鼠内肿瘤的增长,表明CDK4在EC的发生、发展中可能具有重要作用。
为进一步研究CDK4基因在EC生物学过程中的可能作用,我们对转染CDK4干扰片段的细胞进行生物学行为检测,比较转染前后细胞生物学行为的变化。结果显示,拮抗CDK4表达后,HEC-1B细胞的增殖能力明显下降,细胞的周期分布发生改变,处于G1期细胞比例增加,而处于S期的细胞比例下降,细胞的凋亡比例增加。这与Tran等[11]的结果一致,他们证实青蒿素能够通过抑制细胞中核转录因子(Nuclear factor-kappaB,NF-κB)信号通路活性,抑制CDK4表达,从而诱导EC细胞Ishikawa细胞周期停滞,表明CDK4在EC细胞中担当原癌基因,抑制其表达能够明显抑制肿瘤细胞的增长。同时这一生物学过程可能与其调节细胞中p-Rb表达相关,抑制CDK4表达,细胞中p-Rb表达下降,从而抑制下游与周期相关基因的表达,抑制细胞周期由G1期向S期转化有关。我们的实验也证实,抑制细胞中CDK4表达后,细胞内p-Rb表达下降,但是总Rb表达并不受影响。
此外,本实验中体外侵袭实验显示,沉默CDK4基因表达可明显降低EC细胞的体外侵袭能力,这可能是抑制了细胞中细丝蛋白A(filamin A,FLNa)的表达有关。Zhi等[12]的实验表明,抑制CDK4表达能够明显抑制乳腺癌细胞MDAMB-231中FLNa蛋白1459号位点丝氨酸的磷酸化,抑制其表达,从而抑制细胞的侵袭和迁移。FLNa是一类小GTP蛋白,参与细胞内调节肌动蛋白重塑、丝状伪足以及包膜褶皱的形成[13],这些都是细胞发生转移侵袭的重要步骤。因此,抑制其表达能够明显抑制上述生物学过程而抑制细胞的侵袭和迁移,但是CDK4在细胞中调节的具体机制还需要进一步的实验证实。
综上所述,本研究结果表明,运用特异性的siRNA能够有效地沉默CDK4基因在EC细胞中的表达,为研究其功能提供一个理想的技术平台;沉默CDK4基因在EC细胞中的表达能明显抑制细胞的增殖,诱导G1期细胞停滞及凋亡,降低细胞的侵袭能力,这将为进一步开展EC的基因治疗奠定理论基础。
[1]子宫内膜癌筛查委员会. 子宫内膜癌发病率跃居妇科恶性肿瘤首位[J]. 中华妇幼临床医学杂志, 2011, 7(6): 500.
[2]HANAHAN D, WEINBERG R A. The hallmarks of cancer[J]. Cell, 2000, 100(1): 57-70.
[3]PINES J. Cyclins and cyclin-dependent kinases: theme and variations [J]. Adv Cancer Res, 1995, 66: 181-212.
[4]LEONARD J P, LACASCE A S, SMITH M R, et al. Selective CDK4/6 inhibition with tumor responses by PD0332991 in patients with mantle cell lymphoma [J]. Blood, 2012, 119(20): 4597-4607.
[5]BERTHET C, KLARMANN K D, HILTON M B, et al. Combined loss of cdk2 and cdk4 results in embryonic lethality and Rb hypophosphorylation [J]. Dev Cell, 2006, 10(5): 563-573.
[6]SEMCZUK A, MITURSKI R, SKOMRA D, et al. Expression of the cell-cycle regulatory proteins (pRb, cyclinD1, p16INK4A and cdk4) in human endometrial cancer: correlation with clinicopathological features [J]. Arch Gynecol Obstet, 2004, 269(2): 104-110.
[7]ELBASHIR S M, LENDECKEL W, TUSCHL T. RNA interference is mediated by 21- and 22-nucleotide RNAs[J]. Genes Dev, 2001, 15(2): 188-200.
[8]KOSCIOLEK BA, KALANTIDIS K, TABLER M, et al. Inhibition of telomerase activity in human cancer cells by RNA interference [J]. Mol Cancer Ther, 2003, 2(3): 209-216.
[9]ELLEDGE S J. Cell cycle checkpoints: preventing an identity crisis [J]. Science, 1996, 274(5293): 1664-1672.
[10]李洪国, 赵兴波, 孟燕. 米非司酮对裸鼠子宫内膜癌细胞HHUA移植瘤生长及COX-2、CDK4的影响[J]. 中国癌症杂志, 2006, 16(4): 253-256.
[11]TRAN K Q, TIN A S, FIRESTONE G L, et al. Aremisinin triggers a G1 cell cycle arrest of human ishikawa endometrial cancer cells and inhibits cyclin-dependent kinase-4 promoter activity and expression by disrupting nuclear factor-κB transcriptional signaling [J]. Anticancer Drugs, 2013, 25(3): 270-281.
[12]ZHI Z, WEN S Y, CHUN H Z, et al. Cyclin D1/cyclin dependent kinase 4 interacts with filamin A and affects the migration and invasion potential of breast cancer cells [J]. Cancer Res, 2010, 70(5): 2105-2114.
[13]UEDA K, OHTA Y, HOSOYA H, et al. The carboxy-terminal pleckstrin homology domain of ROCK interacts with filamin-A[J]. Biochemical and biophysical research communications, 2003, 301: 886-890.
Effects of a small interfering RNA targeting CDK4 gene on the biological functions of endometrial cancer cells
CHANG Jun1, LIU Fang-ling1, ZHENG Shu-juan1, ZHANG Chan2(1.Department of Gynecology, the Sichuan Maternity and Child Health Hospital, Chengdu Sichuang 610045, China; 2.Department of Gynecology and Obstetrics, the Third People’s hospital of Chongqing Municipality, Chongqing 400014, China)
CHANG Jun E-mail: changjun505@126.com
Background and purpose:Cyclin-dependent kinase 4 (CDK4) is a kind of protein kinases regulating the cell cycle progression, which has been reported to be overexpressed in endometrial carcinoma tissues. But the role of CDK4 in endometrial carcinogenesis and relative mechanisms has not been identi fi ed yet. In this study, we used a small interfering RNA targeting CDK4, and explored the effects of CDK4 on endometrial cancer cells HEC-1B biological function and relative mechanisms.Methods:The chemically synthesized small interfering RNA targeting CDK4 (si-CDK4) was transiently transfected into HEC-1B cells; the quantitative real time-PCR assays and Western blot assays were performed to explore the mRNA and protein expression levels of CDK4 and its downstream genes, Rb and p-Rb, in HEC-1B cells upon transfection; Moreover, the CCK-8, fl ow cytometry (FCM) and invasion assays were performed to indentify the effects of si-CDK4 on the proliferation, cell cycle distribution, apoptosis and invasion abilities of HEC-1B cells, respectively.Results:The results showed that the mRNA and protein expressions of CDK4 were suppressed in HEC-1B cells upon transfection with si-CDK4 (P<0.01); Suppression of CDK4 inhibited cell proliferation and invasion of HEC-1B cells; the number of cells migrating through the transwell membrane in si-CDK4 group was 117±21, which was much fewer than the cells in si-control (269±39) and untreated groups (262±35) (P<0.01); the early apoptosis rate of cells treated with si-CDK4 [(21.7±3.5)%]was much higher than the untreated[(12.4±2.1)%]and si-control groups [(11.8±1.9)%](P<0.01); moreover, suppression of CDK4 increased cells in G1phase (P<0.01) and correspondingly decreased cells in S phase (P<0.01); further Western blot results showed that suppression of CDK4 down-regulated the expression of p-Rb in cells, but did not in fl uence the expression of total Rb.Conclusion:CDK4-siRNA speci fi cally and ef fi ciently blocks the constitutively activated CDK4 in human endometrial cancer cells HEC-1B, resulting in tumor suppression.
Endometrial carcinoma; RNA interference; Cyclin-dependent kinase 4; Retinoblastoma
10.3969/j.issn.1007-3969.2014.04.009
R737.33
A
1007-3639(2014)04-0292-07
2014-01-08
2014-03-05)
常军 E-mail:changjun505@126.com

