miR-486-5p对胃癌细胞株SGC7901生物学行为的影响
李明 连海峰 刘成霞 胡营滨 李有杰
1.滨州医学院附属医院消化内科,山东 滨州 256603;2.滨州医学院肿瘤分子生物学重点实验室,山东 烟台 264003
miR-486-5p对胃癌细胞株SGC7901生物学行为的影响
李明1* 连海峰1 刘成霞1 胡营滨1 李有杰2
1.滨州医学院附属医院消化内科,山东 滨州 256603;2.滨州医学院肿瘤分子生物学重点实验室,山东 烟台 264003
背景与目的:既往研究表明微小RNA-486-5p(miR-486-5p)在多种肿瘤的进展中起重要作用,但其在胃癌中作用的研究较少,本研究旨在探讨miR-486-5p对胃癌细胞株SGC7901增殖、凋亡及迁移能力的影响。方法:使用实时定量PCR(quantification real-time PCR,qRT-PCR)检测胃癌细胞株SGC7901及胃黏膜上皮细胞GES-1中miR-486-5p的表达,构建miR-486-5p过表达质粒,使用脂质体法瞬时转染胃癌细胞株SGC7901,qRT-PCR检测转染细胞后miR-486-5p的表达丰度,噻唑蓝(MTT)法及流式细胞仪检测细胞的增殖及凋亡情况,Transwell小室迁移实验检测细胞的迁移能力。结果:miR-486-5p在SGC7901细胞中表达明显下调,SGC7901细胞转染miR-486-5p过表达质粒后,miR-486-5p表达明显上调,细胞增殖、迁移能力降低,凋亡率增高,差异均有统计学意义(P<0.05)。结论:miR-486-5p可抑制胃癌细胞株SGC7901的增殖和迁移。
胃癌;微小RNA-486-5p;增殖;凋亡;迁移
胃癌是源自胃黏膜上皮的恶性肿瘤,发病率和病死率在我国恶性肿瘤中均居首位,世界范围内胃癌是第二位致患者死亡的恶性肿瘤。尽管近年来胃癌的诊断和治疗取得了较大的进步,但患者的总体治疗效果和预后仍不理想,尤其是进展期的胃癌患者。胃癌的发生是一个多基因参与、多步骤完成的复杂生物学过程,对胃癌发病的具体病因及确切的发病机制目前尚不清楚,因此从不同的分子水平探求胃癌发生的机制对于制定新的治疗策略具有重要的临床意义[1]。
微小RNA(microRNA,miRNA)是近年来备受关注的内源性非编码RNA,长约21~25 nt,广泛存在于真核细胞中,进化上具有高度保守性,表达水平具有组织特异性和时相性。在人体内,miRNA可与mRNA 3’非转录区(3’untranslated region,3’UTR)互补结合,当miRNA和靶mRNA完全配对时诱导mRNA降解,不完全配对时则抑制靶基因的翻译。一条miRNA可调控多个靶基因,而一个mRNA可同时接受数个miRNA的调控,故miRNA可在细胞内形成复杂的网络调控系统,参与细胞增殖、分化、凋亡及免疫防御等生理功能的调节,影响生命整个生命过程。研究表明miRNA基因多位于易发生断裂、缺失、移位的染色体脆性位点,因而miRNA在肿瘤的发生、发展过程中发挥着重要的作用,miRNA有望成为肿瘤治疗的新分子靶点[2-3]。
微小R-486-5p(miR-486-5p)是新近发现的一种miRNA,Navon等[4]使用微阵列方法证实miR-486-5p在胰腺癌、结肠癌、肝癌、肺癌、淋巴瘤、卵巢癌、前列腺癌、睾丸癌的表达均下调。Wang等[5]研究发现miR-486-5p在肺癌组织中表达下调,体外实验证实miR-486-5p通过作用于ARHGAP5发挥抑癌作用。Mees等[6]发现has-miR-486-5p和胰腺导管腺癌的进展密切相关。目前关于miR-486-5p在胃癌中的研究较少,本研究首先检测胃癌细胞株和胃黏膜上皮细胞中miR-486-5p的表达,然后使用脂质体法将miR-486-5p过表达质粒转入胃癌细胞株SGC7901,上调SGC7901细胞内miR-486-5p的表达,探讨miR-486-5p对SGC7901细胞增殖、凋亡及迁移的影响。
1 材料和方法
1.1 细胞及质粒
胃癌细胞株SGC7901购于武汉博士德公司,胃黏膜上皮细胞GES-1由重庆医科大学王璐璐博士惠赠;miR-486-5p过表达质粒(GV214-miR)由上海吉凯公司构建、合成。合成miR-486-5p前体序列并在两端设计BamHⅠ/ HindⅢ酶切位点,插入GV214多克隆位点,同时构建阴性质粒(GV214-NC,表1) 。
1.2 主要试剂
RPMI-1640培养基、标准胎牛血清、0.25%胰蛋白酶购自Hyclone公司,LipofectamineTM2000购自Invitrogen公司,总RNA提取试剂、逆转录试剂盒、实时荧光定量 PCR试剂盒购自宝生物工程(大连)有限公司,荧光实时定量PCR引物由广州锐博有限公司设计合成,MTT购自Promega公司,Transwell小室购自Corning公司,AnnexinⅤ-FITC/PI双染细胞凋亡检测试剂盒购自南京凯基生物公司。
1.3 细胞培养
SGC7901细胞以含10%胎牛血清的RPMI-1640培养基在37 ℃、CO2体积分数为5%的培养箱中常规培养,每2~3 d用0.25%的胰蛋白酶消化、传代,取对数期细胞用于实验。

表1 miRNA-486-5p序列及相关NC的序列Tab. 1 The miRNA-486-5p sequence and related NC sequence
1.4 实时定量PCR(quantification real-time PCR,qRT-PCR)检测GES-1、SGC7901细胞中miR-486-5p的表达
收集处于对数生长期的两种细胞,按以下步骤操作:①按照TRIzol试剂说明提取总RNA,1%的琼脂糖变性凝胶电泳检测RNA的完整性,紫外可见分光光度计检测RNA的纯度和浓度;②按逆转录试剂盒逆转录得到cDNA,反应条件如下:70 ℃ 10 min、冰育2 min、42 ℃ 60 min、70 ℃ 10 min;③qRT-PCR反应参数设置:95 ℃20 s;95 ℃ 5 s,60 ℃ 20 s,72 ℃ 5 s,40个循环,每个样品做3个平行管,每次实验至少重复3次;④数据分析 miR-486-5p相对表达水平用2-ΔΔCT方法计算(CT值是目标扩增产物打到设定阈值所经历的循环数),内参为U6基因。
1.5 miR-486-5p过表达质粒瞬时转染SGC7901细胞
取对数生长期细胞1×106个接种于6孔板,置于37 ℃、CO2体积分数为5%的培养箱中培养至细胞密度70%后,将细胞分为3组:单纯RPMI-1640培养组、GV214-NC质粒转染组、GV214-miR过表达质粒转染组,将培养基换成无血清、无双抗的RPMI 1640培养基(每孔1 mL),质粒及转染试剂LipofectamineTM2000分别用100 μL PRMI 1640培养基稀释后,以质粒(μg)∶脂质体(μL)=1∶2的比例混匀后静置30 min,逐滴加入并轻晃混匀,培养6 h后换为含完全培养基,48 h后收集细胞进行下一步分析。
1.6 qRT-PCR检测转染细胞miR-486-5p丰度
转染48 h后收集细胞各组细胞,其他步骤同1.4。
1.7 噻唑蓝(MTT)比色法检测细胞增殖
取对数生长期细胞,每孔1×104接种于96空板,共分3组:空白对照组、GV214-NC质粒转染组和GV214-miR过表达质粒转染组,每组设5个复孔,常规培养至细胞密度70%左右,后两组分别转染,方法同上,与24、48及72 h分别呈色一块板。呈色反应:吸取旧的培养基,每孔加入MTT(5 mg/mL)20 μL,继续培养4 h后弃培养基,每孔加入二甲基亚砜(DMSO)200 μL,微量震荡器上震荡10 min,使结晶溶解,选择490 nm波长在酶标仪上测量各孔吸光度(A)值,然后以时间为横坐标,A值为纵坐标绘制生长曲线图,显示各组细胞增殖曲线。
1.8 Annexin Ⅴ-FITC/PI双染法检测细胞凋亡
细胞分组及转染同前,于转染48 h后每组收集细胞1×105个,按Annexin Ⅴ-FITC/PI双染细胞凋亡试剂盒分别说明书处理各组细胞,30 min内用流式细胞仪检测细胞凋亡率。实验重复3次。
1.9 Transwell小室迁移实验
转染48 h后,用不含血清的培养基制备各组单细胞悬液,将细胞密度调整为2.5×105个/mL,取400 μL加入Transwell上室中,在下室即24孔板内加入600 μL含20%FBS的RPMI-1640培养基,常规培养24 h后,取出小室,湿棉签擦去上室细胞,PBS缓冲液洗3次后,用-20 ℃预冷的甲醇固定细胞10 min,然后吸尽甲醇,PBS洗3次后自然风干,于0.01%结晶紫染色30 min,风干后用手术刀片沿压痕将小室膜轻轻切下于光镜下观察,并随机选取上、下、左、右及中间5个视野,计数穿膜细胞,并求平均值,以穿膜细胞的数目代表SGC7901细胞的体外迁移能力。
1.10 统计学处理
2 结 果
2.1 miR-486-5p在SGC7901、GES-1细胞中的表达
miR-486-5p及U6扩增曲线均为典型S型曲线,溶解曲线呈单峰且溶解温度均一,表明引物特异性好,qRT-PCR结果可靠。分析结果显示,与GES-1细胞(1.06±0.19)相比,miR-486-5p在SGC7901细胞中的表达量为0.48±0.12,差异有统计学意义(P<0.05,图1)。
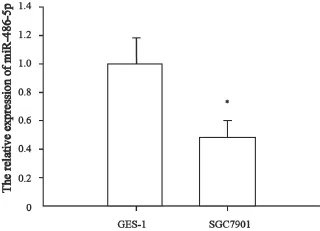
图1 GES-1和SGC7901细胞miR-486-5p 相对表达量Fig. 1 The relative expression of miR-486-5p of GES-1 and SGC7901 cells
2.2 GV214-miR质粒转染细胞miR-486-5p丰度明显上调
与未转染组miR-486-5P表达量(1.02±0.11)相比,GV214-miR质粒转染组中miR-486-5p相对表达量为8.45±0.42(P<0.05),GV214-NC质粒转染组中miR-486-5p相对表达量为1.09±0.07(P>0.05)。结果提示SGC7901细胞转染GV214-miR质粒可显著提高miR-486-5p的表达,证实其可以作为研究miR-486-5p功能的有效指标(图2)。
2.3 miR-486-5p对细胞增殖能力的影响
结果显示,与空白对照组相比,GV214-m i R质粒转染组细胞增殖能力明显降低(P<0.05),而转染GV214-NC质粒组则无明显变化(P>0.05,图3)。

图2 各组细胞miR-486-5p 相对表达量Fig. 2 The relative expression of miR-486-5p of SGC7901 cells in various groups

图3 MTT法检测各组SGC7901细胞增殖状态Fig. 3 MTT assays showed the cell proliferation abilities of SGC7901 cells in various groups
2.4 miR-486-5p对细胞凋亡的影响
结果显示,GV214-miR质粒转染组细胞凋亡率[(15.4±2.1)%]明显高于空白对照组[(4.2±1.1)%]和GV214-NC[(5.3±1.2)%]质粒转染组(P<0.05),而空白对照组和GV214-NC质粒转染组差异无统计学意义(P>0.05,图4)。

图4 各组SGC7901细胞凋亡率Fig. 4 Apoptosis rates of SGC7901 cells in various groups
2.5 miR-486-5p过表达质粒对SGC7901细胞体外迁移能力的影响
与空白对照组SGC7901细胞的穿膜细胞数(108.6±9.3)及GV214-NC质粒转染组(105.2±9.8)相比,GV214-miR质粒转染组(45.2±8.6)明显降低(P<0.05),而空白对照组及GV214-NC质粒转染组相比,但其穿膜细胞数差异无统计学意义(P>0.05,图5)。
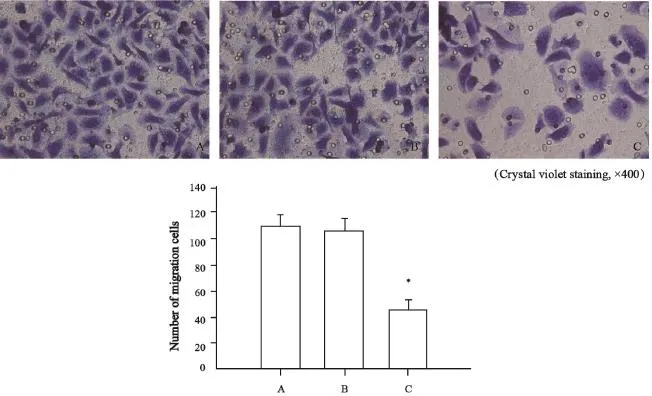
图5 各组SGC7901细胞体外迁移能力Fig. 5 In vitro migration abilities of SGC7901 cells in various groups
3 讨 论
miRNA与肿瘤的关系是目前肿瘤研究领域中的热点之一,大量研究表明肿瘤组织和正常组织中miRNA表达谱存在明显差异,这些差异表达的miRNA通过调节下游靶基因的表达参与肿瘤的发生、发展和转移等病理过程。对于已发现的在肿瘤中异常表达的miRNA,其研究重点的是预测作用靶点及阐明其作用机制。目前研究者对miRNA的研究还停留在实验室阶段,人工构建的pre-miRNA转染细胞以纠正低表达的miRNA及反义抑制剂抑制上调的miRNA是目前研究的热点,为肿瘤的基因治疗提供了新的切入点,有望在肿瘤的基因治疗方面取得重大突破[7]。
近年来miRNA在胃癌中的研究逐渐受到关注,其独特的转录后调控方式为胃癌的研究提供了新的方向和思路。在胃癌中,越来越多的异常表达的miRNA被发现,其中部分miRNA的作用靶点及机制得到初步阐明。例如Wada等[8]使用基因芯片技术分析了多个胃癌细胞系的miRNA及人胚肾细胞HEK-293T的miRNA表达谱,并结合实时定量PCR证实miR-212在多个胃癌细胞系内表达下调,进一步研究发现miR-212通过直接作用MECP2(methyl-CpG-binding protein)参与胃癌的发生过程。Xu等[9]研究发现miR-335在胃癌组织及细胞内均表达下调,使用miR-335可抑制过表达质粒转染胃癌细胞株SGC7901增殖及迁移侵袭,荧光报告基因实验证实miR-335通过直接作用于Bcl-w及特异性蛋白1(specificity protein 1,SP1)发挥抑癌作用。
既往研究表明,miR-486-5p与多个肿瘤的发生、发展密切相关,Oh等[10]报道miR-486-5p在胃癌中可抑制OLFM4的表达,从而发挥抑癌作用。目前关于miR-486-5p在胃癌中的研究较少,我们首先使用qRT-PCR证实胃癌细胞株SGC7901中miR-486-5p表达明显下调,为进一步确定miR-486-5p在胃癌中的作用,本研究使用miR-486-5p过表达质粒转染SGC7901细胞,转染后其表达明显上调。MTT和Transwell小室迁移实验证实,miRNA-486-5p能抑制SGC7901细胞的增殖和迁移,流式细胞术证实miRNA-486-5p可促进细胞凋亡。综上所述,miR-486-5p在胃癌的发生、发展中起着重要作用。
本研究结果证实,miR-486-5p在胃癌细胞株中表达明显下调,并参与胃癌细胞的增殖、凋亡及迁移,但其具体作用机制尚不明确,下一步我们将使用生物信息学技术预测并验证其在胃癌中作用的具体机制。
[1]WU W K, LEE C W, CHO C H, et al. MicroRNA dysregulation in gastric cancer: a new player enters the game[J]. Oncogene, 2010, 29(43): 5761-5771.
[2]LIM L P, LAU N C, GARRETT-ENGELE P, et al. MicroRNA analysis shows that some microRNAs downregulate large numbers of target mRNAs[J]. Nature, 2005, 433(7027): 769-773.
[3]LEWIS B P, BURGE C B, BARREL D P. Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J]. Cell, 2005, 120(1): 15-20.
[4]NAVON R, WANG H, STEINFELD I, et al. Novel rankbased statistical methods reveal microRNAs with differential expression in multiple cancer types[J]. PLoS One, 2009, 4(11): e8003.
[5]WANG J, TIAN X, HAN R, et al. Downregulation of miR-486-5p contributes to tumor progression and metastasis by targeting protumorigenic ARHGAP5 in lung cancer[J]. Oncogene, 2014, 33(9): 1181-1189.
[6]MEES S T, MARDIN W A, SIELKER S, et al. Involvement of CD40 targeting miR-224 and miR-486 on the progression of pancreatic ductal adenocarcinomas[J]. Ann Surg Oncol, 2009, 16(8): 2339-2350.
[7]ZENG Y, CAI X, CULLEN B R. Use of RNA polymerase Ⅱto transcribe artificial microRNAs[J]. Methods Enzymol, 2005, 392: 371-380.
[8]WADA R, AKIYAMA Y, HASHIMOTO Y, et al. miR-212 is downregulated and suppresses methyl-Cp G-binding protein MECP 2 in human gastric cancer[J]. Int J Cancer, 2010, 127(5): 1106-1114.
[9]XU Y, ZHAO F, WANG Z, et al. MicroRNA-335 acts as a metastasis suppressor in gastric cancer by targeting Bcl-w and specificity protein [J]. Oncogene, 2012, 31(11): 1398-1407.
[10]OH H K, TAN A L, DAS K, et al. Genomic loss of miR-486 regulates tumor progression and the OLFM4 anti apoptotic factor in gastric cancer[J]. Clin Cancer Res, 2011, 17(9): 2657-2667.
Relationship between miR-486-5p and biological behavior of gastric carcinoma SGC7901 cells
LI Ming1, LIAN Hai-feng1, LIU Cheng-xia1, HU Ying-bin1, LI You-jie2(1.Department of Digestive, the Af fi liated Hospital of Binzhou Medical University, Binzhou Shandong 256603, China; 2.Key Laboratory of Tumor Molecular Biology, Binzhou Medical University, Yantai Shandong 264003, China)
LIU Cheng-xia E-mail: phdlcx@163.com
Background and purpose:MicroRNA-486-5p (miR-486-5p) has been demonstrated to play an important role in many kinds of tumor, however, there are few reports about the relationship between miRNA-486-5p in gastric carcinoma. This study was aimed to explore the effect of miR-486-5p on the proliferation, apoptosis and migration abilities of the human gastric cancer cell line SGC7901.Methods:Quantitative real-time PCR (qRTPCR) analysis was performed to detect the expression of miR-486-5p in the SGC7901 and GES-1 cells, miR-486-5p over-expressing plasmid was constructed and transfected into the human gastric carcinoma cell line SGC7901 using LipofectamineTM2000. The expression of miR-486-5p of the transfected cells was measured by qRT-PCR, the proliferation level of SGC7901 cells was detected by MTT method, the apoptosis rate of the cells was measured by fl ow cytometry and the in vitro migration abilities of SGC7901 cells by transwell test.Results:The miR-486-5p expression in SGC7901 cells was down-regulated compared with GES-1 cells. The expression of miR-486-5p in SGC7901 cells that was transfected miR-486-5p over-expressing plasmid was obviously up-regulated. The proliferation and migration abilities of SGC7901 cells were inhibited signi fi cantly, and the apoptosis rate of the cells increased.Conclusion:miR-486-5p can effectively suppress the proliferation and in vitro migration abilities of SGC7901 cells, indicating that miR-486-5p might be used as a target for molecular therapy of gastric cancer.
Gastric carcinoma; miR-486-5p; Proliferation; Apoptosis; Migration abilities
10.3969/j.issn.1007-3969.2014.04.006
R73-37
A
1007-3639(2014)04-0273-06
2013-11-17
2014-01-14)
山东省高校科技计划(No:J11LF75);滨州医学院科研启动基金(No:BY2010KYQD02)。
刘成霞 E-mail:phdlcx@163.com
*:现在滨州医学院烟台附属医院消化内科工作。

