癌相关成纤维细胞通过IL-6诱导的“上皮-间质”转换促进宫颈癌细胞的迁移和侵袭
任春霞 赵敏 徐娜 宋亚琴 陈亚萍 吕蓓 杨恭
1江苏省无锡市人民医院妇产科,江苏 无锡 214023;2山东省交通医院妇产科,山东 济南 250031;3复旦大学附属上海市第五人民医院妇产科,复旦大学上海医学院妇产科学系,上海 200240;4复旦大学附属上海市第五人民医院中心实验室,复旦大学上海医学院妇产科学系,上海 200240 5复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032
癌相关成纤维细胞通过IL-6诱导的“上皮-间质”转换促进宫颈癌细胞的迁移和侵袭
任春霞1 赵敏2 徐娜1 宋亚琴1 陈亚萍3 吕蓓1 杨恭4,5
1江苏省无锡市人民医院妇产科,江苏 无锡 214023;2山东省交通医院妇产科,山东 济南 250031;3复旦大学附属上海市第五人民医院妇产科,复旦大学上海医学院妇产科学系,上海 200240;4复旦大学附属上海市第五人民医院中心实验室,复旦大学上海医学院妇产科学系,上海 200240 5复旦大学附属肿瘤医院肿瘤研究所,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:癌相关成纤维细胞(cancer-associated fibroblasts,CAFs)能促进上皮肿瘤的侵袭和转移,细胞因子IL-6在肿瘤间质微环境中可能介导间质和上皮的相互作用,促进肿瘤的侵袭和转移,但其具体机制尚不十分清楚。方法:以宫颈癌细胞HeLa为研究模型,用ELISA测定宫颈癌CAFs和正常宫颈组织成纤维细胞(normal fibroblasts,NFs)条件培养基中IL-6的表达;用条件培养基或IL-6分别处理宫颈癌细胞系HeLa;用Western blot测定样品处理前后上皮-间质转化(epithelial-mesenchymal transition,EMT)标志物(如N-Cadherin和Vimentin等)的变化,同时用划痕和transwell小室测定细胞迁移和侵袭能力的变化。结果:CAF中IL-6表达比NF高4~5倍;与对照组相比,用CAF条件培养基或IL-6处理的HeLa细胞间充质细胞标志物Vimentin和N-Cadherin升高,而上皮细胞标志物E-Cadherin和Cytokeratin下降,表明IL-6可以促进细胞的EMT发生;进一步研究发现过量IL-6处理的HeLa细胞中干细胞转录因子Snail 1随STAT3的激活而上升;同时发现过量IL-6处理的HeLa细胞的迁移和侵袭能力大幅增加。结论:CAF在肿瘤微环境中可能通过IL-6/STAT3/Snail通路诱导宫颈癌上皮细胞的EMT转化,从而促进宫颈癌的侵袭和转移能力。
癌相关成纤维细胞;宫颈癌;白介素6;上皮-间质转换;迁移和侵袭
近年来,间质微环境对肿瘤发生、发展的作用机制是肿瘤研究的热点,其中癌相关成纤维细胞(cancer-associated fi broblasts,CAFs)的特性对上皮类肿瘤的发生尤为重要,因此,CAFs调节肿瘤发生、发展的机制得到广泛的研究。如CAFs作为肿瘤相关的炎性反应源,可能对肿瘤的发生和发展均有一定作用[1-2]。三阴性乳腺癌中CAFs以CXCL12和IGF1介导的PI3K-AKT信号通路对乳腺癌定向骨转移具有决定性作用[3]。此外,CAFs可能通过其旁分泌的IL-33调节头颈鳞癌细胞的侵袭能力[4]。
上皮-间质转换(epithelial-mesenchymal transition,EMT)是近年来肿瘤研究领域的另一热点。EMT对肿瘤的转移及其重要,如Pten丢失和PI3K/AKT激活可以诱导前列腺癌细胞发生EMT,进而促进前列腺癌的高转移[5]。最近发现,EMT可能是肿瘤干细胞的特征之一[6-7]。但与之相对的间质-上皮转换(mesenchymal-epithelial transition,MET)可能也与肿瘤转移密切相关[8-9]。
有研究表明,CAFs可能在乳腺癌组织的边缘通过基质金属蛋白酶促进乳腺癌细胞的EMT发生[10]。在舌鳞状细胞癌中,CAFs可能通过Cadherin-11和FSP-1等分子调节EMT的发生和肿瘤转移[11]。我们最近的研究发现细胞因子IL-6在CAFs中的表达比正常NFs高4~5倍[12],在宫颈癌微环境中,CAFs是否可以通过IL-6诱导EMT发生而促进宫颈癌的转移和侵袭,目前鲜见报道,本研究旨在利用体外细胞学实验验证这一假说。
1 材料和方法
1.1 细胞系和培养基
宫颈癌细胞系HeLa来自美国模式菌种收集中心(ATCC),培养基为含10%胎牛血清、1 mmol/L非必需氨基酸、2 mmol /L L-谷氨酰胺、100 U/mL青霉素及100 μg/mL链霉素的DEME(购于美国Gibco公司),培养环境为37 ℃、CO2体积分数为5%的恒温培养箱。
CAFs和NFs来自南京医科大学附属无锡市人民医院妇产科2012年11月收治的患者4例。所有患者均为初治患者,术前均未接受任何治疗。CAFs获取源(宫颈癌IB1期行广泛子宫切除术加盆腔淋巴结清扫术患者标本和宫颈癌IA1期行全子宫切除术患者标本2例);NFs获取源为卵巢癌行全子宫加双侧附件切除术患者标本2例。标本获取前均与患者签署知情同意书,获得本人许可。成纤维细胞分离方法见文献[12]。成功分离到2株CAFs和2株NFs,体外培养,增殖良好,实验使用CAFs和NFs分别为体外第3代和第5代,无明显衰老表型。
1.2 酶联免疫吸附试验(ELISA)
细胞培养基的收集见1.3,培养基中IL-6的测定按试剂盒(美国R&D System公司)操作说明。检测步骤如下:
⑴用PBS稀释一抗(IL-6Ab)至0.25 μg/mL ,迅速加入100 μL到每个孔中,室温温育过夜。
⑵吸出液体,每孔用300 μL wash buffer洗板4次。最后1次洗完后在纸上翻转板,除去残余的缓冲液。
⑶每孔中加300 μL的封闭液,在室温下至少温育1 h。洗板4次,方法同上。
⑷然后将IL-6标准品从1、0.75、0.5、0.25、0.125到0 ng/mL进行稀释,加100 μL的标准品或者样品到每个孔中,设三样品孔重复,在室温中至少温育2 h。
⑸洗板4次,稀释检测抗体到1.0 μg/mL,每孔加100 μL。室温温育30 min。
⑹洗板4次,以1∶2 000稀释Avidin-HRP第二抗体,每孔加100 μL,室温温育30 min。之后洗板4次,每孔加100 μL显色剂,室温下温育,观察颜色变化。
⑺最后,每孔加入终止液50 μL,用(650 nm波长)酶标仪读取A值,求出IL-6相对浓度。
1.3 条件培养基或IL-6处理HeLa细胞
1.3.1 条件培养基(conditioned medium,CM)的收集
将HeLa细胞,CAFs或NFs在100 mm培养皿中进行正常单层培养至75%的密度,然后更换无血清培养基继续培养48 h后收集培养基即为CM。PBS或无血清培养基作为对照。
1.3.2 细胞处理
将HeLa细胞在35 mm培养皿中正常培养至75%的密度,然后用含CAFs或NFs的CM,或200 ng/mL的IL-6(无血清)处理细胞48 h,收集24和48 h处理的细胞样品,进行蛋白质印迹法(Western blot)检测或进行细胞迁移与侵袭检测试验。
1.4 Western blot检测
主要用于E-cadherin、N-cadherin、cytokeratin、vimentin、pSTAT3(Tyr 705)和 Snail 1等蛋白的检测,抗体均购自美国Cell Signaling Technology公司。将细胞用蛋白裂解缓冲液RIPA(25 mmol/L Tris-HCl,pH为7.6;150 mmol/L NaCl,1%NP-40,1%脱氧胆酸钠-sodium deoxycholate,0.1% SDS)及适量蛋白酶抑制剂混合物(购自美国Sigma公司产品)裂解后,用BCA法测定蛋白浓度(试剂盒购自上海碧云天),然后用6×的SDS加样缓冲液(125 mmol/L Tris-HCl,pH为6.8;2%SDS,20%甘油,0.2%溴酚蓝)制备成适当浓度的样品。样品分离前,用100 ℃的水浴处理样品3~5 min。然后用10%的SDS-聚丙烯酰胺凝胶电泳分离裂解的蛋白样品。之后将蛋白转移到聚偏二氟乙烯膜(PVDF membrane,购自美国Millpore公司)上,并用10%的脱脂奶粉(Bio-Rad)在室温下封闭2 h。此后依次加入一抗和HRP(辣根氧化物酶)-偶联的二抗(依一抗而定)。转移的蛋白用化学发光底物(ECL,购自美国Millipore公司)进行显色后,LAS4000化学发光成像分析仪曝光显出条带。
1.5 细胞划痕实验
分别将CM、IL-6、PBS或无血清培养基处理的HeLa细胞接种至6孔板中,每种细胞接种3个孔。等到细胞完全融合的时候,用10 μL枪头在每孔单层细胞上划痕,每孔划出的“伤口”宽度要保持一致。PBS清洗一次,加无血清培养基,在37 ℃ ,CO2体积分数为5%的培养箱中培养,0、12、24 h分别观察划痕愈合情况并拍照。计算不同时间段迁移的距离反应细胞迁移的能力,此实验重复3次。
1.6 细胞侵袭实验
用带有8 μm微孔聚碳酸酯膜的transwell小室(购自美国BD公司)。首先将Matrigel(50 mg/L)胶和无血清DMEM培养基以1∶3比例进行混合。小室上室铺100 μL混合好的Matrigel,37 ℃无菌保持过夜,确保Matrigel充分凝固。收集对数生长期的细胞,用无血清DMEM培养基调整细胞浓度为1×106mL-1,每孔加100 μL细胞悬液于上室,设3个重复孔,下室每孔加600 μL无血清DMEM。在37 ℃、体积分数为5%的CO2培养箱中温育16 h后取出小室,滤膜用4%多聚甲醛固定20 min。用棉签小心擦去未侵袭的滤膜表面细胞, 结晶紫染色,在光镜下随机选5个视野,计算细胞总数,以穿过Matrigel的细胞数来表示肿瘤细胞的侵袭能力,本实验重复3次。
2 结 果
2.1 IL-6分泌水平结果
本试验测定了HeLa细胞,2株CAF细胞和2株NF细胞培养基中IL-6的水平,发现CAF培养基中IL-6>700 pg/mL,而NF培养基的IL-6浓度<150 pg/mL。此外,HeLa细胞中的IL-6浓度介于CAF和NF之间,为(365±28)pg/mL(图1)。因此,在后续的实验中我们主要使用CAF2的CM或IL-6(浓度为200 ng/mL),同时以NF的CM和PBS等作为对照处理细胞。
2.2 CAF条件培养基中IL-6促进HeLa细胞的EMT
用CAF的CM处理HeLa细胞24和48 h,分别测定了上皮细胞标志物E-Cadherin和Cytokeratin以及间充质细胞标志物Vimentin和N-Cadherin的表达水平,发现E-Cadherin和Cytokeratin下降,而Vimentin和N-Cadherin上升(图2A)。这些蛋白的变化标志着CAF的CM可能诱导宫颈癌细胞发生EMT。

图1 用ELISA法测定的CAFs、NFs和HeLa细胞培养基中IL-6的相对浓度Fig. 1 Relative concentrations of IL-6 measured by ELISA in medium collected from cultures of CAFs, NFs and HeLa cells
为了测定CAF中CM促进EMT发生是否由于IL-6的作用,我们首先用IL-6处理了HeLa细胞,同时在CAF-CM或IL-6处理的HeLa细胞中,分别添加了IL-6中和抗体(购自美国R&D System公司),结果发现IL-6单独处理的HeLa细胞也可以诱导HeLa细胞的EMT发生,而且IL-6中和抗体可以抑制EMT相关蛋白的表达(图2B)。
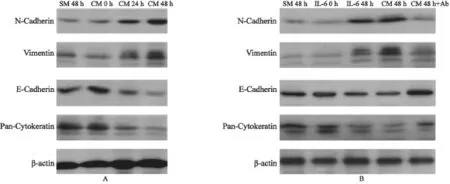
图2 用CAF2的条件培养基或IL-6处理的HeLa细胞48 h后显示EMT相关分子的变化Fig. 2 Alterations of EMT-associated molecules in HeLa cells treated with CAF2 CM or IL-6 for 48 h.
2.3 STAT3激活是IL-6诱导EMT发生的关键
由于IL-6介导的主要细胞信号通路是受STAT3磷酸化控制的,而且EMT作为肿瘤干细胞的特征,转录因子Snail可能具有重要的调节功能。因此我们用Western blot检测了STAT3的磷酸化和Snail 1的表达,同时在IL-6处理的细胞中加入STAT3抑制剂S31-201(美国Santa Cruz Biotechnology公司产品),进行了EMT 标志物的对比检测。结果发现IL-6促进STAT3 Tyr705磷酸化和Snail 1表达的上升,抑制STAT3磷酸化,Snail 1的表达水平下降(图3)。说明STAT3的磷酸化可能是IL-6诱导EMT发生的关键节点。
2.4 IL-6诱导的EMT促进宫颈癌细胞的迁移和侵袭
为了检测IL-6诱导的EMT对HeLa细胞的生物学效应,我们用划痕和transwell小室测定了细胞迁移和侵袭能力。结果表明,IL-6处理的HeLa细胞迁移能力和细胞的侵袭性均增强,而用IL-6抗体中和或用STAT3抑制剂再处理后,细胞的迁移和侵袭能力会下降(图4)。
以上结果表明,肿瘤间质微环境中CAFs可能通过其旁分泌的IL-6使宫颈癌上皮细胞STAT3激活和Snail 1上升,诱导EMT发生,从而促进宫颈癌的扩散和转移。
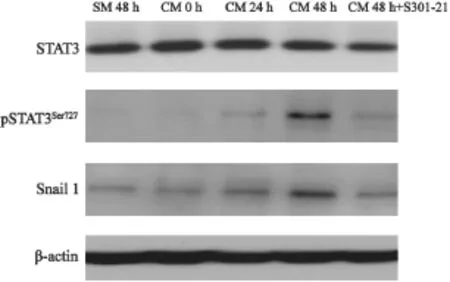
图3 IL-6激活STAT3磷酸化,以促进Snail 1的表达,β-actin为加样对照Fig. 3 Activation of STAT3 by IL-6 promotes the expression of Snail 1,β-actin is a loading control
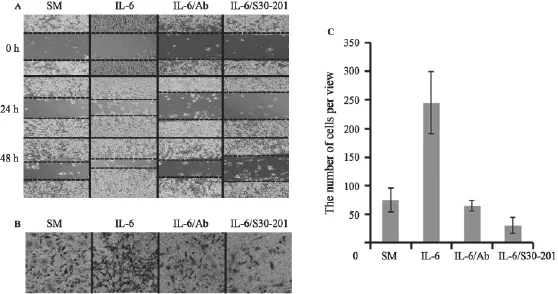
图4 HeLa细胞用无血清培养基(SM)、IL-6、IL-6及其抗体(IL-6/Ab)、IL-6及STAT3抑制剂S30-201(IL-6/S30-201)处理后HeLa细胞迁移和侵袭的变化Fig. 4 Migration and invasion of HeLa treated with SM (serum-free medium), IL-6, IL-6/Ab (IL-6+antibody of IL-6), and IL-6/S30-201 (IL-6+STAT3 inhibitor-S30-201)
3 讨 论
本研究用人体宫颈组织中分离的CAFs和NFs进行对比性研究,发现其分泌的IL-6水平通过激活STAT3信号,提高干细胞转录因子Snail 1的表达,诱导宫颈癌细胞的EMT发生和增强细胞迁移和侵袭的能力。
CAFs一般呈衰老状态,在酸性条件(pH=5.2)下,衰老相关beta半乳糖苷酶活性上升[12-13]。尽管细胞衰老意味着生命的结束,但衰老的间质细胞由于分泌大量衰老相关表型,对肿瘤的发生、发展却具有促进作用[13-14]。因此,研究CAFs在肿瘤微环境中对上皮恶性转化、侵袭和转移具有重要意义。本研究的结果说明CAFs作为微环境中IL-6分泌的主要来源,对宫颈癌EMT的发生起着至关重要的作用。
IL-6作为炎性细胞因子,与肿瘤血管形成、肿瘤发生和转移密切相关[15-16]。其作用机制大多与JAK或STAT3信号通路相关[15,17]。目前已有人报道IL-6可以诱导乳腺癌细胞CD44表达上升而形成EMT相关微球体[18]。在头颈部鳞癌中,内皮细胞来源的IL-6也可能诱导癌细胞的EMT发生[19]。本研究发现IL-6通过促进STAT3磷酸化,调节EMT干细胞标志物Snail 1的表达,同时我们发现EMT的发生可增强细胞的迁移和侵袭能力。本试验的结果基本证实CAFs通过旁分泌IL-6的方式,诱导宫颈癌EMT发生和促进肿瘤的迁移和转移,尽管本研究数据尚需在动物体内和人体宫颈癌标本组织中进行相关验证,但这一初步结论预示着CAFs在肿瘤微环境中的重要性,因而对宫颈癌转移的诊断、治疗和预后可能具有理论价值和临床意义。
[1]SERVAIS C, EREZ N. From sentinel cells to inflammatory culprits: cancer-associated fibroblasts in tumour-related inflammation [J]. J Pathol, 2013, 229(2): 198-207.
[2]KARAGIANNIS G S, POUTAHIDIS T, ERDMAN S E, et al. Cancer-associated fibroblasts drive the progression of metastasis through both paracrine and mechanical pressure on cancer tissue [J]. Mol Cancer Res, 2012, 10(11): 1403-1418.
[3]ZHANG X H, JIN X, MALLADI S, et al. Selection of bone metastasis seeds by mesenchymal signals in the primary tumor stroma [J]. Cell, 2013, 154(5): 1060-1073.
[4]CHEN S F, NIEH S, JAO S W, et al. The paracrine effect of cancer-associated fibroblast-induced interleukin-33 regulates the invasiveness of head and neck squamous cell carcinoma [J]. J Pathol, 2013, 231(2): 180-189.
[5]MULHOLLAND D J, KOBAYASHI N, RUSCETTI M, et al. Pten loss and RAS/MAPK activation cooperate to promote EMT and metastasis initiated from prostate cancer stem/ progenitor cells [J]. Cancer Res, 2012, 72(7): 1878-1889.
[6]BIDDLE A, MACKENZIE I C. Cancer stem cells and EMT in carcinoma [J]. Cancer Metastasis Rev, 2012, [Epub ahead of print].
[7]CIOCE M, CILIBERTO G. On the connections between cancer stem cells and EMT [J]. Cell Cycle, 2012, 11(23): 4301-4302.
[8]OCANA O H, CORCOLES R, FABRA A, et al. Metastatic colonization requires the repression of the epithelialmesenchymal transition inducer Prrx1 [J]. Cancer Cell, 2012, 22(6): 709-724.
[9]TSAI J H, DONAHER J L, MURPHY D A, et al. Spatiotemporal regulation of epithelial-mesenchymal transition is essential for squamous cell carcinoma metastasis[J]. Cancer Cell, 2012, 22(6): 725-736.
[10]GAO M Q, KIM B G, KANG S, et al. Stromal fibroblasts from the interface zone of human breast carcinomas induce an epithelial-mesenchymal transition-like state in breast cancer cells in vitro [J]. J Cell Sci, 2010, 123(Pt 20): 3507-3514.
[11]VERED M, DAYAN D, YAHALOM R, et al. Cancerassociated fibroblasts and epithelial-mesenchymal transition in metastatic oral tongue squamous cell carcinoma[J]. Int J Cancer, 2010, 127(6): 1356-1362.
[12]REN C, CHENG X, LU B, et al. Activation of interleukin-6/ signal transducer and activator of transcription 3 by human papillomavirus early proteins 6 induces fibroblast senescence to promote cervical tumourigenesis through autocrine and paracrine pathways in tumour microenvironment [J]. Eur J Cancer, 2013, 49(18): 3889-3899.
[13]KRTOLICA A, PARRINELLO S, LOCKETT S, et al. Senescent fibroblasts promote epithelial cell growth and tumorigenesis: a link between cancer and aging [J]. Proc Natl Acad Sci U S A, 2001, 98(21): 12072-12077.
[14]TCHKONIA T, ZHU Y, VAN DEURSEN J, et al. Cellular senescence and the senescent secretory phenotype: therapeutic opportunities [J]. J Clin Invest, 2013, 123(3): 966-972.
[15]CHANG Q, BOURNAZOU E, SANSONE P, et al. The IL-6/ JAK/Stat3 feed-forward loop drives tumorigenesis and metastasis [J]. Neoplasia, 2013, 15(7): 848-862.
[16]BOTTO S, STREBLOW D N, DEFILIPPIS V, et al. IL-6 in human cytomegalovirus secretome promotes angiogenesis and survival of endothelial cells through the stimulation of survivin[J]. Blood, 2011, 117(1): 352-361.
[17]HATZI E, MURPHY C, ZOEPHEL A, et al. N-myc oncogene overexpression down-regulates IL-6; evidence that IL-6 inhibits angiogenesis and suppresses neuroblastoma tumor growth [J]. Oncogene, 2002, 21(22): 3552-3561.
[18]XIE G, YAO Q, LIU Y, et al. IL-6-induced epithelialmesenchymal transition promotes the generation of breast cancer stem-like cells analogous to mammosphere cultures[J]. Int J Oncol, 2012, 40(4): 1171-1179.
[19]YADAV A, KUMAR B, DATTA J, et al. IL-6 promotes head and neck tumor metastasis by inducing epithelialmesenchymal transition via the JAK-STAT3-SNAIL signaling pathway [J]. Mol Cancer Res, 2011, 9(12): 1658-1667.
Cancer-associated fibroblasts promotes migration and invasion of cervical epithelial cancer cells through IL-6-induced “epithelial-mesenchymal” transition
REN Chun-xia1, ZHAO Min2, XU Na1, SONG Ya-qin1, CHEN Ya-ping3, LV Bei1, YANG Gong4,5(1.Department of Gynecology and Obstetrics, The People’s Hospital of Wuxi, Wuxi Jiangsu 214023, China; 2.Department of Gynecology and Obstetrics, Shandong Jiaotong Hospital, Jinan Shandong 250031, China; 3.The 5thPeople’s Hospital of Shanghai, Fudan University, Department of Gynecology and Obstetrics, Shanghai Medical College, Fudan University, Shanghai 200240, China; 4.Central Laboratory, The 5thPeople’s Hospital of Shanghai, Fudan University, Department of Gynecology and Obstetrics, Shanghai Medical College, Fudan University, Shanghai 200240, China; 5.Cancer Institute, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
LV Bei E-mail: lvbei@wuxiph.com
Background and purpose:Cancer-associated fibroblasts (CAFs) are known to promote theinvasion and metastasis of epithelial cancers. The cytokine IL-6 may mediate the interaction between stromal cells and epithelia in tumor microenvironment to facilitate the invasiveness and metastasis of cancer, however, such mechanism has not been fully covered yet.Methods:We used cervical cancer cell line HeLa as a model for this study. ELISA was used to measure the levels of IL-6 in CAFs and normal fi broblasts (NFs) isolated from squamous cervical cancer or normal cervical tissues. CAFs conditioned medium or IL-6 was used to treat cervical cancer HeLa cell line. The epithelial-mesenchymal transition (EMT) markers such as N-Cadherin and Vimentin were detected by Western blot in cells before and after treatment. Scratches and transwell chambers were used to test the abilities of cell migration and invasion.Results:The levels of IL-6 were 4-5 folds higher in CAFs than in NFs. Treatment of HeLa cells with CAF conditioned medium or IL-6 upregulated N-Cadherin and Vimentin, but down-regulated E-Cadherin and cytokeratin, compared with control cells, indicating that IL-6 may stimulate HeLa cells to EMT. Further study found that Snail 1, the featured transcription factor for stem cells, was increased along with the enhanced phosphorylation of STAT3. Meanwhile, the migration and invasion of HeLa cells treated with IL-6 or CAF conditioned medium were markedly increased.Conclusion:CAF induces the EMT of cervical epithelial cancer cells through IL-6/STAT3/Snail pathway, which thereby promotes the invasiveness and metastasis cervical epithelial cancer.
Cancer-associated fi broblasts; Cervical cancer; Interleukin-6; Epithelial-mesenchymal transition; Migration and invasion
10.3969/j.issn.1007-3969.2014.04.003
R73-37
A
1007-3639(2014)04-0252-06
2013-12-27
2014-03-14)
国家自然科学基金面上项目(No:NSFC91129721)、南京医科大学面上基金(No:2012NJMU179)。
吕蓓 E-mail:lvbei@wuxiph.com

