负载核糖体蛋白L8的树突状细胞对黑色素瘤的抑制作用
遵义医学院附属医院检验科,贵州 遵义563003
负载核糖体蛋白L8的树突状细胞对黑色素瘤的抑制作用
李燕 尹令丝 岳欢 黄俊琼 胡永林
遵义医学院附属医院检验科,贵州 遵义563003
背景与目的:研究发现核糖体蛋白L8(ribosomal protein L8,RPL8)在黑色素瘤中表达能激活黑色素瘤患者外周血单个核细胞增殖并产生白细胞介素2,提示RPL8可能参与抗肿瘤免疫应答,有望成为抗肿瘤治疗的靶点。本研究通过RPL8蛋白负载树突状细胞(dentritic cell,DC),探讨负载RPL8蛋白的DC对黑色素瘤的免疫效应。方法:原核表达RPL8蛋白,纯化后致敏小鼠骨髓来源DC,流式细胞仪检测DC表面标志,MTT法检测细胞毒性T淋巴细胞对小鼠黑色素瘤细胞的杀伤作用;负载RPL8蛋白DC免疫治疗小鼠后,观察肿瘤体积变化及小鼠生存时间。结果:纯化蛋白经蛋白质印迹法(Western blot)分析见约28×103大小的特异性条带;DC经RPL8及细菌脂多糖(Lipoplysaccharide,LPS)诱导成熟后细胞表面CD11c、CD80、MHC-Ⅰ类、MHC-Ⅱ类分子表达增高,能激活T淋巴细胞,对B16细胞有抑制作用,RPL8-DC组的抑制率在效靶比为30∶1时高达70%,较PBS组和DC组明显增高;负载RPL8蛋白DC免疫治疗小鼠后,肿瘤体积缩小,小鼠的生存期明显延长。结论:负载RPL8的DC对黑色素瘤有生长抑制作用。
核糖体蛋白L8;树突状细胞;黑色素瘤;免疫治疗
树突状细胞是目前已知的抗原提呈功能最强的细胞,有强大的激活CD8+细胞毒性T细胞(cytotoxic T lymphocyte,CTL)及CD4+辅助T细胞的能力。树突状细胞(dentritic cell,DC)表面高表达MHC-Ⅰ、MHC-Ⅱ类及黏附分子,在激发免疫反应诱导CTL对肿瘤细胞产生特异性杀伤的过程中起重要作用。以肿瘤特异性抗原或肿瘤相关抗原致敏DC,可诱导特异性抗肿瘤免疫应答[1-2]。本研究采用原核表达的核糖体蛋白L8(ribosomal protein L8,RPL8)冲击DC,探讨RPL8致敏的DC对黑色素瘤的治疗作用。
1 材料和方法
1.1 实验材料
E.coliDH5a、BL21、PET28a(+)质粒、PUC57-RPL8由本实验室保存;T4DNA连接酶、限制性内切酶HindⅢ和EcolⅠ购自日本Takara公司;质粒中小量提取试剂盒购自美国Omega公司;6~8周龄C57BL/6小鼠购自第三军医大学实验动物中心;重组小鼠GM-CSF、IL-4分别购自杭州隆基生物科技公司、PeproTech公司;荧光素标记的anti-CD11c、anti-CD80、anti-MHC-Ⅰ、anti-MHC-Ⅱ购自美国eBioscience公司。
1.2 方法
1.2.1 RPL8原核表达载体的构建及诱导表达
以本实验室构建的pUC57-RPL8载体为模板,扩增目的基因RPL8,构建pET28a(+)-RPL8原核表达载体,经测序鉴定正确后将其转化BL21工程菌,用IPTG诱导目的蛋白表达,采用Ni柱进行纯化,纯化蛋白用蛋白质印迹法(Western blot)进行鉴定。
1.2.2 负载RPL8蛋白的DC的制备及鉴定
无菌取小鼠股骨、胫骨,PBS液冲洗髓腔,收集冲洗液,NH4Cl溶液裂解红细胞,用含10%胎牛血清的RPMI-1640培养液调节细胞浓度为1×106/mL,接种于6孔板内培养(含10 ng/mL的GM-CSF和5 ng/mL的IL-4),第6天加入RPL8蛋白,使其终浓度为10 μg/mL,于37 ℃、CO2体积分数为5%的条件下培养,第2天加入LPS继续培养24 h,收集细胞,即为RPL8-DC。加入RPL8一抗和二抗,荧光显微镜下观察。流式细胞仪分析细胞表面CD80、CD11c、MHC-Ⅰ及MHC-Ⅱ类分子的表达。
1.2.3 细胞杀伤活性测定
取小鼠脾脏,研磨成匀浆,低渗破红细胞,加入含10%胎牛血清的RPMI-1640培养液重悬制成细胞悬液后,加至尼龙毛柱中,与37 ℃、CO2体积分数为5%的条件下培养1 h,收集T细胞。分别取PBS、DC、RPL8-DC与T细胞以1∶3比例混匀,继续培养72 h后,调节细胞浓度为1×106/mL,培养24 h后以效靶比为10∶1、20∶1、30∶1加入培养于96孔板内的B16细胞中,每组设3个复孔,继续培养48 h后加入MTT,4 h后加入DMSO,于570 nm波长处检测各组的A值。
1.2.4 体内抑瘤实验
小鼠右前腋下注射B16细胞(1×106/只),待小鼠长出肿瘤后即为荷瘤小鼠模型。荷瘤5 d后,随机将荷瘤小鼠分为3组,分别接受PBS、DC、RPL8-DC注射,体积为200 μL,每隔5 d注射1次,共3次,用游标卡尺测量小鼠的肿瘤大小,观察小鼠的生存情况。
1.3 统计学处理
2 结 果
2.1 纯化蛋白的鉴定
重组蛋白经Western blot分析,可见大小约28×103的特异性条带,同时以BL21空菌作为对照,对照菌未出现相应条带(图1)。

图1 纯化蛋白的鉴定Fig. 1 Puri fi ed protein was identi fi ed by Western blot
2.2 DC表面标志分析
在体外培养第6天未经RPL8诱导的DC,细胞表面特征性分子CD11c,共刺激分子CD80,MHC-Ⅰ、MHC-Ⅱ类分子低表达;经RPL8、 LPS诱导后的DC表面标志符合成熟DC的特点,即CD11c、CD80、MHC-Ⅰ、MHC-Ⅱ类分子等高表达(图2)。

图2 DC细胞表型鉴定Fig. 2 The membrane molecules on DC were analyzed after stimulation with RPL8
2.3 RPL8-DC的鉴定
DC和RPL8蛋白混合培养24 h后加入RPL8一抗,于37 ℃、CO2体积分数为5%的条件下温育1 h,加入FITC标记的羊抗鼠IgG,室温避光1 h后,荧光显微镜下观察可见细胞内有绿色荧光(图3)。
2.4 RPL8-DC诱导T细胞的杀伤效应
RPL8-DC激活的T淋巴细胞对B16黑色素瘤细胞的抑制率,以效靶比30∶1的效率最高,为70%,DC组的抑制率为48%,PBS组的抑制率为35%,RPL8-DC组对黑色素瘤的抑制率较DC组及PBS组明显增高(P<0.05,图4)。
2.5 荷瘤小鼠的生存时间及肿瘤体积的变化
C57BL/6小鼠右前腋皮下接种B16细胞5 d后,所有小鼠接种部位均出现直径约0.2~0.3 cm大小的结节,此时给予第1次免疫治疗,隔5 d免疫1次 ,游标卡尺测量肿瘤的大小,直到PBS组和DC组出现进食减少、精神萎靡、活动减少,逐渐死亡。RPL8-DC组的肿瘤大小显著小于PBS组及DC组(P<0.05),PBS组与DC组差异无统计学意义(图5)。RPL8-DC组小鼠的生存期明显延长,RPL8-DC组与DC组、PBS组比较,小鼠的生存期差异有统计学意义(P<0.05,图6)。
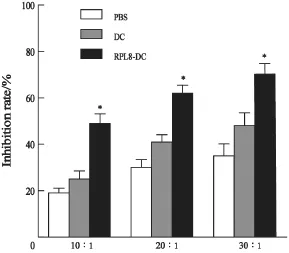
图4 各组对B16细胞的杀伤效应Fig. 4 RPL8-DC inhibited the growth of B16 cells
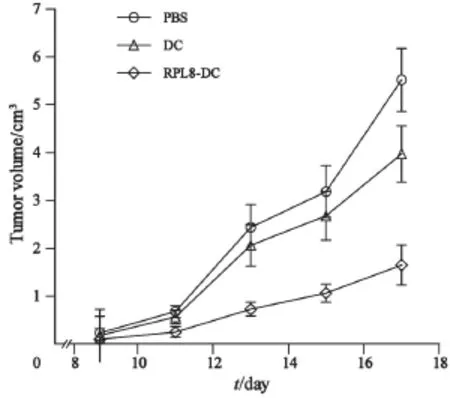
图5 RPL8-DC治疗后肿瘤体积的变化Fig. 5 The tumor volumes after treatment with RPL8-DC
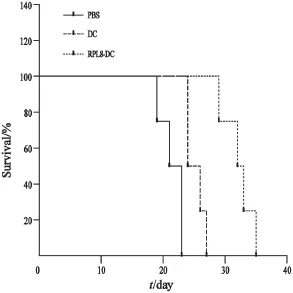
图6 RPL8-DC治疗后荷瘤小鼠的生存时间Fig. 6 Survival period of tumor-bearing mice after treatment with RPL8-DC
3 讨 论
黑色素瘤是来源于黑色素细胞的肿瘤,常发生于皮肤,恶性程度高,易发生转移,近年来其发生率和死亡率呈上升趋势。黑色素瘤早期以手术切除为主要治疗手段,结合化疗、放疗效果仍不理想,复发率高,5年生存率低于10%,属于难治疗的肿瘤之一,需要新的治疗手段的开发和应用[3]。肿瘤发生过程中常常伴有机体抗肿瘤免疫功能的低下,发生机制包括肿瘤抗原调变、表达减少,以及抗原提呈细胞MHC及共刺激分子的下调等,导致不能有效提呈抗原、刺激产生特异性抗肿瘤免疫应答[4]。肿瘤疫苗研究主要是围绕如何增强肿瘤的免疫原性、增强机体的抗肿瘤免疫应答及如何打破肿瘤免疫耐受这一关键问题。理想的肿瘤疫苗不仅能刺激宿主产生有效的免疫应答,而且还应安全、无不良反应,具有预防肿瘤复发的保护性的长期的免疫记忆功能[5]。
树突状细胞是机体免疫应答反应的首要环节,是唯一能直接激活初始型T淋巴细胞的抗原提呈细胞,在抗肿瘤免疫应答的启动及调控中起着极其关键的作用[6-7]。近年来,利用DC提呈肿瘤抗原,诱导机体产生特异性抗肿瘤免疫是肿瘤免疫治疗研究的一个热点。Lin等[8]将肿瘤抗原基因MAGE-A3转染DC,后者可诱导抗原特异的T细胞应答,活化的T细胞可抑制肿瘤细胞系Huah-7、SGC-7901的生长。Markowicz等[9]给黑色素瘤Ⅲ期患者用负载黑色素瘤抗原肽的DC疫苗进行治疗可使患者3年生存率明显提高。目前抗原致敏的DC疫苗已应用于肿瘤的辅助治疗,但其诱导产生特异性CTL反应的能力还不稳定,究其根本原因在于抗原的免疫原性,与抗原的选择有关。RPL8属于核糖体蛋白家族,参与蛋白质翻译、复制、转录、翻译调控等。研究发现RPL8在脑胶质瘤、黑色素瘤和乳腺癌中高表达,能被CD4+HLA-DR7限制性的Th细胞识别,能激活黑色素瘤患者外周血单个核细胞增殖并产生白细胞介素2,提示RPL8可作为肿瘤抗原,用于肿瘤的免疫治疗[10]。
本实验利用原核表达技术表达目的蛋白RPL8,RPL8冲击致敏DC,获得的负载RPL8的DC免疫治疗小鼠后,能抑制肿瘤的生长,RPL8-DC组肿瘤体积较PBS组和DC组明显缩小。体外实验发现,经RPL8冲击后的DC能激活T细胞,抑制B16黑色素瘤细胞的生长,与PBS组和DC组比较差异有统计学意义。表明所制备负载RPL8的DC具有诱导小鼠产生抗肿瘤免疫的能力。负载RPL8的DC能明显抑制黑色素瘤的生长,PBS组、DC组的小鼠在24 d内均死亡,而负载RPL8的DC组生存期为31 d,荷瘤小鼠的肿瘤体积变化及生存期与对照组比较差异有统计学意义。本研究成功制备了负载RPL8的DC,在体内外可抑制黑色素瘤的生长,为进一步研究其作用机制奠定了基础。
[1]ZHANG H, TIAN M, XIU C, et al. Enhancement of antitumor activity by combination of tumor lysate-pulsed dendritic cells and celecoxib in a rat glioma model[J]. Oncol Res, 2013, 20(10): 447-455.
[2]SONG S, WANG Y, WANG J, et al. Tumour-derived IL-10 within tumour microenvironment represses the antitumour immunity of Socs1-silenced and sustained antigen expressing DCs[J]. Eur J Cancer, 2012, 48(14): 2252-2259.
[3]杨莉, 吴小华, 张志毅, 等. 原发性宫颈及阴道恶性黑色素瘤51例的临床分析[J]. 中国癌症杂志, 2013, 23 (7): 540-546.
[4]YOSHII M, TANAKA H, OHIRA M, et al. Association of MHC class Ⅰ expression and lymph node metastasis of gastric carcinoma[J]. Hepatogastroenterology, 2013, 60(123): 611-615.
[5]SCHADENDORF D, BELORDELLI F, FERRANTINI M, et al. Conference on cancer vaccines[J]. Cancer Immunol Immunother, 2000, 49(4-5): 281-284.
[6]SON C H, BAE J H, SHIN D Y, et al. Ctla-4 blockade enhances antitumor immunity of intratumoral injection of immature dendritic cells into irradiated tumor in a mouse colon cancer model[J]. J Immunother, 2014, 37(1): 1-7.
[7]TEL J, SITTIG S P, BLOM R A, et al. Targeting uptake receptors on human plasmacytoid dendritic cells triggers antigen cross-presentation and robust type Ⅰ IFN secretion[J]. J Immunol, 2013, 191(10): 5005-5012.
[8]LIN L, WEI J, CHEN Y, et al. Induction of antigen-specific immune responses by dendritic cells transduced with a recombinant lentiviral vector encoding MAGE-A3 gene[J]. J Cancer Res Clin Oncol, 2014, 140(2): 281-289.
[9]MARKOWICZ S, NOWECKI Z I, RUTKOWSKI P, et al. Adjuvant vaccination with melanoma antigen-pulsed dendritic cells in stage Ⅲ melanoma patients[J]. Med Oncol, 2012, 29(4): 2966-2977.
[10]SWOBODA P K, SOMASUNDARAM R, CAPUTO L, et al. Shared MHC class Ⅱ-dependent melanoma ribosomal protein L8 identified by phage display[J]. Cancer Res, 2007, 15(67): 3555-3559.
Experimental study of the anti-melanoma effect of dentritic cells pulsed with RPL8 peptide
LI Yan,YIN Ling-si,YUE Huan,HUANG Jun-qiong,HU Yong-lin (Clinical Laboratory, A fi liated Hospital of Zunyi Medical College, Zunyi Guizhou 563003, China)
HUANG Jun-qiong E-mail: junqiongh@aliyun.com
Background and purpose:Studies have shown that ribosomal protein L8 (RPL8) is shared by melanomas, gliomas and ovarian carcinomas. A peptide of RPL8 signi fi cantly stimulated proliferation and cytokine expression of the hepler T cell clone and lymphocytes in melanoma patients. RPL8 may stimulate anti-tumor immunity, making RPL8 an attractive candidate for therapeutic intervention. In this study, we prepared DC pulsed by RPL8 (RPL8-DC) and investigate the anti-tumor effect of RPL8-DC on melanoma in mice.Methods:The recombinant protein was achieved through IPTG induction in E. coli and identi fi ed with Western blot. Bone marrow-derived DC was loaded with RPL8 protein. RPL8 and CD11c, CD80, MHC-Ⅰ, MHC-Ⅱ molecules on dentritic cells were monitored by fl uorescence microscope and FACS analysis, respectively. The anti-tumor effect of T cells in vitro was detected by MTT assay. Subcutaneous tumors were induced in C57BL/6 mice using B16 cells. The tumor volumes were measured after injection with RPL8-DC.Results:The puri fi ed protein was combined with speci fi c antibodies. DCs pulsed by RPL8 were visualized under fl uorescent microscopy. CD11c, CD80, MHC-Ⅰ, MHC-Ⅱ molecules on DCs were up-regulated after stimulation with RPL8 and LPS. B16 cells were inhibited by T cells stimulated with RPL8-DC. The inhibition rate of tumor cells was 70% in RPL8-DC group when effector-to-target ratio was 30∶1, which was higher than PBS and DC groups. Inhibition of growth could be observed more signi fi cantly in mice after the treatment with RPL8-DC. The mice receiving the therapy of RPL8-DC were able to survive much longer than the mice receiving control therapy.Conclusion:The DC pulsed by RPL8 protein can inhibit the growth of melanoma.
Ribosomal protein L8; Dendritic cells; Melanoma; Immunotherapy
10.3969/j.issn.1007-3969.2014.04.007
R739.5;R73-3
A
1007-3639(2014)04-0279-05
2014-01-26
2014-03-26)
贵州省科学技术基金项目(No:黔科合丁字20082198);贵州省卫生厅科学技术基金项目(No:gzwkj2012-1-063)。
黄俊琼 E-mail:junqiongh@aliyun.com

