趋化因子CCL28在乳腺癌中的表达及意义
龚迪和 丁克峰
1.浙江大学医学院附属第二医院肿瘤外科,浙江 杭州 310009;2.温州医科大学附属慈溪医院普外科,浙江 慈溪 315300
趋化因子CCL28在乳腺癌中的表达及意义
龚迪和1,2 丁克峰1
1.浙江大学医学院附属第二医院肿瘤外科,浙江 杭州 310009;2.温州医科大学附属慈溪医院普外科,浙江 慈溪 315300
背景与目的:目前已知趋化因子在乳腺癌的发生、发展中扮演着重要的角色,但对CCL28在乳腺癌的功能报道较少,本研究旨在探讨趋化因子CCL28在人乳腺癌中的表达情况,并分析其与乳腺癌相关临床病理指标之间的关系。方法:采用免疫组织化学方法检测趋化因子CCL28在150例乳腺癌、相应癌旁正常乳腺组织的表达差异情况;分析乳腺癌中CCL28表达与患者年龄、临床分期、肿瘤直径、淋巴结转移状况、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)等临床病理指标的相关性。结果:①CCL28在乳腺癌组及癌旁正常乳腺组中均有表达,在乳腺癌组中CCL28的阳性表达率为54.6%,在癌旁正常乳腺组中的阳性表达率为9.3%;CCL28在乳腺癌组的表达明显高于癌旁正常乳腺组,差异有统计学意义(P<0.001)。②CCL28的表达与患者的年龄、肿瘤直径、临床分期、淋巴结转移与否、ER、PR及HER-2的表达等临床病理指标无关(P>0.05)。结论:CCL28在乳腺癌中呈现高表达而在癌旁正常乳腺组织则表达较少,CCL28可能与乳腺癌发生、发展有关。CCL28在乳腺癌中表达的高低与发生淋巴结转移无明显的相关性,CCL28能否作为预测淋巴结转移的指标有待于进一步的研究。
CCL28;乳腺癌;临床病理指标;转移
乳腺癌是女性最常见的恶性肿瘤之一,严重威胁到女性的身心健康,而且有逐年升高的趋势[1]。近年研究证实,乳腺癌细胞可以产生多种趋化因子,也可以表达多种具有活性的趋化因子受体。趋化因子及其受体构成的复杂的网络体系在乳腺癌生长、发展及转移中起到广泛的作用。趋化因子CCL28,又称黏膜相关上皮趋化因子(mucosa-associated epithelia chemokine,MEC),是CC类趋化因子家族中的一员。Wang等[2]于2000年克隆到人类CCL28基因的读码区,它编码了趋化因子CCL28的127个氨基酸,其中N端的22个氨基酸为信号肽,其受体有CCR10和CCR3。Pan等[3]发现,CCL28的mRNA主要分布于唾液腺、乳腺、气管、小肠及结肠等不同的黏膜部位。有关文献报道CCL28在不同的肿瘤的表达方式及意义较为少见,关于CCL28在乳腺癌中的表达情况及与乳腺癌关系的报道更少。本研究通过免疫组织化学染色方法分别检测乳腺癌组织及癌旁正常乳腺组织中CCL28的表达情况,分析CCL28表达的高低与患者年龄、临床分期、肿瘤直径、淋巴结转移状况、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)等临床病理指标的相关性;探讨CCL28的表达与乳腺癌的发生、发展及转移的关系,为研究乳腺癌的发病、转移机制,判断预后提供新的参考资料,为探索乳腺癌的治疗提供新的靶点。
1 资料和方法
1.1 研究资料
收集温州医科大学附属慈溪医院病理科2004年5月—2013年3月期间乳腺癌手术切除标本150例,150例患者均通过病理诊断确诊,临床资料完整,确诊后均行乳腺癌根治性手术治疗,术前均未行放、化疗及内分泌治疗,其中乳腺单纯癌8例,浸润型导管癌96例,乳腺髓样癌9例,乳腺黏液腺癌6例,其他类型的乳腺癌31例,其中有淋巴结转移者56例,无淋巴结转移者94例,中位年龄48岁(31~78岁),按AJCC和UICC(第七版,2009年)TNM分期:Ⅰ期50例,Ⅱ期68例,Ⅲ期32例。选取手术切除标本中正常乳腺组织(癌旁>3 cm)作为对照。
1.2 方法
1.2.1 主要试剂
兔抗人CCL28 Polyclonal Antibody(PA5-28821) 购自美国Thermo公司;内源性过氧化酶阻断剂(SP KIT-A3)、DAB显色试剂(DAB KIT-0017)购自福州迈新生物技术开发有限公司。
1.2.2 免疫组织化学方法
采用Envision法对150例女性乳腺癌石蜡标本进行CCL28蛋白表达进行检测,实验严格按照检测试剂说明书进行,组织切片常规脱蜡至水,阻断内源性过氧化物酶,放入EDTA抗原修复液,PBS冲洗,兔血清封闭,滴加兔抗人CCL28 Polyclonal Antibody(Thermo公司1∶100稀释),4 ℃冰箱过夜,PBS冲洗,滴加二抗,PBS冲洗,滴加DAB显色剂,复染,常规脱水、透明,封片,镜检,以PBS代替一抗作为阴性对照。
1.3 结果判定
由2位病理医师双盲阅片,每例选取5个不同高倍视野各计数100个细胞,结果判定如下:CCL28阳性细胞表达定位于细胞质,偶见细胞膜阳性表达,以肿瘤细胞的细胞质和(或)细胞膜出现棕黄色颗粒为阳性细胞。按切片中肿瘤细胞阳性细胞率和着色强度分别进行记分。①按阳性细胞百分率记分:<5%为0分,5%~<25%为1分,25%~<50%为2分,50%~<75%为3分,≥75%为4分;②按着色强度记分,分为4个等级:无着色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。最后两者乘积:0分表示阴性;大于1分表示阳性,其中<6分为低表达;≥6分为高表达[4]。
1.4 统计学处理
采用SPSS 11.0统计软件包进行统计分析,P<0.05为差异有统计学意义。采用Pearson检验比较乳腺癌与癌旁正常乳腺组织中各指标表达差异及乳腺癌中各指标表达情况与患者年龄、肿瘤直径、临床分期、淋巴结转移状况、ER、PR、HER-2等临床病理参数的差异。
2 结 果
2.1 CCL28在乳腺癌及癌旁正常乳腺组织中的表达
在150例乳腺癌癌旁正常乳腺导管上皮和(或)小叶上皮细胞中,CCL28呈较弱染色或无染色(图1),CCL28阳性14例,阳性表达率为9.3%;150例乳腺癌中,在乳腺癌细胞的细胞质内可见CCL28呈中到强染色(图2、3),CCL28阳性82例,阳性表达率为54.6%。CCL28在乳腺癌中的表达明显高于癌旁正常乳腺组织,差异有统计学意义(P<0.001,表1)。
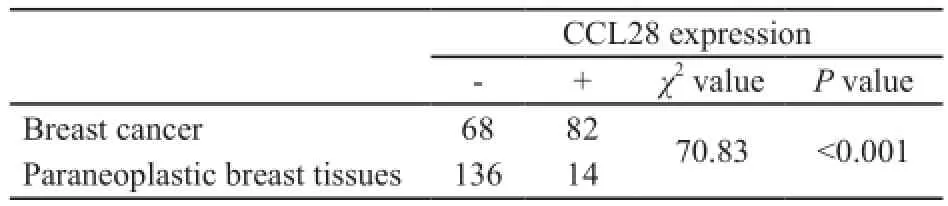
表1 CCL28在乳腺癌及癌旁正常组织中的表达Tab. 1 CCL28 expression in breast cancer and normal paraneoplastic breast tissues
2.2 CCL28与乳腺癌临床病理参数的关系
本研究发现乳腺癌组织中CCL28表达水平与患者年龄、肿瘤直径、临床分期、有无腋淋巴结转移无明显相关性(P>0.05);通过Spearman相关分析发现CCL28表达情况与ER、PR及HER-2表达状态无关(表2)。
2.3 乳腺癌中CCL28表达与腋淋巴转移的关系
本研究中,共有56例发生腋窝淋巴结转移,其中CCL28高表达者为18例;有94例无腋窝淋巴结转移,其中CCL28高表达者为31例,本研究显示CCL28的表达情况与乳腺癌是否发生腋淋巴结转移无关(P>0.05)。
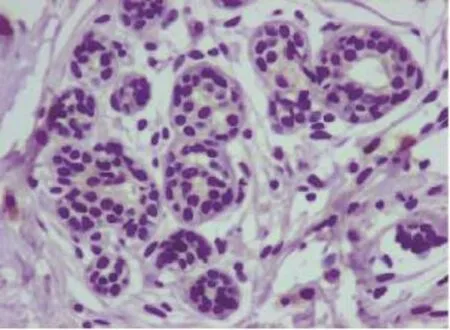
图1 CCL28在癌旁正常组织中呈阴性表达Fig. 1 CCL28 in normal paraneoplastic breast tissues is negative expression (EnVision,×400)
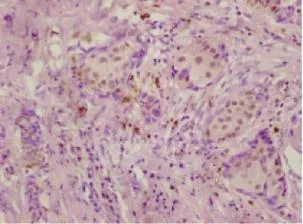
图2 CCL28在乳腺癌组织中的阳性表达Fig. 2 The positive expression of CCL28 in breast cancer (EnVision,×200)
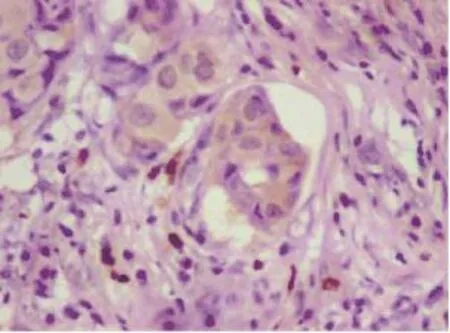
图3 CCL28在乳腺癌组织中的阳性表达Fig. 3 The positive expression of CCL28 in breast cancer (EnVision,×400)
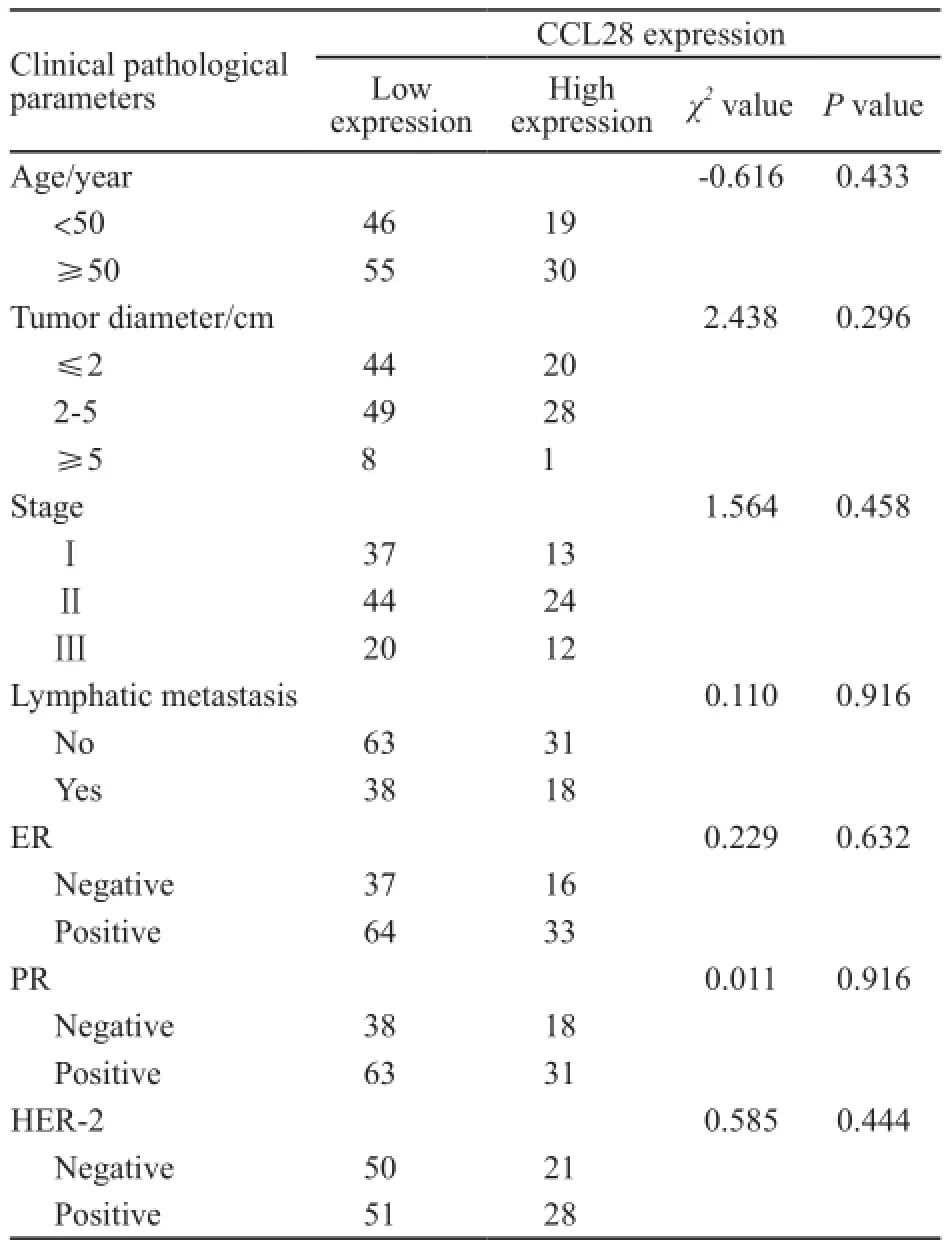
表2 CCL28与乳腺癌临床病理参数的关系Tab. 2 CCL28 expression in breast cancer and its relationship with clinical pathological parameters
3 讨 论
乳腺癌是目前女性最常见的恶性肿瘤之一,其病死率居全球第二位,仅次于肺癌,据世界卫生组织国际癌症研究中心(International agency for research on cancer,IARC)估计,2008年全球女性乳腺癌新发病例达138万,占全部女性恶性肿瘤发病的22.9%。在中国,2009年女性乳腺癌的发病率为21.21/10万,居所有女性恶性肿瘤的首位,而且有逐年升高的趋势。目前认为,乳腺癌是一类生物特征各异的疾病,乳腺癌的发生、发展是由多基因、多阶段作用的结果,虽然经过手术治疗、化疗、放疗、内分泌治疗以及靶向治疗等综合手段的运用,有效的降低了乳腺癌患者的病死率和无瘤生存率,但由于乳腺癌具有侵袭能力强、易发生淋巴转移、术后易复发的特点,仍然是女性恶性肿瘤死亡的主要原因。
趋化因子,又叫趋化性细胞因子,是一类分泌型小分子蛋白,它能趋化细胞定向移动,由70~100个氨基酸组成,相对分子质量为8×103~12×103,目前发现的趋化因子有60余种,按照半胱氨酸残基的数量和位置可将趋化因子分为4类:CXC、CC、C、CX3C 4个亚类[5]。趋化因子在炎性反应、淋巴细胞归巢及免疫反应等方面有重要作用[6-7],近年研究表明,乳腺癌细胞可以产生多种趋化因子,也可以表达多种具有活性的趋化因子受体。趋化因子及其受体家族在乳腺癌生长、发展及转移中起到广泛的作用:有些趋化因子可以通过自分泌和旁分泌的方式促进乳腺癌细胞的增殖,抑制肿瘤细胞的凋亡;诱导血管生成,促进肿瘤细胞的增殖和转移,研究指出CXCL8、CXCL1、CCL2、CCL5、CCL18等趋化因子具有促乳腺癌作用[8];而有些趋化因子及其受体可增强机体细胞的免疫功能,抑制肿瘤血管生成,从而抑制肿瘤生长,如CCL19、CCL21等则可能有抗乳腺癌作用[9-10]。
趋化因子CCL28,又称黏膜相关上皮趋化因子,是CC类趋化因子家族中的一员,在2000年于人和鼠的黏膜组织中被发现,其受体有CCR10和CCR3,可表达于唾液腺、乳腺、气管及结肠等不同的黏膜部位。有研究报道在促炎因子的刺激下,CCL28在结肠上皮细胞中的表达上调,提示CCL28与炎性反应密切相关;Eksteen等[11]发现炎性反应因子LPS或IL-1β能够促使CCL28分泌增多,CCL28与炎性反应有一定的关系;Hieshima等[12]认为CCL28有广谱抗菌活性;目前,关于CCL28与肿瘤的关系研究较少。Dimberg等[13]发现结肠癌患者血清中CCL28蛋白的表达远高于直肠癌患者;最新研究发现,CCL28在缺氧条件下可通过趋化调节性T细胞介导肿瘤血管生成和免疫逃逸,从而使得癌症进展[14]。
国内有研究报道,CCL28能够促进乳腺癌细胞系MDA-MB-231增殖,抑制肿瘤细胞凋亡,可能与上调Bcl-2有关,后者是一种凋亡调控基因,参与肿瘤的发生、发展及细胞凋亡[15]。
本实验研究中,通过检测趋化因子CCL28在癌旁正常乳腺上皮及乳腺癌细胞的表达情况发现,150例乳腺癌中,在乳腺癌细胞的细胞质内可见CCL28呈中到强染色,CCL28阳性82例,阳性表达率为54.6%;在150例乳腺癌癌旁正常乳腺导管上皮和(或)小叶上皮细胞中,CCL28呈较弱染色或无染色,CCL28阳性14例,阳性表达率为9.3%,CCL28在乳腺癌中的表达明显高于癌旁正常乳腺组织,两组差异有统计学意义(P<0.001)。该现象表明趋化因子CCL28可能与乳腺癌的发生、发展有关。
肿瘤的转移是恶性肿瘤的主要生物学特征,是肿瘤患者致死的主要原因,是肿瘤治疗中的最大障碍。肿瘤转移是一个复杂的、多步骤的过程[16],在恶性肿瘤的转移过程中,肿瘤细胞并不是随机迁移的,特定的肿瘤表现出特定的转移方式;肿瘤转移具有嗜器官特异性。在这一过程中趋化因子及其受体起着重要的作用如乳腺癌、黑色素瘤、前列腺癌等恶性肿瘤细胞,其癌细胞的迁移类似于免疫细胞的迁移归巢过程。不同的肿瘤高表达特异的趋化因子受体,而有些器官表达其相应的趋化因子配体,肿瘤细胞借助趋化因子与其受体的特异性结合力,最终达成向这些器官的特异性转移[17]。趋化因子及其受体在恶性肿瘤的转移过程中起着重要的作用,逐渐成为当前的研究热点之一。
乳腺癌转移是导致乳腺癌患者死亡的主要原因,最常见的转移部位是腋窝淋巴结、肺、肝和骨,少见皮肤和肾转移。靶器官中适宜的肿瘤“微环境”是肿瘤发生转移的必要条件,乳腺癌组织上表达趋化因子受体,靶器官上表达相应的趋化因子与表达相应趋化因子的乳腺癌细胞结合,促进肿瘤组织中的生成,导致肿瘤的转移,因此,乳腺癌发生转移与靶器官上所表达的趋化因子有关。Muller等[18]发现,CXCL12能明显增加乳腺癌细胞的趋化及侵袭活性趋化因子受体与相应的配体结合癌细胞伪足形成,促进肿瘤的转移。Li等[19]发现乳腺癌高表达CCR4的患者易发生肺,骨等转移。Andrel等[20]发现乳腺癌细胞上CCR6的表达与乳腺癌转移有关,显而易见,乳腺癌的转移可能涉及多种趋化因子。目前,有关CCL28与乳腺癌转移的研究及报道较少,本实验对150例乳腺癌细胞上CCL28的表达情况进行研究发现,乳腺癌细胞上CCL28的表达与乳腺癌的淋巴结转移亦无相关性,可能由于趋化因子受体CCR3或CCR10在乳腺癌中的作用常常有免疫细胞的参与,通过免疫应答来抑制乳腺癌细胞的生长、转移;抑制肿瘤血管的生成,进而影响趋化因子CCL28及其受体CCR3或CCR10发挥转移效应的作用;因此,CCL28的表达与乳腺癌的淋巴结转移的关系及其在促进乳腺癌转移方面是否有作用有待于进一步的研究。
虽然,越来越多的趋化因子与趋化因子受体被证实与乳腺癌相关,趋化因子及相应的受体在乳腺癌中的作用越来越引起人们的重视,给乳腺癌的治疗带来新的思路,一些趋化因子及其受体已显示出良好的应用前景,但是,趋化因子受体在肿瘤中的作用常常有免疫细胞的参与,趋化因子及其受体效应的作用发挥可能受到多种因素的影响。因此,趋化因子及其受体在未来能否作为乳腺癌治疗的靶点还有待更多的研究。
[1]FACKENTHAL J D, OLOPADE O I. Breast cancer risk associated with BRCA1 and BRCA2 in diverse populations[J]. Nat Rev Cancer, 2007, 7(12): 937-948.
[2]WANG W, SOTO H, OLDHAM E R, et al. Identification of a novel chemokine (CCL28), which binds CCR10 (GPR2) [J]. J Biol Chem, 2000, 275(29): 22313-22323.
[3]PAN J, KUNKEL E J, GOSSLAR U, et al. A novel chemokine ligand for CCR10 and CCR3 expressed by epithelial cells in mucosal tissues[J]. J Immunol, 2000, 165(6): 2943-2949.
[4]YOSHIDA R, NAGIRA M, KITAURA M, et al. Secondary lymphoid tissue chemokine is a functional ligand for the CC chemokine receptor CCR7[J]. Biol Chem, 1998, 273(12): 7118-7122.
[5]ZLOTINK A, YOSHIEO. Chemokines: a new classification system and their role in immunity[J]. Immunity, 2000, 12(2): 121-127.
[6]DEVORA-ROSSI A Z. The biology of chemokines and theirreceptors[J]. Annu Rev Immunol, 2000, 18: 217-242.
[7]SCHWARZ M K, WELLS T N. New therapeutics that modulate chemokine networks[J]. Nat Rev Drug Discov, 2002, 1: 347-358.
[8]AZENSHTEIN E, LUBOSHITS G, SHINA S, et al. The CC chemokine RANTES in breast carcinoma progression: regulation of expression and potential mechanisms of promalignant activity[J]. Cancer Res, 2002, 62(4): 1093-1102.
[9]SHARMA S, STOLINA M, LUO J, et al. Secondary Lymphoid tissue chemokine mediates T cell-dependent antitumor responses in vivo[J]. J Immunol, 2000, 164: 4558-4563.
[10]YANG S C, HILLINGER S, RIEDL K, et al. Intratumoral administration of dendritic cells overexpressing CCL21 generates systemic antitumor responses and confers tumor immunity[J]. Clin Cancer Res, 2004, 10: 2891-2901.
[11]EKSTEEN B, MILES A, CURBISHLEY S M, et al. Epithelial inflammation is associated with CCL28 production and the recruitment of regulatory T cells expressing CCR10[J]. J Immunol, 2006, 177(1): 593-603.
[12]HIESHIMA K, OHTANI H, SHIBANO M, et al. CCL28 has dual roles in mucosal immunity as a chemokine with broadspectrum antimicrobial activity[J]. J Immunol, 2003, 170(3): 1452-1461.
[13]DIMBERG J, HUGANDER A, WAGSATER D. Protein expression of the chemokine, CCL28, in human colorectal cancer[J]. Int J Oncol, 2006, 28(2): 315-319.
[14]FACCIABENE A, PENG X, HAGEMANN I S, et al. Tumour hypoxia promotes tolerance and angiogenesis Ⅵa CCL28 and T(reg) cells[J]. Nature, 2011, 475(7355): 226-230.
[15]林凤娟, 杨小利, 邵志敏, 等. 趋化因子CCL28过表达对人乳腺癌细胞增殖的影响[J]. 中国癌症杂志, 2013, 23(3): 161-166.
[16]NICOLSON G L. Paracrine and autocrine growth mechanisms in tumor metastasis to specific sites with particular emphasis on brain lung metastasis[J]. Cancer Metastasis Rev, 1993, 12(2): 325-343.
[17]SMITH M C, LUKER K E, GARBOW J R, et al. CXCR4 regulates growth of both primary and metastatic breast cancer[J]. Cancer Res. 2004, 64(23): 8504-8612.
[18]MULLER A, HOMEY B, SOTO H, et al. Involvement of chemokine receptors in breast cancer metastasis[J]. Nature, 2001, 410(6824): 50-56.
[19]LI J Y, QU Z L, YU S J, et al. The chemokine receptor CCR4 promotes growth and lung metastasis in breast cancer[J]. Breast Cancer Res Treat, 2012, 131(3): 837-848.
[20]ANDREL F, CABIOGLU N, ASSIL H, et al. Expression of chemokine receptors predicts the site of metastatic relapse in patients with axillary node positive primary breast cancer[J]. Ann Oncol, 2006, 17(6): 945-951.
Study of CCL28 expression in breast cancer
GONG Di-he1,2, DING Ke-feng1(1.Department of Surgical Oncology, The Second Af fi liated Hospital of Zhejiang University School of Medicine, Hangzhou Zhejiang 310009, China; 2.Department of General Surgery, The Cixi Hospital Affiliated to Wenzhou Medical University, Cixi Zhejiang 315300, China)
DING Ke-feng E-mail: dingkefeng@126.com
Background and purpose:Chemokines play an important role in breast cancer occurrence and development. However, little about the function of CCL28 in breast cancer is reported. This study was designed to observe and study the expression of chemokine CCL28 in breast cancer, and analyze their association with pathological features of breast cancer.Methods:Expressions of chemokine CCL28 in 150 breast cancer patients were determined by IHC(immunohistochemistry) technique. The corresponding normal breast tissues in paraneoplastic were also detected. The level of CCL28 expression in 150 breast cancer was analyzed whether it was associated with age, cTNM stage, tumor diameter, axillary lymph node status, ER status, PR status and HER-2 status.Results:①CCL28 was highly expressed in both breast cancer and normal breast tissues in paraneoplastic. The positive expression rate of CCL28 in breast cancer was 54.6% and the positive expression rate of CCL28 in normal paraneoplastic breast tissues was 9.3%. Expression of CCL28 in breast cancer was signi fi cantly higher than that in normal paraneoplastic breast tissues, there was statistically significance between the two groups(P<0.001). ②The expression of CCL28 was not associated with age, cTNM stage, tumor size, axillary lymph node, ER, PR and HER-2 status(P>0.05).Conclusion:The level of CCL28 expression showed signi fi cantly difference between breast cancer and paraneoplastic normal breast tissues. In conclusion, CCL28 may be correlated with breast cancer carcinogenesis and evolvement. The level of CCL28expression was not signi fi cantly correlated with lymph node metastasis. If CCL28 may be a factor to predict lymph node metastasis in breast cancer is worth further studying.
CCL28; Breast cancer; Clinic pathological factors; Metastasis
10.3969/j.issn.1007-3969.2014.04.011
R737.9
A
1007-3639(2014)04-0304-06
2013-12-13
2014-03-02)
丁克峰 E-mail:dingkefeng@126.com

