SERPINA3在子宫内膜癌中表达上调的临床意义及功能研究
杨广东 任渊 张蓉
1.南方医科大学第三临床医学院,广东 广州 510665;2.南方医科大学附属奉贤医院妇产科,上海 201499;3.江苏省常州市妇幼保健院妇产科,江苏 常州 213003
SERPINA3在子宫内膜癌中表达上调的临床意义及功能研究
杨广东1,2 任渊3 张蓉1,2
1.南方医科大学第三临床医学院,广东 广州 510665;2.南方医科大学附属奉贤医院妇产科,上海 201499;3.江苏省常州市妇幼保健院妇产科,江苏 常州 213003
背景与目的:SERPINA3是丝氨酸蛋白酶抑制剂超家族的一员,已有研究证实其在多种肿瘤细胞中异常表达。然而,它在子宫内膜癌中生物学功能及临床意义尚不清楚。本研究旨在探讨SERPINA3在子宫内膜癌细胞中的功能和子宫内膜癌预后评估中的价值。方法:①收集20对子宫内膜癌组织和正常子宫内膜组织,用实时定量PCR(quantitative real-time PCR)检测SERPINA3 mRNA在内膜组织中表达情况;②使用免疫组化方法,检测组织芯片(子宫内膜癌81例和正常对照37例)的SERPINA3表达情况,依据染色结果,用SPSS软件分析SERPINA3与子宫内膜癌临床病理特征之间的关系;③检测5株子宫内膜癌细胞系中SERPINA3的表达情况,选取表达量最高的HEC-1A细胞,利用小片段干扰RNA(small interfering RNA)干扰SERPINA3基因在HEC-1A细胞中的表达;④蛋白质印迹法(Western blot)和qPCR检测干扰后HEC-1A中SERPINA3基因在mRNA和蛋白水平表达情况,细胞迁移实验检测细胞运动能力的变化。结果:①SERPINA3 mRNA在内膜癌中表达明显高于对照内膜组织(n=20,P<0.05);②免疫组化结果显示SERPINA3在子宫内膜癌中的表达水平高于正常子宫内膜组织(P<0.001)。SERPINA3的表达水平与子宫内膜癌的临床分期、肿瘤细胞级别、脉管浸润、淋巴结转移之间比较差异有统计学意义(P<0.05);③干扰SERPINA3组细胞迁移能力显著减弱。结论:SERPINA3基因在子宫内膜癌中表达显著上调,可能与子宫内膜癌的侵袭和转移等相关。SERPINA3有望成为评估子宫内膜癌预后的生物学标志物,并可能作为子宫内膜癌生物靶向治疗的靶标之一。
SERPINA3;子宫内膜癌;组织微阵列;小干扰RNA干扰;迁移
Migration
子宫内膜癌是最常见的女性生殖系统肿瘤之一,其发病率仅次于乳腺癌、肺癌及结直肠肿瘤,目前认为与生活方式密切相关[1]。在北美,仅美国2010年就约有43 470新发患者和7 950死亡患者,位居女性生殖系统恶性肿瘤之首[2]。在我国,随着社会的发展和经济条件的改善,子宫内膜癌的发病率亦逐年升高,目前仅次于宫颈癌,居女性生殖系统恶性肿瘤的第2位。SERPINA3是属于丝氨酸蛋白酶抑制剂家族A亚型,由423个氨基酸组成,包括一个位于氮端的信号肽以及一个具有丝氨酸蛋白酶抑制剂活性的serpin结构域;有多个糖基化位点,总相对分子质量为55×103~66×103[3]。据文献报道,SERPINA3与炎性反应、阿尔茨海默氏病、恶性黑色素瘤、胃癌以及结肠癌等相关[4]。SERPINA3还能够进入细胞核与DNA结合促进染色质浓缩,抑制细胞分裂,进而阻滞细胞增殖[5]。为探寻子宫内膜癌新的治疗靶标提供依据。
1 材料和方法
1.1 主要试剂
子宫内膜癌细胞A N 3 C A、K L E、Ishiakawa、HEC-1A和ECC-1购于武汉大学中国典型培养物保藏中心;siRNA瞬转片段及RNAi Mate转染试剂购于上海吉玛公司;TRIzol购于美国Invitrogen公司;RNA提取试剂盒,购于德国Qiagen公司;Prime Script RT reagent Kit SYBR Premix Ex Taq试剂盒购于Takara公司(大连宝生物); SERPINA3兔抗人多克隆抗体和GAPDH鼠抗人单克隆抗体分别购于Abcam和Proteintech公司;山羊抗兔二抗购于武汉博士德公司;IRDye 800兔二抗和IRDye 680鼠二抗购于美国LI-COR公司;细胞培养DMEM/F12培养基、McCoy’5A培养基、PRMI-1640培养基、Opti-MEM培养基、胎牛血清以及胰蛋白酶购于美国GIBCO公司。Transwell小室购于德国Millipore公司。
1.2 细胞培养
AN3CA、KLE、Ishikawa细胞培养在DMEM/F12培养基;HEC-1A细胞培养于McCoy’5A培养基,ECC-1细胞培养于PRMI-1640培养基,所有细胞培养基中都含有10% (V/V)胎牛血清(FBS),100 U/mL的青霉素和100μg/mL的链霉素,在37 ℃,CO2体积分数为5%,100%湿度培养箱中温育。
1.3 标本收集
收集2007年10月—3013年5月在南方医科大学附属奉贤医院和常州妇幼保健院的81例子宫内膜癌组织和37例同期因子宫肌瘤行子宫切除术的正常内膜组织石蜡标本,用于构建组织芯片,其各取20例子宫内膜癌和正常内膜新鲜组织标本用于提取总RNA,本研究选择的子宫内膜癌患者均有随访信息和临床数据完整。所有子宫内膜癌患者均接受改良根治性子宫切除术或全子宫切除术,联合双侧输卵管、卵巢切除和盆腔淋巴结清扫,有或无腹主动脉旁淋巴结取样,手术前均未接受过放化疗,激素治疗或其他相关的抗肿瘤治疗。同期因子宫肌瘤行子宫切除术的正常增生期子宫内膜(15例)和分泌期子宫内膜(22例)石蜡标本和各10例新鲜组织被选为对照组。新鲜标本离体后迅速至于液氮中,-80 ℃保存。子宫内膜癌的诊断和组织学分类采用国际妇产科协会(FIGO)分期标准和世界卫生组织(WTO)提出肿瘤分级标准进行。患者的临床资料和特征见表1。组织标本的收集经患者签署知情同意书,并通过2所医院人体研究伦理委员会审核许可。
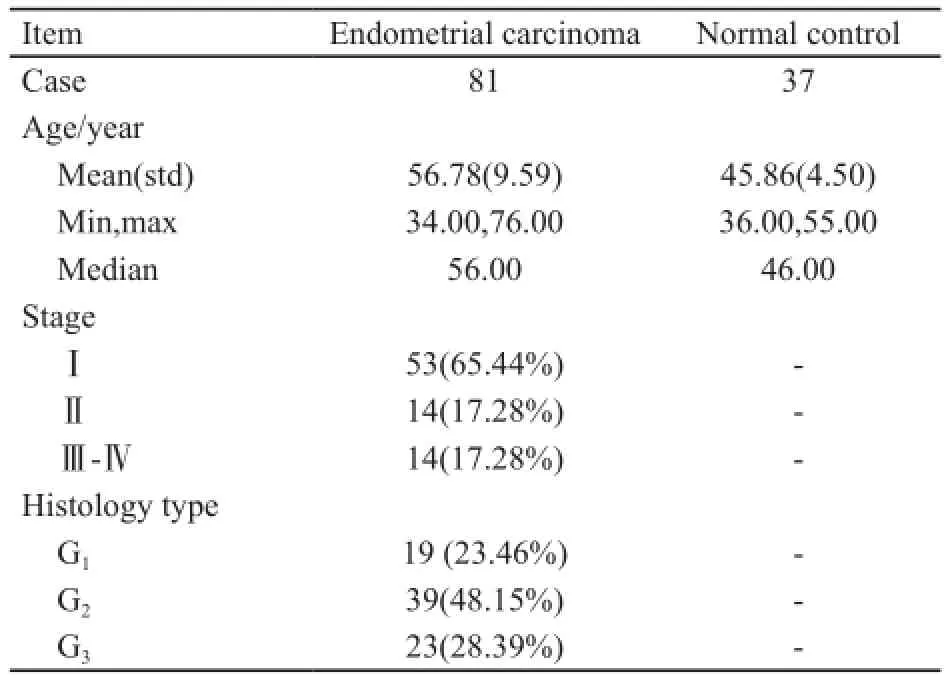
表1 内膜癌患者及正常子宫内膜基本临床信息Tab. 1 Clinical characteristics of normal endometrial tissues and patients with endometrial cancer
1.4 组织芯片的构建
选取并标记HE切片上具有代表性的肿瘤区域、正常内膜组织相应蜡块,肿瘤组织,正常对照每例选取2个点。将所需的靶组织用直径1.0 mm的吸针从供体蜡块靶区取出,按芯片设计的排列顺序定位装载在受体蜡块中。受体蜡块连续4 μm切片备用。
1.5 免疫组织化学染色
白片经70 ℃烤制1 h,二甲苯脱蜡,梯度乙醇水化至蒸馏水后行抗原修复,0.01 mol/L枸橼酸盐缓冲液(pH=6.0) 100 ℃抗原修复10 min。1∶50稀释的SERPINA3兔抗人多克隆抗体,4 ℃温育过夜,1∶200山羊抗兔二抗室温温育1 h,二氨基联苯胺显色,苏木素复染,中性树胶封片。评分标准:阳性细胞所占百分比评分:阳性细胞0~10%为0分,阳性细胞>l0%~30%为1分,阳性细胞>30%~60%为2分,阳性细胞>60%为3分。肿瘤2个点染色不一致时以高评分为准。由2名病理医师双盲阅片和评分,结果一致者为最后判定结果。将结果分为2组:0~1分为低表达,2~3分的为高表达。
1.6 实时定量PCR
使用TRIzol试剂提取细胞和组织中总RNA,根据制造商的说明书通过PrimeScript RT试剂盒通过反向逆转录PCR(rt-PCR)获得cDNA,反应条件为37 ℃,30 min;85 ℃,5 s。随后用ABI7300仪上进行实时聚合酶链反应(real-time PCR)。引物如下:SERPINA3基因上游引物5’-TGCCAGCGCACTCTTCATC-3’,下游引物5’-TGTCGTTCAGGTTATAGTCCC TC-3’;GAPDH基因上游引物5’- TGCGAG TACTCAACACCAACA-3’,下游引物5’-GCATA TCTTCGGCCCACA-3’。两步法PCR扩增总反应体系20 μL,各管分别含GAPDH或SERPINA3上下游引物0.8 μL,cDNA 7.6 μL,SYBR Premix Ex TaqTM(2×)10 μL,Rox Reference Dye(50×) 0.4 μL;PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火31 s,40个循环。扩增过程、荧光信号检查、数据储存和分析均由ABI7300型PCR仪自带软件自动完成,所获数据导至Excle进行计算和分析。
1.7 蛋白质印迹法(Western blot)检测
收集细胞,以含有100 μmol/L PMSF的细胞裂解液裂解细胞,4 ℃,12 000 r/min离心15 min,取上清液采用Bradford法进行蛋白质定量。取50 μg蛋白上样,经10%SDS-聚丙烯酰胺凝胶电泳分离,转移至硝酸纤维素膜,5%脱脂奶37 ℃ 封闭1 h,分别加1∶500稀释的SERPINA3抗体和1∶10 000稀释的GAPDH抗体4℃过夜,1∶10 000稀释的IRDye 800兔二抗或1∶20 000稀释的IRDye 680鼠二抗在室温温育1 h后,由Odyssey红外成像系统检测。实验重复3次。
1.8 瞬转干扰细胞转染试验
HEC-1A细胞生长至80%融合时传代。转染前l d,将对数生长期的细胞(1×105)接种于6孔培养板,每孔所加培养基为1.5 mL。转染时,细胞汇合率为40%~50%。每个细胞收集时间点设3个平行孔。配制工作母液:在含有的双链siRNA干粉中加入125 μL的DEPC水,得到浓度为20 μmol/L的siRNA母液。将RNAi Mate试剂轻柔摇匀,取5 μL RNAi Mate试剂和20 μmol/L的siRNA母液分别与50 μL Opti-MEM混合。把稀释后的siRNA与稀释后的RNAi Mate进行混合,形成siRNA与RNAi Mate稀释液的转染复合物,混合液加入培养细胞,培养6~8h换液。
1.9 Transwell小室体外迁移实验
细胞转染24 h后,胰酶消化,用无血清的DMEM/F12空培配制成4×105/mL的细胞悬液。将微孔直径为8 μm的Transwell细胞趋化小室置于24孔板中,上室种入100 μL细胞浓度为4×105/mL细胞悬液,下室周围加0.7 mL含10%血清的DMEM/F12培养基。每种细胞设3个复孔,常规培养24 h后取出小室,棉签小心拭去滤膜上层剩余细胞,4%多聚甲醛固定30 min,晾干后,1%结晶紫染色30 min。取下微孔滤膜,反面朝上,用中性树胶固定于载玻片上。200倍光镜下随机取5个视野计数膜背面的穿膜细胞,取平均数。实验重复3次。
1.10 统计学处理
实验数据采用SPSS11.0软件进行χ2检验,Fisher确切概率法以及 t 检验。数据如需描述均以表示,P<0.05为差异有统计学意义。
2 结 果
2.1 SERPINA3基因在子宫内膜癌组织中表达上调
实时定量PCR检测20例正常子宫内膜组织和20例子宫内膜癌组织中SERPINA3基因表达差异情况,结果显示在mRNA水平上,SERPINA3 mRNA在子宫内膜癌组织中的表达显著高于正常子宫内膜组织(P<0.05,图1)。
2.2 SERPINA3与子宫内膜癌病理分级、临床分期、脉管浸润和淋巴结转移密切相关
免疫组化检测结果显示,SERPINA3在子宫内膜癌中的表达显著高于正常子宫内膜组织(P<0.05,表2、图2)。分析SERPINA3表达情况与内膜癌临床病理参数之间的关系,发现SERPINA3的表达水平与子宫内膜癌病理分级、临床分期、脉管浸润、淋巴结转移之间有密切的相关性(表2)。在Ⅰ期内膜癌患者中SERPINA3高表达的患者约占35.8%(n=53),而在Ⅱ期和Ⅲ~Ⅳ期患者中,分别高达71.4%(n=14)和92.8%(n=14),三者之间差异有统计学意义(P<0.001),表明SERPINA3表达升高与肿瘤的进展相关;在低分化的内膜癌(G3)中SERPINA3表达明显高于高分化的内膜癌组织(G1),SERPINA3高表达比率分别为69.6%(n=23)和36.8%(n=19),两者比较差异有统计学意义(P=0.034)。发生淋巴结转移的患者中SERPINA3均为高表达(n=6),未发生淋巴结转移的患者中明显降低,为48%(n=75),两者比较差异有统计学意义(P=0.026)。有脉管癌栓的患者中SERPINA3高表达率达81.8%(n=11),而未发生脉管浸润的为47.1%(n=70),两者比较差异有统计学意义(P=0.049)。
2.3 SERPINA3 mRNA在内膜细胞系中表达水平检测及小片段干扰RNA干扰效率验证结果
为了进一步研究SERPINA3在子宫内膜癌细胞系中的表达情况,选择AN3CA、KLE、Ishiakawa、HEC-1-A和ECC-1,5株常用的子宫内膜癌细胞株,利用实时定量PCR的方法检测其SERPINA3 mRNA表达情况。结果显示,HEC-1A细胞中SERPINA3 mRNA的表达最高(图3A)。采用实时荧光定量PCR检测,含3条SERPINA3特异小片段干扰RNA(siRNA)转染子宫内膜癌细胞HEC-1A后SERPINA3基因的mRNA水平表达变化。采用公式2-ΔΔCT值计算,设转染无义片段的HEC-1A细胞(对照组)SERPINA3基因表达量为1,则2-ΔΔCT为转染后SERPINA3基因较未转染基因表达量的倍数,发现siRNA1组、siRNA2组、siRNA3组,SERPINA3 mRNA的表达量分别为27%、15%和20%(图3B)。说明3条SERPINA3基因特异小片段干扰序列对SERPINA3基因均有抑制作用,差异有统计学意义。Western blot检测结果显示,3对siRNA片段均能显著下调HEC-1A细胞SERPINA3蛋白表达水平(图3C)。在随后的实验中选用siRNA2和siRNA3作为干扰组。
2.5 干扰SERPINA3基因后HEC-1A细胞迁移能力明显减弱
悬浮于上室无血清空培中的肿瘤细胞为了逃避凋亡,向含有10%血清的完全培养基方向移动,以24 h内穿过Transwell小室膜细胞数表示细胞的体外迁移能力。结晶紫染色后镜下可见穿膜细胞核呈蓝色,实验组穿膜细胞数量明显较对照组少,差异有统计学意义(P<0.05)。表明转染siRNA靶向干扰SERPINA3后,HEC-1A细胞迁移能力明显降低(图4)。

图1 20对正常子宫内膜和子宫内膜癌组织SERPINA3表达分析Fig. 1 SERPINA3 expression was analyzed in 20 pairs of normal endometrial and endometrial cancer tissues
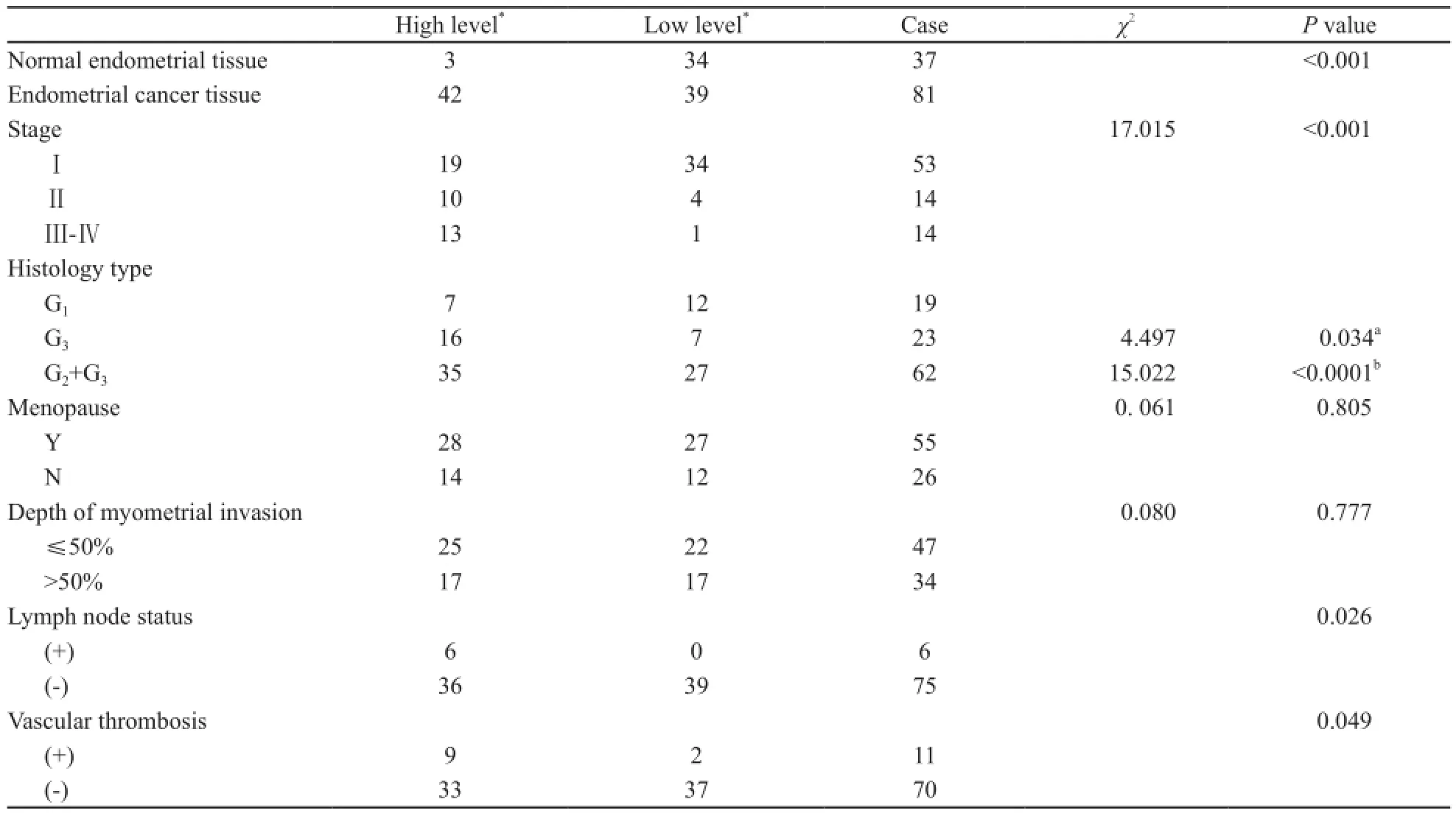
表2 SERPINA3表达水平与子宫内膜癌临床病理特征关系分析Tab. 2 Association of SERPINA3 expression level with the clinical parameters

图2 免疫组化检测正常内膜和子宫内膜癌组织中SERPINA3表达(SP法,组织芯片)Fig. 2 Immunohistochemical detection of normal endometrium and endometrial carcinoma SERPINA3 expression (SP method, tissue microarray)
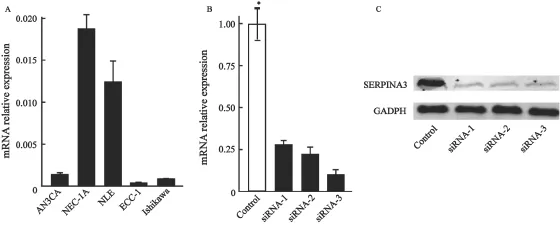
图3 5株内膜癌细胞系SERPINA3表达情况及瞬转干扰HEC-1A细胞SERPINA3表达效率验证Fig. 3 The expression of SERPINA3 in 5 endometrial cancer cell lines and evaluate the ef fi ciency of interference in HEC-1A cells
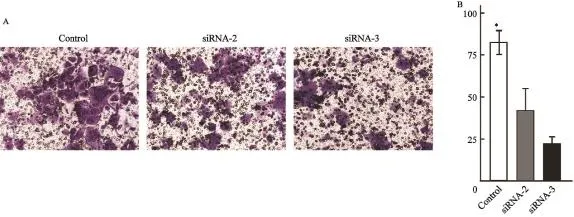
图4 SERPINA3对HEC-1A细胞迁移能力的影响Fig. 4 SERPINA3 impact on migration of HEC-1A cells
3 讨 论
子宫内膜癌是世界范围内女性生殖系统最常见的恶性肿瘤之一。在欧盟国家,每年有81 500例新发患者,全球范围内,子宫内膜癌在女性恶性肿瘤中列第7位[6-7]。虽然女性早期子宫内膜癌的预后相对较好,但仍然有部分患者因复发或转移而导致预后不良,而且子宫内膜癌发病率上升且呈低龄化趋势[8]。我们迫切需要进一步研究子宫内膜癌发生、发展的机制为临床治疗提供有益的指导。在国内,关于SERPINA3与子宫内膜癌发病相关的研究性文章还鲜有报道。本研究结果证实,SERPINA3在子宫内膜癌组织中高表达与肿瘤发生、发展密切相关,而且体外细胞功能实验也与此一致。
SERPINA3表达于各种肿瘤细胞中,如:乳腺癌、胃癌、肝癌、前列腺癌、唾液腺腺肿瘤以及肺腺癌,但SERPINA3在肿瘤发生、发展中的作用尚不清楚[9]。本研究通过组织芯片筛查,发现SEPINA3在内膜癌中表达显著高于正常内膜组织。进一步分析其与子宫内膜癌相关临床病理特点,发现SERPINA3与子宫内膜癌病理分级、临床分期、脉管癌栓和淋巴转移等运动能力相关,通过siRNA干扰SERPINA3表达后细胞迁移能力明显降低。
最近的一些研究其他类型的肿瘤都支持高SERPINA3是不良预后的标志物:例如SERPINA3作为炎性反应信号转导通路上的蛋白之一,在复发性卵巢肿瘤中表达上调,可能在卵巢癌的进展和化疗耐药中发挥重要作用[10];有研究显示在人胎盘疾病中SERPINA3表达上调与基因的5’区域的甲基化相关,研究者通过在绒毛膜癌JEG-3细胞中过表达SERPINA3后观察到细胞免于凋亡[11];此外,已发现肝癌、胰腺癌和前列腺癌患者血浆SERPINA3的含量增高[12-13]。
子宫内膜癌仍然是一个缺乏有针对性治疗的恶性肿瘤。虽然早期子宫内膜癌子宫切除后,为一部分内膜癌患者提供了治愈的可能,然而子宫内膜癌患者总生存率并没有显著改善[14]。有效的生物靶向治疗将可能提高部分内膜癌患者的生存时间和延长复发时间[15]。淋巴结转移和脉管浸润是子宫内膜癌独立的预后因素[16-17],本研究结果还证实SERPINA3与之密切相关。由此推测SERPINA3可能是子宫内膜癌预后不良的标志物。
总之,SERPINA3有望成为评估子宫内膜癌预后的生物学标志物,并可作为子宫内膜癌生物靶向治疗的靶标之一。
[1]TAKAYAMA S, MONMA Y, TSUBOTA-UTSUGI M, et al. Food intake and the risk of endometrial endometrioid adenocarcinoma in Japanese women[J]. Nutr Cancer, 2013, 65 (7): 954-960.
[2]JEMAL A, SIEGEL R, XU J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5): 277-300.
[3]LAW R H, ZHANG Q, MCGOWAN S, et al. An overview of the serpin superfamily[J]. Genome Biol, 2006, 7(5): 216.
[4]DIMBERG J, STROM K, LOFGREN S, et al. Expression of the serine protease inhibitor serpinA3 in human colorectal adenocarcinomas[J]. Oncol Lett, 2011, 2(3): 413-418.
[5]SANTAMARIA M, PARDO-SAGANTA A, ALVAREZASIAIN L, et al. Nuclear α1-antichymotrypsin promotes chromatin condensation and inhibits proliferation of human hepatocellular carcinoma cells[J]. Gastroenterology, 2013, 144(4): 818-828.
[6]PLATANIOTIS G, CASTIGLIONE M. Endometrial cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2010, 21 (Suppl 5): v41-45.
[7]BANNO K, KISU I, YANOKURA M, et al. Epigenetics and genetics in endometrial cancer: new carcinogenic mechanisms and relationship with clinical practice[J]. Epigenomics, 2012, 4: 147-162.
[8]丰有吉, 陈晓军. 妇科恶性肿瘤临床基础研究进展[J].中国癌症杂志, 2006, 16(11): 881-885.
[9]LAI M L, RIZZO N, LIGUORI C, et al. Alpha-1-antichymotrypsin immunoreactivity in papillary carcinoma of the thyroid gland[J]. Histopathology, 1998, 33(4): 332-336.
[10]JINAWATH N, VASOONTARA C, JINAWATH A, et al. Oncoproteomic analysis reveals co-upregulation of RELA and STAT5 in carboplatin resistant ovarian carcinoma[J]. PLoS One, 2010, 5(6): e11198.
[11]CHELBI S T, WILSON M L, VEILLARD A C, et al. Genetic and epigenetic mechanisms collaborate to control SERPINA3expression and its association with placental diseases[J]. Hum Mol Genet, 2012, 21(9): 1968-1978.
[12]MATSUZAKI S, IWAMURA K, ITAKURA M, et al. A clinical evaluation of serum alpha-1-antichymotrypsin levels in liver disease and cancers[J]. Gastroenterol Jpn, 1981, 16(6): 582-591.
[13]ESTELLES A, GILABERT J, GRANCHA S, et al. Abnormal expression of type 1 plasminogen activator inhibitor and tissue factor in severe preclampsia[J]. Thromb Haemost, 1998, 79(3): 500-508.
[14]CHAUDHRY P, ASSELIN E. Resistance to chemotherapy and hormone therapy in endometrial cancer[J]. Endocr Relat Cancer, 2009, 16(2): 363-380.
[15]WEIGELT B, BANERJEE S. Molecular targets and targeted therapeutics in endometrial cancer[J]. Curr Opin Oncol, 2012, 24(5): 554-563.
[16]STEINER E, EICHER O, SAGEMULLER J, et al. Multivariate independent prognostic factors in endometrial carcinoma: a clinicopathologic study in 181 patients: 10 years experience at the Department of Obstetrics and Gynecology of the Mainz University[J]. Int J Gynecol Cancer, 2003, 13(2): 197-203.
[17]吴鸣, 沈铿, 郎景和, 等. 子宫内膜癌206例临床分析[J].中华妇产科学, 2002, 37: 620-621.
Identify effect of SERPINA3 up-regulated expression in endometrial cancer
YANG Guang-dong1,2, REN Yuan3, ZHANG Rong1,2(1. Third Clinical Medical College of Southern Medical University, Guangzhou Guangdong 510665, China; 2. Department of Obstetrics and Gynecology, Fengxian Hospital, Southern Medical University, Shanghai 201499, China; 3. Department of Obstetrics and Gynecology, Changzhou Maternal and Child Care Hospital, Changzhou Jiangsu 213003, China)
ZHANG Rong E-mail: rongzhang@163.com
Background and purpose:SERPINA3 is a protease inhibitor, belonging to the serpin super family. It has been reported that SERPINA3 expression up-regulated in various tumor cells. However, its clinical significance and biological function in endometrial cancer remains unclear. This study was aimed to investigate the effect and prognosis value of up-regulated SERPINA3 (α1-ACT) in endometrial cancer.Methods:①We collected 20 pairs of endometrial carcinoma and normal endometrial tissues then extracted total RNA, detected SERPINA3 mRNA expression by quantitative real-time PCR; ②Immunohistochemistry was used to detect the expression of SERPINA3 in tissue chip which contained 81 endometrial cancer tissue samples and 37 normal controls endometrial tissues, based on the results, using SPSS software to analyze the relationship between SERPINA3 expression with clinicopathological features of endometrial cancer;③The highest SERPINA3 expression was selected from 5 endometrial cancer cells, then small interfering RNA targeted interference SERPINA3 gene expression; ④With real-time quantitative PCR and Western blotmethods, we detected SERPINA3 gene expression in mRNA and protein levels after interference, at last, analyzed cell motility by cell migration assay.Results:①SERPINA3 mRNA expression in endometrial carcinoma was signi fi cantly higher than the control endometrial tissue (n=20, P<0.05); ②Immunohistochemistry also showed SERPINA3 expression in endometrial carcinoma higher than in normal endometrial tissues (P<0.001). The analysis showed that between the expression level of SERPINA3 with endometrial cancer clinical stage, tumor differentiation, vascular invasion, lymph node metastasis, there was a close correlation (P<0.05); ③Interference expression of SERPINA3, endometrial cancer cells migration was signi fi cantly reduced.Conclusion:SERPINA3 gene expression in endometrial carcinoma was signi fi cantly increased and correlated with endometrial cancer invasion and metastasis; SERPINA3 is expected to become the pathological marker of diagnosis and determination in the prognosis of endometrial cancer. It may be used as one of the biological target of endometrial cancer targeted therapy.
SERPINA3; Endometrial cancer; Tissue microarrayer; Small interfering RNA interference;
10.3969/j.issn.1007-3969.2014.04.008
R737.33
A
1007-3639(2014)04-0284-08
2013-12-24
2014-03-05)
上海市卫生局重点科研课题(No:2010249)。
张蓉 E-mail:rongzhang@163.com

