响应面试验优化番木瓜籽中硫代葡萄糖苷酶解工艺
李文钊,杜依登,朱华平*,史宗义,时瀛洲,阮美娟
(天津科技大学食品工程与生物技术学院,天津 300457)
响应面试验优化番木瓜籽中硫代葡萄糖苷酶解工艺
李文钊,杜依登,朱华平*,史宗义,时瀛洲,阮美娟
(天津科技大学食品工程与生物技术学院,天津 300457)
通过单因素试验和Box-Behnken试验设计响应面分析对番木瓜籽中硫代葡萄糖苷(硫苷)的酶解条件进行优化。通过气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪鉴定酶解产物中的异硫氰酸酯种类。结果表明:酶解缓冲液pH值、酶解时间对异硫氰酸酯得率有显著影响,酶解温度影响不显著;得到的最优酶解条件为酶解缓冲液pH 4.8、酶解时间40 min、酶解温度27 ℃,在此条件下异硫氰酸酯得率为13.5‰;GC-MS结果表明,番木瓜籽硫苷酶酶解产物中只含有异硫氰酸苄酯一种异硫氰酸酯。
番木瓜籽;硫代葡萄糖苷;酶解;异硫氰酸酯
番木瓜籽是番木瓜加工过程中的废弃物,一直以来没有得到合理的开发利用[1-2],研究发现,番木瓜籽中含有一定量的硫代葡萄糖苷[3](简称硫苷),硫苷是一种常见于十字花科的次生代谢产物,目前未见报道其有直接的生理功能[4],但当植物受到损伤时,硫苷与内源硫苷酶接触,在不同的条件下降解成一系列的具有生物活性的代 谢产物[5-6],其中以异硫氰酸酯类最受关注。异硫氰酸酯类物质能赋予食物特殊的风味[7],同时,研究表明异硫氰酸酯类物质具有较强的防腐抗菌[8-9]和降低某些癌症发生[10]的作用。目前,已查到相关番木瓜成熟过程中籽中硫苷和异硫氰酸酯类含量的分析报道[11-12],但暂未见有关硫苷转化为异硫氰酸酯类条件优化的研究报告。本研究优化异硫氰酸酯类生成条件,选择性的引导番木瓜籽中硫苷降解生成异硫氰酸酯类,为研究异硫氰酸酯类的生物功能活性提供原料来源,为番木瓜籽的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
番木瓜籽 海南思坦德生物科技有限公司;无水乙醇(分析纯) 天津市化学试剂三厂;氨水、二氯甲烷、磷酸氢二钠、磷酸二氢钠、柠檬酸、抗坏血酸(均为分析纯) 天津市化学试剂一厂;正己烷、无水硫酸钠(均为分析纯) 天津市北方天医化学试剂厂;异硫
氰酸苄酯(纯度98%) 西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
FW100型高速万能粉碎机 天津市泰斯特仪器有限公司;752E紫外可见分光光度计 天津市普瑞斯仪器有限公司;AB204-N电子分析天平、DL22 F&D全自动电位滴定仪 梅特勒-托利多仪器有限公司;HS-4磁力搅拌器 广州仪科实验室技术有限公司;HHS11-2B电热恒温水浴锅 上海医疗器械五厂;XW-80A漩涡混合器江苏海门市其林贝尔仪器制造有限公司;TDZ5-WS台式低速离心机 湘仪离心机仪器有限公司;SHZ-D循环水式真空泵 河南省予华仪器有限公司;RE-3000旋转蒸发仪 上海亚荣生化仪器厂;4000MS气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪 美国瓦里安技术有限公司。
1.3 方法
1.3.1 硫苷酶解条件的单因素试验
分别以原料粒径、料液比、酶解缓冲液pH值、酶解温度、酶解时间为自变量,以异硫氰酸酯得率为考察指标,研究各因素对异硫氰酸酯得率的影响。原料粒径选取90~120、120~150、150~180、180~250、250~380 μm五个水平;料液比选取1∶5、1∶10、1∶15、1∶20、1∶25(g/mL)五个水平;酶解液pH值选取1.5、2.5、3.5、4.5、5.5、6.5、7.5七个水平;酶解温度选取10、20、30、40、50 ℃五个水平;酶解时间选取0、20、40、60、80 min五个水平。
1.3.2 硫苷酶解条件的响应面试验设计
在单因素试验的基础上,选取影响内源硫苷酶活性的主要因素,以异硫氰酸酯得率为考察指标,进行Box-Behnken试验设计优化酶解条件。
1.3.3 异硫氰酸酯含量的测定
在NY/T 1596—2008《油菜饼粕中异硫氰酸酯的测定:硫脲比色法》[13]的基础上进行改进,利用内源酶进行酶解代替在样品前处理中加芥子酶。
1.3.4 异硫氰酸酯提取物制备
木瓜籽粉碎、过筛,按照优化的条件酶解,加二氯甲烷混合均匀,在室温条件下振荡0.5 h,4 000 r/min转速下离心5 min,取下层二氯甲烷相至圆底烧瓶中,接旋蒸仪蒸发去除二氯甲烷,收集残留物,加过量的无水硫酸钠,冷藏待GC-MS分析[14-15]。
1.3.5 异硫氰酸酯提取物的GC-MS分析
色谱条件[16]:D B-5石英毛细管柱(3 0 m× 0.32 mm,0.25 μm);升温程序:50 ℃保持2 min,以10 ℃/min速率升至250 ℃,保持5 min;载气为He,流速1.4 mL/min;进样口温度250 ℃,分流比10∶1,进样量1 μL。
质谱条件:电子电离源;电子能量70 eV;传输线温度200 ℃;离子源温度200 ℃;质量扫描范围m/z 40~600。
1.4 数据处理
单因素试验中每个因素的各个水平和响应面试验设计中的每个试验组合都重复3 次,数据结果采用3 次重复试验的平均值表示,数据使用Microsoft Office Excel 2007进行统计,采用Matlab进行方差分析及多重比较,使用OriginPro 9.0绘制图表,响应面设计及数据分析使用Design-Expert 8.05b。
2 结果与分析
2.1 单因素试验
2.1.1 原料粒径对异硫氰酸酯得率的影响
经方差分析得不同原料粒径对异硫氰酸酯得率的影响极显著(P<0.01);从图1可以看出,随着原料粒径的增大,异硫氰酸酯得率逐渐减小;从原理上讲,粒径越小,酶和底物的接触越充分,得率越高,但是由于粒径越小,所需要的粉碎时间越长,不仅耗费了大量能源,也会产生大量热量,由于异硫氰酸酯易挥发,受热后会有一定的损失,因此,综合考虑本实验选择原料粒径为小于150 μm。

图1 原料粒径对异硫氰酸酯得率的影响Fig.1 Effect of material particle size on the yield of isothiocyanates
2.1.2 料液比对异硫氰酸酯得率的影响
经方差分析得不同料液比对异硫氰酸酯得率的影响显著(P<0.05),经多重比较得料液比(g/mL)为1∶5和1∶20时得率有显著差异;从图2可以看出,在料液比为1∶20时异硫氰酸酯得率最高。

图2 料液比对异硫氰酸酯得率的影响Fig.2 Effect of material-to-liquid ratio on the yield of isothiocyanates
2.1.3 酶解缓冲液pH值对异硫氰酸酯得率的影响
经方差分析得不同酶解缓冲液pH值对异硫氰酸酯得率影响极显著(P<0.01);由图3可见,在pH值小于3.5时,得率随着pH值升高而增大;在pH值大于3.5时,得率随着pH值升高而减小;在pH值在3.5~4.0时,异硫氰酸酯得率最高。据文献[17-18]报道在pH值不同时,硫苷的降解产物也不相同,其主要的降解产物有异硫氰酸酯、腈类、硫氰酸酯、恶唑烷酮等,本试验结果说明,在pH值在3.5~4.0时,番木瓜籽中的硫苷更偏向于转化为异硫氰酸酯。

图3 酶解缓冲液pH值对异硫氰酸酯得率的影响Fig.3 Effect of buffer pH on the yield of isothiocyanate
2.1.4 酶解温度对异硫氰酸酯得率的影响
经方差分析得不同酶解温度对异硫氰酸酯得率影响极显著(P<0.01);从图4可知,番木瓜籽中硫苷酶在20~30 ℃时活性较高。现有文献对的不同来源硫苷酶的最适温度在25~80 ℃均有报道[19-20],说明硫苷酶对温度比较敏感,针对不同来源的硫苷酶要针对性的研究。

图4 酶解温度对异硫氰酸酯得率的影响Fig.4 Effect of hydrolysis temperature on the yield of isothiocyanate
2.1.5 酶解时间对异硫氰酸酯得率的影响

图5 酶解时间对异硫氰酸酯得率的影响Fig.5 Effect of hydrolysis time on the yield of isothiocyanate
经方差分析得不同酶解时间对异硫氰酸酯得率影响极显著(P<0.01);由图5可以看出,在酶解开始20 min内,随着酶解时间延长,异硫氰酸酯得率迅速增加,说明酶解反应初期反应迅速;当酶解时间为20~40 min时,异硫氰酸酯得率达最高点;由于异硫氰酸酯易挥发,随酶解进程到40 min以后,随着酶解时间延长,异硫氰酸酯得率不但没有增加反而呈下降趋势。
2.2 响应面试验
2.2.1 响应面试验设计与结果
以单因素试验结果为基础,根据Box-Behnken模型的试验设计原理,对酶解缓冲液pH值(A)、酶解时间(B)、酶解温度(C)3 个主要因素做响应面试验设计。试验设计方案及结果见表1。
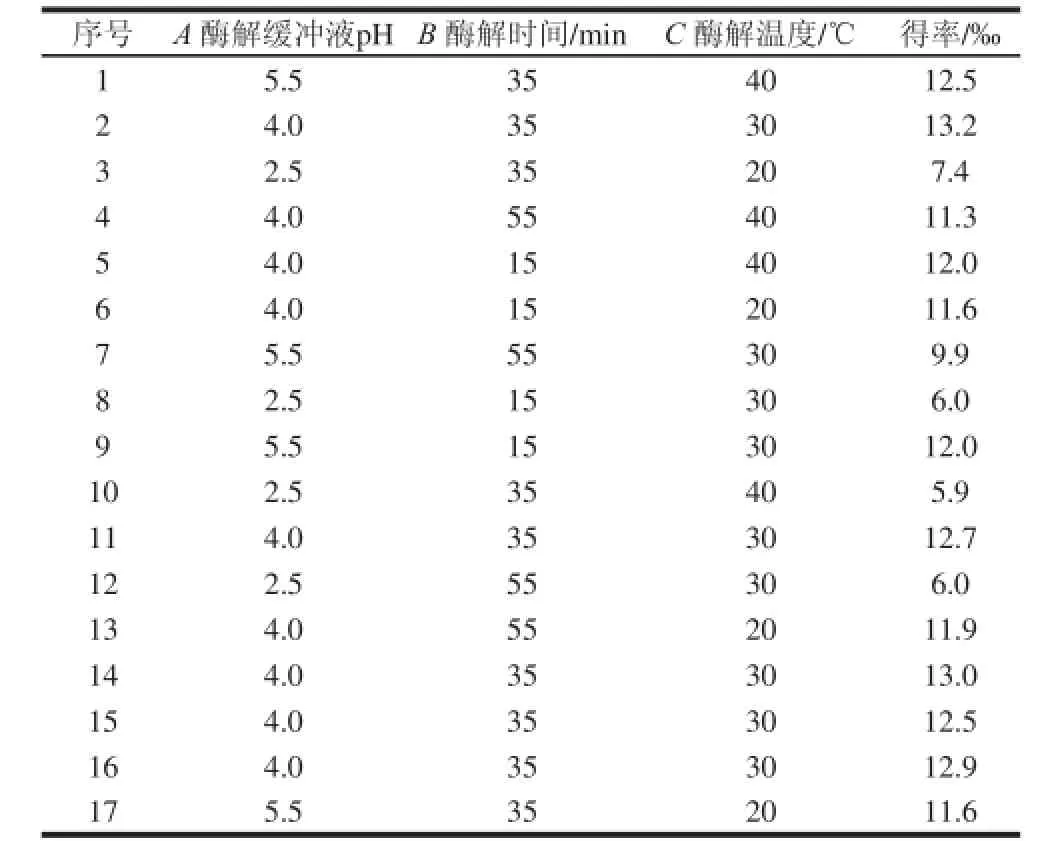
表1 Box-Behnken试验设计方案与结果Table 1 Box-Behnken design scheme and corresponding results
2.2.2 模型方差分析
对表中的试验数据进行响应面回归分析可得到二阶拟合模型:得率/‰=-20.500 89+13.110 83A+ 0.269 94B-0.040 75C-0.017 50AB+0.040 00AC-0.001 25BC-1.496 67A2-0.002 54B2-0.001 42C2。响应面二阶回归模型方差分析见表2。

表2 响应面设计二阶回归模型方差分析表Table 2 Analysis of variance for the second-order regression model
表2显示,该回归模型P<0.000 1,方程模型极显著,失拟项P>0.05,失拟不显著,可以利用该模型预测异硫氰酸酯的最高得率;结果显示,酶解缓冲液pH值对异硫氰酸酯得率影响极显著,酶解时间对得率影响显著,酶解温度对得率影响不显著;pH值和温度、pH值和时间的交互相应对得率有显著影响,说明,试验因素对得率的影响不是简单的线性关系,交互项、二次项也有显著影响。
根据方差分析结果,pH值-时间、pH值-温度之间具有一定的交互效应,因此通过单因素试验不能确定最优酶解条件,需要考虑3 个因素之间的交互作用。通过Design-Expert软件对试验模型进行优化,以异硫氰酸酯得率最高为优化目标,得到在pH值为4.8、酶解时间为40 min、酶解温度27 ℃时异硫氰酸酯得率最高,为13.5‰。
2.3 异硫氰酸酯提取物的GC-MS分析

图6 异硫氰酸酯提取物的GC-MS分析谱图Fig.6 GC-MS profile of isothiocyanates extracted from the hydrolysate
提取物的GC-MS结果见图6,结合标准图谱库初步判定出一种异硫氰酸酯类物质,即异硫氰酸苄酯(保留时间14.10 min),这与文献[21-25]报道称木瓜籽硫苷酶酶解产物中只含异硫氰酸苄酯这一种异硫氰酸酯的结果一致。同时,通过分析发现,提取物中含有异氰酸苄酯(保留时间8.6 min)、苄基腈(保留时间9.00 min)和硫氰酸苄酯(保留时间13.68 min)3 种可能的酶解产物,这说明硫苷并没有完全按照异硫氰酸酯途径酶解,酶解过程中还可能产生了少量以上几种产物,因此,还有必要对硫苷酶解途径进行研究,探讨通过不同酶解条件来控制酶解产物的可能性。
3 结 论
本研究以异硫氰酸酯得率为指标,通过单因素试验,考察了原料粒径、料液比、酶解温度、时间及pH值等因素对番木瓜籽中硫苷酶解反应的影响;并经Box-Behnken试验设计及响应面分析,获得了硫苷酶的最优酶解条件为酶解缓冲液pH 4.8、酶解时间40 min、酶解温度27 ℃,在此条件下异硫氰酸酯得率为13.5‰。GC-MS结果表明,番木瓜籽硫苷酶酶解产物中只含有异硫氰酸苄酯一种异硫氰酸酯,但是酶解产物中同时还鉴定出苄基腈、硫氰酸苄酯和异氰酸苄酯,说明即使在最优反应条件下,硫苷并非完全按照异硫氰酸苄酯途径转化,有必要通过进一步研究考察硫苷在不同酶解条件下酶解途径。
[1] 孔永强, 郑华, 张弘, 等. 我国异硫氰酸酯(ITCs)的开发现状及利用前景[C]//第十一届全国化学工艺学术年会. 郑州: 化工进展, 2011: 291-294.
[2] 周鹏, 沈文涛, 言普, 等. 我国番木瓜产业发展的关键问题及对策[J].热带生物学报, 2010, 1(3): 257-260.
[3] ZHOU Kaibin, WANG Hui, MEI Wenli, et al. Antioxidant activity of papaya seed extracts[J]. Molecules, 2011, 16(8): 6179-6192.
[4] 杨瑛洁, 李淑燕, 胡国伟, 等. 硫代葡萄糖苷的降解途径及其产物的研究进展[J]. 西北植物学报, 2011, 31(7): 1490-1496.
[5] 陈新娟. 中国芸薹属蔬菜硫代葡萄糖苷及其影响因子研究[D]. 杭州: 浙江大学, 2006: 9-10.
[6] TRIPATHI S, SUZUKI J Y, CARR J B, et al. Nutritional composition of Rainbow papaya, the first commercialized transgenic fruit crop[J]. Journal of Food Composition and Analysis, 2011, 24(2): 140-147.
[7] 潘思轶, HYDAMAKA A, KUO A. 辣根风味形成优化[J]. 农业工程学报, 2003, 19(5): 141-146.
[8] CHAVEZ-QUINTAL P, GONZALEZ-FLORES T, RODRIGUEZBUENFIL I, et al. Antifungal activity in ethanolic extracts of Carica papaya L. cv. maradol leaves and seeds[J]. Indian Journal of Microbiology, 2011, 51(1): 54-60.
[9] AZAIEZ I, MECA G, MANYES L, et al. Antifungal activity of gaseous allyl, benzyl and phenyl isothiocyanate in vitro and their use for fumonisins red uction in bread[J]. Food Control, 2013, 32: 428-434.
[10] KERMANSHAI R, MCCARRY B E, ROSENFELD J, et al. Benzyl isothiocyanate is the chief or sole anthelmintic in papaya seed extracts[J]. Phytochemistry, 2001, 57(3): 427-435.
[11] ROSSETTO M R M, DO NASCIMENTO J R O, PURGATTO E, et al. Benzylglucosinolate, benzylisothiocyanate, and myrosinase activity in papaya fruit during development and ripening[J]. Journal of Agricultural and Food Chemistry, 2008, 56(20): 9592-9599.
[12] SEIGLER D S, PAULI G F, NAHRSTEDT A, et al. Cyanogenic allosides and glucosides from Passif l ora edulis and Carica papaya[J]. Phytochemistry, 2002, 60(8): 873-882.
[13] 中华人民共和国农业部. NY/T 1596—2008 油菜饼粕中异硫氰酸酯的测定: 硫脲比法[S]. 北京: 中国标准出版社, 2008.
[14] 袁海娜, 尤玉如. 响应面设计优化西兰花种子异硫氰酸酯制备技术[J].中国食品学报, 2010, 10(4): 178-186.
[15] 李建颖, 卜路霞, 赵彦巧, 等. 自菜粕中提取芥子油甙的最佳工艺研究[J]. 食品研究与开发, 2010, 31(11): 82-85.
[16] 陈虹霞, 王成章, 叶建中, 等. 辣根硫代葡萄糖苷水解工艺比较及其水解产物的结构鉴定[J]. 林产化学与工业, 2009, 29(2): 100-104.
[17] ANNA P, BARBARA K, MAGDALENA M. Myrosinase activity in different plant samples: optimization of measurement conditions for spectrophotometric and pH-stat methods[J]. Industrial Crops and Products, 2013, 50: 58-67.
[18] JED W F, AMY T Z, PAUL T. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants[J]. Phytochemistry, 2001, 56(1): 5-51.
[19] 袁海娜. 异硫氰酸酯的制备、功效分析及包合技术研究[D]. 杭州:浙江大学, 2010: 10-11.
[20] 肖华志. 食用辛辣风味物质异硫氰酸烯丙酯(AITC)的研究[D]. 北京: 中国农业大学, 2004: 12-15.
[21] DAVID J W, SHARON P, MRIDUSMITA C, et al. An unusual combination in papaya (Carica papaya): The good (glucosinolates) and the bad (cyanogenic glycosides)[J]. Journal of Food Composition and Analysis, 2013, 29: 82-86.
[22] KAUL P, SATHISH H A, PRAKASH V. Effect of metal ions on structure and activity of papain from Carica papaya[J]. Nahrung, 2002, 46(1): 2-6.
[23] WILSON R K, TONY K K, CHIU-YIN K, et al. Effects of papaya seed extract and benzyl isothiocyanate on vascular contraction[J]. Life Sciences, 2002, 71(5): 497-507.
[24] 腊贵晓, 方萍. 芥子油苷分解研究进展[J]. 食品科学, 2008, 29(1): 350-354.
[25] NEOH T L, YAMAMOTO C, IKEFUJI S, et al. Heat stability of allyl isothiocyanate and phenyl isothiocyanate complexed with randomly methylated b-cyclodextrin[J]. Food Chemistry, 2012, 131(4): 1123-1131.
Optimization of Enzymatic Hydrolysis Conditions of Glucosinolates from Carica papaya Seeds by Response Surface Methodology
LI Wen-zhao, DU Yi-deng, ZHU Hua-ping*, SHI Zong-yi, CHI Ying-zhou, RUAN Mei-juan
(College of Food Engineering and Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China)
The enzymatic hydrolysis of glucosinolates (GS) from Carica papaya seeds was optimized by response surface methodology with Box-Behnken design (BBD). The resulting isothiocyanates were identified by gas chromatography-mass spectrometry (GC-MS). The results showed that enzyme buffer solution pH and hydrolysis time had significant effects on the yield of isothiocyanates, whereas enzymatic hydrolysis temperature had no significant effect. The optimal hydrolysis conditions were found to be hydrolysis at 27 ℃ for 40 min in a buffer solution at pH 4.8. Under the optimized conditions, the yield of isothiocyanates was 13.5‰. GC-MS analysis showed that only one isothiocyanate—benzyl isothiocyanate was detected in the hydrolysate.
Carica papaya seed; glucosinolates; enzymatic hydrolysis; isothiocyanates
TS209
A
1002-6630(2014)18-0028-04
10.7506/spkx1002-6630-201418006
2013-12-17
“十二五”国家科技支撑计划项目(2012BAD33B09;2012BAD31B06)
李文钊(1970—),女,副教授,博士,研究方向为食品加工与保鲜。E-mail:liwenzhao5518@sina.com
*通信作者:朱华平(1980—),男,副研究员,博士,研究方向为食品营养与安全。E-mail:zhuhuaping@126.com

