透明质酸对体外培养的大骨节病和骨关节炎软骨细胞透明质酸合成酶2 mRNA表达的影响
高宗强,郭 雄,陈君长,段 琛,马玮娟,刘瑞宇,顾其胜
大骨节病是一种慢性变形性、地方性的骨关节病,严重危害了病区人群的健康,目前其发病原因及机制尚不清楚[1],其与骨关节炎具有相似的临床症状、体征及关节软骨病理学变化,尚无有效的促进软骨修复的方法。尽管在最新美国骨科医师学会(AAOS)骨关节炎指南中,对骨关节炎患者关节腔注射透明质酸不予推荐,但在既往临床中,大量病例证实膝关节腔注射透明质酸钠可有效缓解大骨节病、骨关节炎的症状与体征[2-7]。关节炎患者关节液中,透明质酸含量下降,分子量减小,但软骨细胞自身合成、分泌透明质酸的能力有无变化,相关研究较少。补充外源性透明质酸,对软骨细胞自身合成、分泌透明质酸又有何影响,目前亦无相关研究。本课题选择在透明质酸合成酶中至关重要的合成酶2基因作为软骨细胞透明质酸合成能力的观测指标,将大骨节病和骨关节炎软骨细胞和正常软骨细胞比较,观察病理状态下软骨细胞透明质酸合成酶2(HAS2)mRNA表达有何变化,并观察外源性透明质酸干预对软骨细胞自身透明质酸合成的影响。
1 资料与方法
1.1 临床资料 选取2006年8月—2008年7月陕西地方病研究所明确诊断大骨节病,并实施膝关节游离体摘除术后取出的游离体及关节软骨6例为大骨节病组,其中男3例,女3例;年龄35~47岁;西安市红十字会医院明确诊断骨关节炎,并行全膝关节置换术后的膝关节软骨6例为骨关节炎组,其中男3例,女3例;年龄57~73岁。符合我国大骨节病临床诊断标准(GB16003-1995)[8-9]和美国风湿病协会骨关节炎诊断标准(1995年版)[10]诊断大骨节病和骨关节炎。另选择同时期由于车祸等意外原因截肢或身亡者的新鲜膝关节软骨6例为对照组,其中男4例,女2例;年龄27~39岁;取材部位与大骨节病、骨关节炎患者一致,均排除了类风湿性关节炎等其他关节疾患。
1.2 主要试剂与仪器 DMEM/F12培养液(Hyclone公司,美国);小牛血清(兰州明海生物制品有限公司);胰蛋白酶、透明质酸酶、Ⅱ型胶原酶、MTT、 DMSO(SIGMA公司,美国);AnnexinⅤ-PI染液(深圳晶美生物工程有限公司);透明质酸钠(上海其胜生物制剂有限公司);Shel-Lable CO2培养箱(Shel-Lable公司,美国);倒置显微镜(Olympus公司,日本);Nikon双目光学显微镜及纤维照相系统(日立公司,日本);RNAfast200-总RNA 极速抽提试剂盒(上海飞捷生物技术有限公司);cDNA反转录试剂盒(MBI公司,美国);PCR mix(MBI公司,美国);引物合成 (北京奥科生物技术有限责任公司);Agarose琼脂糖(solarbio分装);DL2000Marker (北京万农先锋生物技术公司);
本研究创新点——
本研究对体外培养的人大骨节病和骨关节炎软骨细胞采用不同剂量的透明质酸进行干预,检测干预前后软骨细胞自身透明质酸合成酶2基因mRNA的水平变化,发现与对照组相比,大骨节病和骨关节炎的软骨细胞透明质酸合成酶2表达均有所下降,且骨关节炎下降更明显。补充外源性透明质酸后,发现各组软骨细胞自身合成透明质酸的能力均有增加的趋势,尽管差异无统计学意义,但也为下一步的实验和临床使用透明质酸提供了一定的参考。对于大骨节病和骨关节炎患者透明质酸合成酶2基因的相关研究,目前尚属于空白。
PCR仪(ASTEC公司,日本);GeneGenius全自动凝胶成像分析系统(SynGene公司,英国)。
1.3 软骨细胞的分离与培养
1.3.1 原代细胞的分离与培养 关节置换术后4 h或死亡后12 h内,在无菌条件下取出关节软骨,并转移至无血清的DMEM/F12培养基中带入超净台,将软骨切为1 mm×1 mm的骨粒,先加入10 ml 0.2%的胰蛋白酶,将其放置在37 ℃的摇床上消化1 h,之后加入10 ml 0.1%透明质酸酶消化1 h,最后加入10 ml 0.2%的Ⅱ型胶原酶消化4 h,收集含有细胞的上清液,进行离心,离心后吸取上清的胶原酶重新加入锥形瓶中,对其余的软骨块进行消化。重复收集细胞3次,将收集的细胞放入200目的滤网中进行过滤,过滤后进行收集离心。离心后放入含有10%胎牛血清的DMEM/F12培养液中重新悬浮。得到原代细胞后,按照40万/瓶的密度进行接种,加入4 ml含10%胎牛血清的DMEM/F12培养液,培养液中含青霉素、链霉素各100 U/ml,将培养瓶置于5%CO2,37 ℃的培养箱中进行细胞培养。培养2~3 d后观察:关节软骨细胞呈多变性,并有细胞少数贴壁。在培养过程中,可在倒置显微镜下观察细胞的生长状态。原代细胞在培养箱中72 h后更换培养液,之后每隔48 h进行换液,培养3~4周后形成细胞单层。
1.3.2 传代培养 待原代培养的细胞长满后,弃去瓶中的培养液,使用磷酸盐缓冲液(PBS)冲洗细胞后,加入2 ml 0.25%胰蛋白酶+0.02%乙二胺四乙酸(EDTA)消化液,在倒置显微镜下观察细胞,待细胞明显皱缩、变圆后加入培养液停止消化,之后吹打悬浮液,收集细胞悬浮液进行离心,离心后按照40万/瓶的密度将细胞接种于培养瓶中,放入37 ℃的CO2培养箱进行培养,隔天更换培养基,待细胞长满后,消化细胞,进行下面实验。
1.4 RNA的提取 消化长满的1代细胞,按照20×104/孔的密度接种于6孔板中,每孔加入2 ml培养液,每个病例接种一板,在接种48 h后更换培养基:吸去原培养基,分别加入2 ml含不同剂量透明质酸钠的培养液,每个6孔板分为3组,分别为H0(0 μg/ml)、H100(100 μg/ml)和H500(500 μg/ml),隔天更换培养液,共培养6 d。按RNAfast 200-总RNA极速抽提试剂盒说明书方法提取RNA:每组的两孔合起在冰上加入500 μl 的RA2液,吹打1 min,使其充分混匀;吸取细胞裂解物置于内套管中,按照12 000 r/min(离心半径30 cm),4 ℃下离心1 min;将外套管中的液体弃去,给内套管中加入500 μl洗液离心1 min;重复此过程一次;取出内套管,弃去外套管中液体,仍然套回内套管,不加洗液,按照12 000 r/min(离心半径30 cm),4 ℃下离心1 min;将内套管移入新的eppendorf管中,在膜中央加入30 μl洗脱液,于室温下静置1 min,离心1 min,最终获得总RNA。
1.5 RT-PCR检测 按试剂盒的说明采取一步法反转录cDNA。cDNA 链扩增目的DNA双链。在冰上的EP管中加入以下反应体系:PCR mix 12.5 μl、反转录产物(cDNA) 1 μl、上游引物1 μl、下游引物和无RNA酶的去离子水1 μl,加至25 μl,将上述混合物充分混合,并离心3~5 s。将上述混合物放入PCR仪中进行扩增。HAS2基因上游引物为:5′-ATTGTTGGCTACCAGTTTATCC-3′;下游引物为:5′-CTTTATGTGACTCATCTGTCTC-3′。内参GAPDH上游引物为:5′-TTACTCCTTGGAGGCCATGTGGGCC-3′;下游引物为:5′-ACTGCCACCCAGAAGACTGTGGATGG-3′。 PCR反应条件为:预变性94 ℃ 5 min,变性94 ℃ 30 s,退火53 ℃ 1 min,于70 ℃延伸1 min,共循环35轮。
1.6 PCR电泳及凝胶成像分析 将PCR产物跑电泳后,使用凝胶成像分析系统摄像,并分析条带积分光密度(IOD)值,对各组各条带与内对照GAPDH条带的IOD值的比值进行分析,从而进行目的mRNA表达的半定量分析。

2 结果
2.1 干预前3组HAS2 mRNA表达比较 干预前3组HAS2 mRNA表达比较,差异有统计学意义(P<0.05);其中骨关节炎组较对照组降低,差异有统计学意义(P<0.05,见表1)。
2.2 干预后不同剂量间HAS2 mRNA表达比较 干预后不同剂量间HAS2 mRNA表达比较,差异均无统计学意义(P>0.05,见表2、图1)。
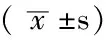
Table1 Comparison of HAS2 mRNA expression levels among 3 groups of chondrocytes before treatment

组别例数HAS2mRNA对照组60654±0018 大骨节病组60610±0027 骨关节炎组60552±0099∗F值4371P值0032
注:HAS2=透明质酸合成酶2;与对照组比较,*P<0.05
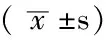
Table2 Comparison of HAS2 mRNA expression levels among different dose groups of chondrocytes after treatment

组别例数对照组大骨节病组骨关节炎组H0组60654±00180610±00270552±0099H100组60720±01480620±00600492±0216H500组60686±00790663±00370572±0029F值068424690550P值052001180588
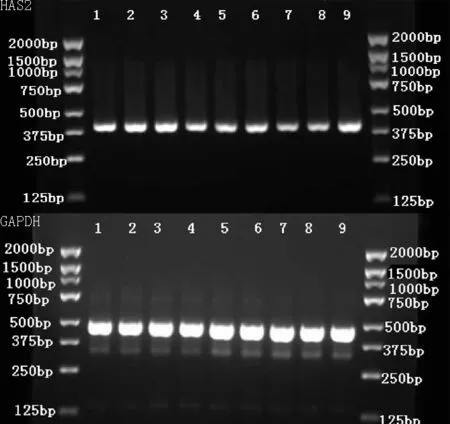
注:1、2、3为对照组H0、H100、H500;4、5、6为大骨节病组H0、H100、H500; 7、8、9为骨关节炎组H0、H100、H500
图1 透明质酸钠干预后各组软骨细胞HAS2 mRNA PCR扩增产物
Figure1 PCR amplification products of HAS2 mRNA in different groups of chondrocytes after hyluronic acid treatment
3 讨论
透明质酸是软骨细胞外基质的重要组成部分,蛋白聚糖单体正是通过连接蛋白附着于透明质酸链上组成聚集蛋白聚糖。其正常的结构和足够的数量是保证软骨基质保持正常形态结构的基础。在关节液中,透明质酸也是重要组成部分,可以有效减少关节摩擦,增加关节润滑度。
在关节退变时,关节软骨中正常的透明质酸链发生降解,附着在透明质酸链上的聚集蛋白聚糖同时发生降解,关节软骨依靠大分子蛋白聚糖聚集水分的能力极大下降,含水量的下降导致关节软骨的弹性降低,分散压力的能力下降,更容易出现损伤。同时关节液中大分子透明质酸逐步降解为小分子透明质酸,并且含量较正常降低,正常的润滑作用明显减低。在这也是临床上关节腔注射透明质酸治疗骨关节炎和大骨节病的重要原因。
通过补充外源性透明质酸, 外源性透明质酸能覆盖于关节软骨和滑膜的表面,防止滑液中的各种蛋白酶和炎性递质通过关节软骨表层的“裂痕”进入软骨基质,从而保护胶原和蛋白多糖免受酶的消化,阻断关节退变的发生。增强关节滑液的润滑作用,改善关节的活动功能。并进入软骨表层与蛋白多糖结合,修复软骨。可稳定伤害性感受器,减轻骨关节炎患者的疼痛症状。
透明质酸合成酶(HAS)是一类存在于细胞膜上,能够特异性作用于透明质酸合成的酶。1996年,美国4个实验室几乎同时确认了真核生物的HAS-cDNAs,证实人类HAS基因是多基因家族,其编码3种同工酶[11]:HAS1、HAS2和HAS3。3种HAS都能在细胞中独立地催化生成透明质酸,但活性各不相同[12],最终表现在生理功能上的不同。HAS3的催化活性大于HAS2,HAS2的催化活性又大于HAS1。Toole[13]通过敲除小鼠HAS1或HAS3基因,发现小鼠仍可以存活,但是敲除HAS2基因时,小鼠却难以生存。这是因为在小鼠的胚胎发育期HAS2的缺乏将会导致透明质酸合成不足,引发严重的发育缺陷,如卵黄囊和心脏缺陷。说明HAS2在发育中是至关重要的。然而,针对不同分子量透明质酸功能差异的研究,目前仍十分有限。HAS1、HAS2、HAS3差别所具有的生理学意义也不十分清楚[14-15]。有研究表明,HAS2与软骨形成和排卵有关[16]。
Yoshida等[17]通过对比发现,类风湿关节炎和骨关节炎患者滑液中HAS1、HAS2表达明显降低,这也许可以解释类风湿关节炎和骨关节炎滑液中透明质酸的含量和分子量都下降。同样有研究显示骨关节炎患者关节滑膜中HAS2表达量明显低于正常对照组[18];在自体软骨移植修复软骨缺损过程中HAS2表达量明显升高[19]。David-Raoudi等[20]观察到硫酸软骨素可以增加骨关节炎患者滑膜、成纤维细胞分泌高分子量透明质酸,并认为是通过上调HAS1和HAS2来实现的,还发现白介素1β(IL-1β)可以刺激HAS3的表达,硫酸软骨素可抑制此过程,增加大分子量透明质酸的分泌。
对于大骨节病患者中HAS的变化,目前尚无相关研究数据。曹佩华等[21]发现中浓度雪腐镰刀菌烯醇(NIV)毒素可显著促进HAS2 mRNA表达,提示在一定范围内毒素可刺激关节软骨合成透明质酸。在另一项研究中,Li等[22]发现T-2毒素可以降低HAS2 mRNA表达,似乎不同毒素对关节软骨细胞HAS2 mRNA的表达影响不同。
本实验结果显示,大骨节病和骨关节炎患者中HAS2表达量有所降低,表明了在大骨节病和骨关节炎患者软骨细胞自身透明质酸的合成能力是下降的。这也为临床上关节腔注射透明质酸提供了理论基础。补充外源性透明质酸钠干预后有一定的促进软骨细胞HAS2 mRNA表达的趋势,尽管无统计学差异,但也许能给我们提示,补充外源性透明质酸还能促进软骨细胞自身透明质酸的合成。这也许能解释为什么临床上关节腔注射透明质酸钠后,疗效仍能长时间维持。
正是由于高分子量透明质酸在退变关节中作用明显,而内源性透明质酸又主要是由HAS2催化生成的,Zhang等[23]提出设想,可将HAS2基因转染入关节,也许可以长期有效地刺激内源性高分子量的透明质酸产生,与传统的关节内注射透明质酸钠相比,作用时间更为持久,可有效避免因反复注射带来的并发症,具有很好的临床应用前景,也许可作为治疗骨关节炎的一个新途径,并于2007年成功地构建了pEGFP-N3-HAS2真核表达载体,并证实经该载体瞬时转染的HEK293细胞,可高效表达HAS2-EG-FP融合蛋白。
提示,也许可以将HAS2基因作为大骨节病和骨关节炎治疗方面一个新的基因靶点。
本实验也有一定的缺陷,至于外源性透明质酸干预后只有变化的趋势,没有统计学差异,可能与样本量过小,而且,早期实验条件所限,采用的是半定量的RT-PCR有关,没有采用更为客观的实时定量PCR,影响了实验数据的精确性,且缺乏蛋白方面的验证。但添加外源性透明质酸后促进软骨细胞自身HAS2基因表达的趋势,也能给临床使用透明质酸提供一定的参考。
1 郭雄.大骨节病发病机制与防治研究的新进展及其展望[J].国外医学:医学地理分册,2010,31(1):1-4,25.
2 杨建伯.成人大骨节病的药物治疗——向骨关节炎治疗经验的借鉴[J].中国地方病学杂志,2005,24(1):87-90.
3 Aggarwal A,Sempowski IP.Hyaluronic acid injections for knee osteoarthritis.Systematic review of the literature[J].Can Fam Physician,2004,50:249-256.
4 Arrich J,Piribauer F,Mad P,et al.Intra-articular hyaluronic acid for the treatment of osteoarthritis of the knee:systematic review and meta-analysis[J].CMAJ,2005,172(8):1039-1043.
5 董军峰,郑之和.透明质酸治疗骨关节炎[J].中国临床医学,2006,13(3):483-484.
6 许鹏,郭雄,靳卫章,等.关节腔内注射透明质酸钠治疗大骨节病的疗效观察[J].中国地方病学杂志,2004,23(6):588-590.
7 凌沛学,沈渤江,金艳,等.透明质酸在骨科中的应用[J].中国药学杂志,2012,47(3):161-165.
8 刘宁.《大骨节病诊断标准》解读[J].中国卫生标准管理,2010,1(4):56-58.
9 大骨节病诊断标准[J].中国地方病学杂志,1994,13(5):309.
10 Zhang W,Moskowitz RW,Nuki G,等.国际骨关节炎研究学会髋与膝骨关节炎治疗指南——第二部分:基于循证和专家共识之治疗指南[J].国际骨科学杂志,2009,30(4):208-217.
11 DeAngelis PL.Hyaluronan synthases:fascinating glycosyltransferases from vertebrates,bacterial pathogens,and algal viruses[J].Cell Mol Life Sci,1999,56(7/8):670-682.
12 Pummill PE,Kempner ES,DeAngelis PL.Functional molecular mass of a vertebrate hyaluronan synthase as determined by radiation inactivation analysis[J].J Biol Chem,2001,276(43):39832-39835.
13 Toole BP.Hyaluronan is not just a goo[J].J Clin Invest,2000,106(3):335-336.
14 Mrosek E,Erggelet C,McDonald JA,et al.Hyaluronan synthases in normal and regenerating joint cartilage[J].Cells Tissues Organs,2003,173(2):93-104.
15 Usui T,Nakajima F,Ideta R,et al.Hyaluronan synthase in trabecular meshwork cells[J].Br J Ophthalmol,2003,87(3):357-360.
16 Nishida Y,Knudson CB,Nietfeld JJ,et al.Antisense inhibition of hyaluronan synthase-2 in human articular chondrocytes inhibits proteoglycan retention and matrix assembly[J].J Biol Chem,2014,289(26):18121.
17 Yoshida M,Sai S,Marumo K,et al.Expression analysis of three isoforms of hyaluronan synthase and hyaluronidase in the synovium of knees in osteoarthritis and rheumatoid arthritis by quantitative real-time reverse transcriptase polymerase chain reaction[J].Arthritis Res Ther,2004,6(6):R514-520.
18 Pavelka K,Forejtova S,Olejarova M,et al.Hyaluronic acid levels may have predictive value for the progression of knee osteoarthritis[J].Osteoarthritis Cartilage,2004,12(4):277-283.
19 杨泉生,朱庆生,李立文,等.透明质酸合成酶2真核表达载体的构建及表达[J].科学技术与工程,2007,7(8):1573-1576.
20 David-Raoudi M,Deschrevel B,Leclercq S,et al.Chondroitin sulfate increases hyaluronan production by human synoviocytes through differential regulation of hyaluronan synthases:Role of p38 and Akt[J].Arthritis Rheum,2009,60(3):760-770.
21 曹佩华,曹峻岭,曹励民,等.NIV毒素对软骨细胞透明质酸代谢的影响[J].国外医学:医学地理分册,2007,28(2):94-96.
22 Li SY,Cao JL,Shi ZL,et al.Promotion of the articular cartilage proteoglycan degradation by T-2 toxin and selenium protective effect[J].J Zhejiang Univ Sci B,2008,9(1):22-33.
23 Zhang DW,Yang QS,Zhu JY,et al.Amelioration of osteoarthritis by intra-articular hyaluronan synthase 2 gene therapy[J].Med Hypotheses,2007,69(5):1111-1113.

