江苏部分地区猪圆环病毒2型的分子流行病学检测
,,,,,,,,,
(扬州大学兽医学院,农业部畜禽传染病重点开放实验室,禽类预防医学教育部重点实验实验室,江苏扬州 225009)
江苏部分地区猪圆环病毒2型的分子流行病学检测
管 萌,宿春虎,许晨旭,刘 星,杨 林,娄亚坤,焦库华,陈素娟,彭大新,刘秀梵
(扬州大学兽医学院,农业部畜禽传染病重点开放实验室,禽类预防医学教育部重点实验实验室,江苏扬州 225009)
根据猪圆环病毒2型(PCV2)基因序列,设计1对特异性PCV2的鉴定引物,利用PCR方法对65份疑似PCV2感染的病料进行检测。PCR检测为阳性的病料经处理后,接种无PCV污染的Dulac细胞进行间接免疫荧光检测。对各分离毒株的全基因组进行PCR扩增、测序和基因型分析。结果表明:共分离鉴定21株PCV2,均属2b基因型,其中有16株为1C群,5株为1A/1B群。研究显示PCV2b 1C群已在江苏成为流行毒株。
猪圆环病毒2型;分离;鉴定;基因型
猪圆环病毒(porcine circovirus,PCV)可分为PCV1和PCV2两种血清型,其中PCV2被认为是断奶仔猪多系统衰竭综合征(PMWS)的主要病原[1],同时与皮炎与肾病综合征、增生性坏死性间质肺炎、呼吸道综合征、繁殖障碍、先天性震颤、肠炎等临床症状相关[2-4]。该病还可引起免疫抑制,在世界范围内广泛存在,已给全球养猪业造成相当严重的经济损失。基于PCV2基因组序列特性,将PCV2分为两个主要的基因型(PCV2a和PCV2b),以及8个基因群(PCV2b-1A~PCV2b-1C和PCV2a-2A~PCV2a-2E)[5]。不同地区和不同年代流行的毒株基因型不同,基因群也在变化[6]。为了进一步了解江苏省近年来PCV2流行状况及病毒变异情况,本试验从江苏省扬州、泰州、盐城等地采集疑似PCV2感染猪的病料,进行PCR检测、病毒分离、全基因组序列分析和系统进化树的构建,为PCV2的防控提供了流行病学资料。
1 材料与方法
1.1材料
1.1.1病料来源
病料主要来源于江苏省扬州、泰州、盐城等地区,其病猪主要表现为精神不振、食欲不佳、皮毛粗乱、皮肤苍白、常伴全身组织黄染;有的在耳部、腹部可见出血性紫红色斑块;部分仔猪出现神经症状,震颤,四肢呈划水状。剖检变化为全身淋巴结肿大,特别是腹股沟淋巴结、肠系膜淋巴结最为明显;肺脏肿大,呈间质性肺炎。无菌采集病猪的淋巴结、肺脏、肝脏、脾脏等组织,置-70℃保存备用。
1.1.2试剂与细胞系
DNA提取试剂盒购自大连Takara生物工程有限公司;DMEM培养液、新生牛血清、胰蛋白酶购自GIBCO生物工程公司;D-氨基葡萄糖、FITC标记羊抗鼠IgG购自美国Sigma公司;Dulac细胞由扬州大学动物传染病实验室保存,经PCR检测PCV1和PCV2均为阴性;PCV2阳性血清是用原核表达的GST-Cap融合蛋白免疫Balb/C小鼠制得的鼠多抗血清。
1.2方法
1.2.1PCR检测
根据GenBank中登录的PCV2核酸全序列(GeneBank Accession:PCV2b-AF055394,PCV2a-AF055392),利用Primer Premier 5设计了1对PCV2特异性的PCR引物P1和P2(表1),扩增长度为569 bp。PCR反应条件:94℃预变性4 min;94℃变性50 s,54℃退火45 s,72℃延伸50 s,共30个循环;72℃延伸10 min。取反应产物15μl在1%的琼脂糖凝胶上电泳检测。

表1本实验所用引物
1.2.2病毒分离与培养
PCR检测阳性组织研磨制成无菌悬浮液后离心取上清,按50 ml/L的比例接种60%~70%融合的Dulac细胞,吸附1 h后37℃培养24 h。用300 mmol/L D-氨基葡萄糖处理30 min,弃去D-氨基葡萄糖,用pH 7.4的 10 mmol/L无菌PBS洗涤2次,然后加入含0.5%胎牛血清的细胞维持液,37℃继续孵育48~72 h后传代培养。连续盲传6代后提取DNA后进行PCR扩增鉴定。
1.2.3间接荧光试验
以50 ml/L的比例将盲传细胞培养物接入已长成单层Dulac细胞的96孔板中,培养48 h后弃去维持液,用0.01mol/L pH7.4 PBS洗涤3次,冷丙酮固定细胞,50 μL/孔,4℃30 min;洗涤后加入1∶1000稀释的PCV2抗体,50 μL/孔,37℃作用1 h;洗涤后加入1∶200稀释的FITC标记的羊抗鼠二抗,50 μL/孔,37℃作用1 h;洗涤后在荧光显微镜下观察结果。
1.2.4全基因组克隆和测序
以P3和P4(表1)引物扩增PCV2基因组,片段长度为1767bp或1768bp。扩增产物克隆到pEASY-T3载体,酶切鉴定后阳性质粒送南京金斯瑞生物科技有限公司进行序列测定。应用Lasergene7.1软件对测序基因片段进行拼接和同源比对,应用MEGA4.0软件NJ法绘制遗传进化树。
2 结果
2.1病料PCR的扩增
将疑似PCV2感染的病料组织提取DNA,经PCR扩增后可见1条600bp左右的条带(图1),与预期相符。病料的阳性检出率为32.3%(21/65)。
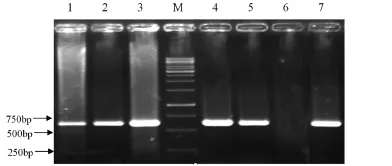
图1部分病料中PCV2的PCR检测结果
2.2间接免疫荧光检测结果
盲传6代后细胞接种Dulac细胞后经PCV2抗体染色后,细胞核内呈特异性亮绿色荧光(图2),而PCV阴性血清、PRV、PPV和PRRSV阳性血清没有特异性荧光,共鉴定出21株PCV2(表2)。
2.3全基因序列测定及分析
对分离的阳性样品用引物P3/P4扩增目的片段,PCR产物大小约1800 bp(图3),连接至T载体后测定序列,全长均为1767 bp。从GenBank中选取16株来自不同国家和地区的PCV2基因组序列(表3),与21 株分离株的全基因组序列进行比较,绘制进化树(图4),结果表明分离到的21株PCV2均为PCV2b亚型,其中16株为PCV2b 1C,5株为PCV2b 1A/1B。

图2 PCV2部分分离株IFA结果(20×)
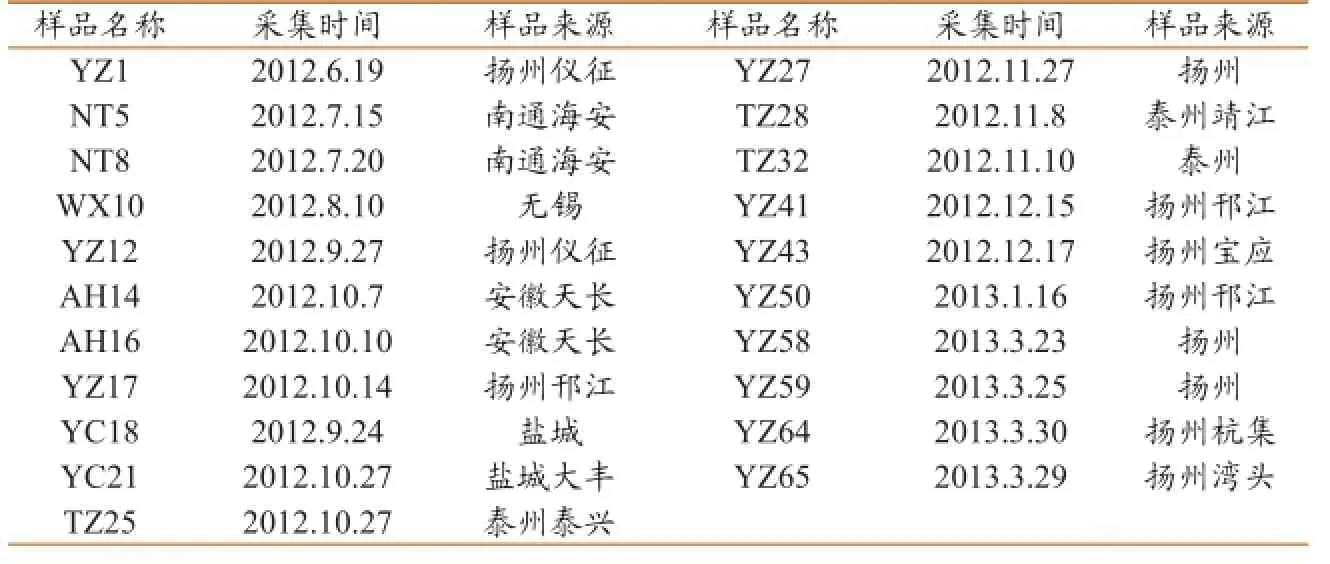
表2 21株PCV2的来源和命名

图3 PCV2部分分离毒株基因组全长扩增结果
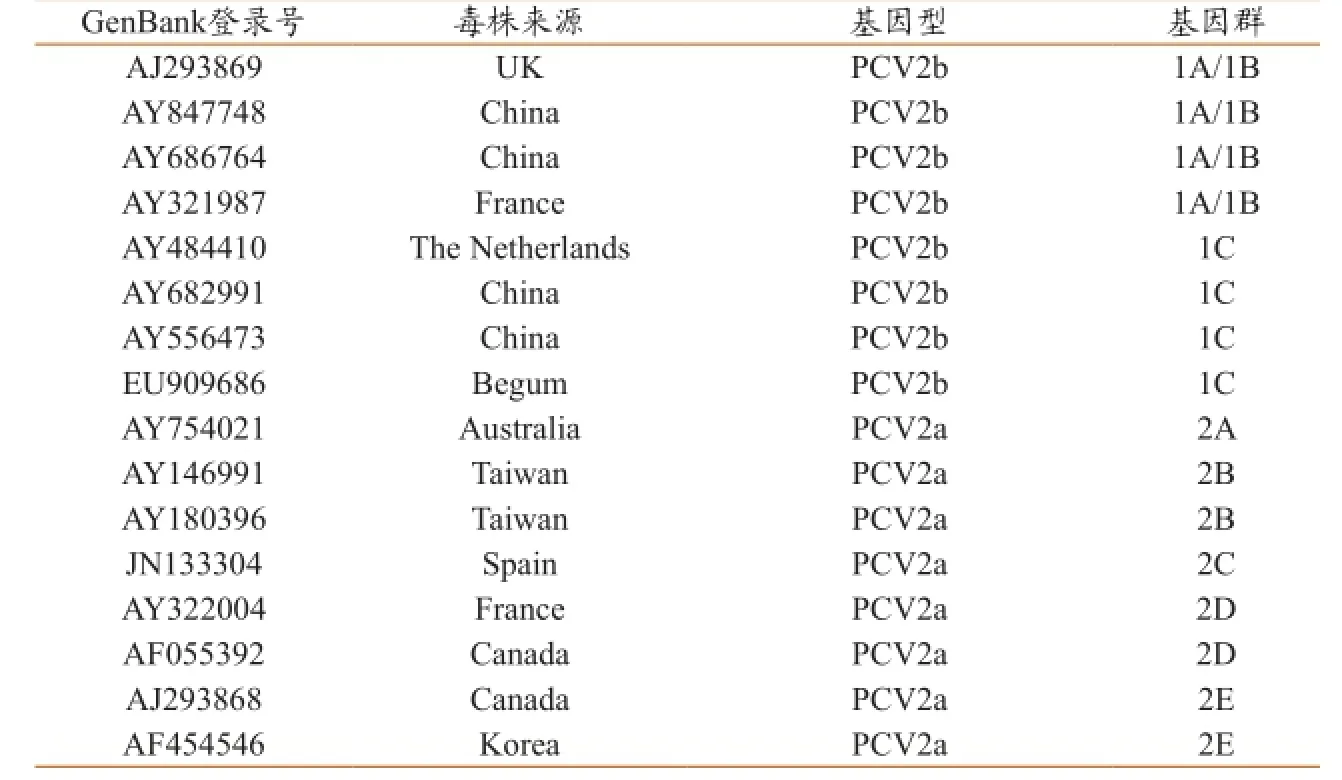
表3本实验中引用的PCV2参考序列
2.4PCV2 ORF2序列分析
截取2 1株P C V 2分离株的ORF2基因序列进行比对,PCV2分离株ORF2 序列之间的核苷酸同源性为94.3%~100%,与参考序列AY146991(PCV2a)同源性为92.0%~93.6%、EU909688(PCV2b)同源性为94.3%~99.1%、EU148505(PCV2c)同源性为89.0%~90.7%。
氨基酸序列比对发现主要变异位点为53~91、121~151、190~210和230~234,在第8、169和215等位点也有变异(图5、表3)。PCV1A/1B 群拥有Y8、R59、R89、E90、S121、A190和E210位点,而PCV 1C群拥有I53、K59、N68、L89、T90、N134、R/G169、T190、I215和K234位点。
3 讨论
PMWS自1991年加拿大首次报道以来逐渐呈流行趋势,而PCV2感染是引起PMWS必不可少的致病因素[7]。郎洪武等在2000年首次在我国检测到PCV2,其阳性率为43.9%[8]。张建武等在对全国PCV2流行病学调查发现,发病猪PCV2阳性率为28.85%(60/208),健康猪为6.12%(3/49),总阳性率为24.51%(63/257)[9]。赵津等对华东地区的 2008—2010年期间收集的1017份血清样品进行PCV2的检测总阳性率达到59.9%[10]。郭抗抗等对NCBI 中登录的556个PCV2分离株全基因序列进行分析显示1999—2002 年所登录的PCV2的优势流行毒株为基因A型(PCV2a);从2003年开始基因B型(PCV2b)逐渐为优势流行毒株[11]。本研究中,对江苏省不同地区发病猪的65份病料进行检测,检出率为32.3%,经测序比对均为PCV2b型,表明目前PCV2b仍然是江苏地区的优势基因型。
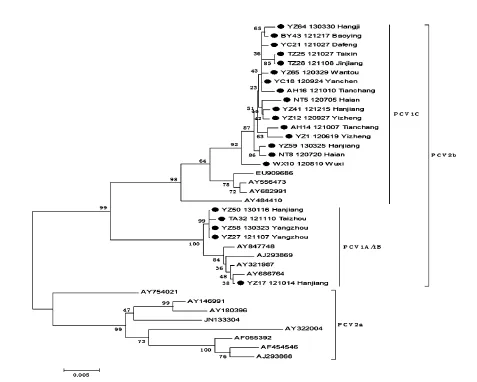
图4 PCV2分离株的系统进化树

图5 PCV2分离株间ORF2的氨基酸序列差异性分析
PCV2b中的1A/1B在2001—2008年间为主要的基因群,而1C在2002年首次发现以后,2009年以后逐渐成为占主导的基因群[6]。在我们分离出的21株PCV2中有5株属于1A/1B基因群,16株为1C基因群。PCV21A/1B基因群的ORF2序列长度为702 bp,而1C基因群由于核衣壳蛋白的C末端终止密码子之前增加了一个赖氨酸密码子,其ORF2序列长度变为705 bp。Wenliang Li等[4]对氨基酸位点进行统计分析时发现,PCV2 每个群都有其特异的氨基酸变异位点,如Y8,R59,R89,E90,S121,A190,E210位点,仅仅为 PCV1A/1B 群所特有的;而 I53,K59,N68,L89,T90,N134,R/ G169,T190,I215,K234为PCV 1C群的特异性的氨基酸位点。本研究的结果完全符合上述群的特异性位点,这对于临床上区别PCV2基因群具有一定的指导意义。由于ORF2编码的Cap蛋白中氨基酸的变异对PCV2的致病性有重要的影响[12],而Cap蛋白的86-91表位是区分PCV2a 和PCV2b的重要标志之一[13],这些变异位点对不同基因群PCV2的抗原性和致病性影响还有待于进一步研究。
[1] Resendes A R,Majo N,van den Ingh TS,et al. Apoptosis in postweaning multisystemic wasting syndrome(PMWS)hepatitis in pigs naturally infected with porcine circovirus type 2(PCV2)[J] . Vet J,2011,189(1):72-76.
[2] Kennedy S,Segales J,Rovira A,et al. Absence of evidence of porcine circovirus infection in piglets with congenital tremors [J]. J Vet Diagn Invest,2003,15(2):151-156.
[3] Chae C. A review of porcine circovirus 2-associated syndromes and diseases [J]. Vet J,2005,169(3):326-336.
[4] Li W,Wang X,Ma T,Feng Z,et al. Genetic analysis of porcine circovirus type 2(PCV2)strains isolated between 2001 and 2009:genotype PCV2b predominate in postweaning multisystemic wasting syndrome occurrences in eastern China [J]. Virus Genes,2010,40(2):244-251.
[5] Olvera A,Cortey M,Segales J. Molecular evolution of porcine circovirus type 2 genomes:phylogeny and clonality [J]. Virology,2007,357(2):175-185.
[6] Cai L,Ni J,Xia Y,et al. Identif i cation of an emerging recombinant cluster in porcine circovirus type 2 [J]. Virus Res,2012,165(1):95-102.
[7] Wellenberg G J,Pesch S,Berndsen F W,et al. Isolation and characterization of porcine circovirus type 2 from pigs showing signs of post-weaning multisystemic wasting syndrome in The Netherlands [J]. Vet Q ,2000,22(3):167-172.
[8] 郎洪武,张广川,吴发权,等. 断奶猪多系统衰弱综合征血清抗体检测[J]. 中国兽医科技,2000,30(3):3-5.
[9] 张建武,庄金山,刘长龙,等. 2007 年中国部分地区猪圆环病毒 2 型分子流行病学分析[J]. 中国农业科学,2009,42(8):2949-2957.
[10] 赵津,张小敏,周斌,等. 2008 ~ 2010 年华东部分地区猪圆环病毒 2 型感染血清学调查[J]. 中国动物传染病学报,2010(6):49-52.
[11] 郭抗抗,张彦明,张红,等. 猪圆环病毒 2 型分离株优势基因型分析与检测[J]. 中国预防兽医学报,2010,32(10):808-811.
[12] Fenaux M,Opriessnig T,Halbur P G,et al. Two amino acid mutations in the capsid protein of type 2 porcine circovirus(PCV2)enhanced PCV2 replication in vitro and attenuated the virus in vivo [J]. J Virol,2004,78(24):13440-13446.
[13] Cheung A K,Greenlee J J. Identif i cation of an amino acid domain encoded by the capsid gene of porcine circovirus type 2 that modulates intracellular viral protein distribution during replication [J]. Virus Res,2011,155(1):358-362.
Molecular epidemiological surveillance of porcine circovirus type 2 in part of Jiangsu province
Guan Meng,Su Chunhu,Xu Chenxu,Liu Xing,Yang Lin,Lou Yakun,Jiao Kuhua,Chen Sujuan,Peng Daxin,Liu Xiufan
(Key Laboratory of Animal Infectious Diseases,Ministry of Agriculture;Key Laboratory for Avian Preventive Medicine,Ministry of Education;College of Veterinary Medicine,Yangzhou University,Yangzhou 225009,China)
According to the genome sequences of porcine circovirus type 2(PCV2),one pair of primer was designed to detect PCV2 by PCR in 65 samples from the suspected cases of PCV2 infection. The positive samples were inoculated on to Dulac cells and subjected to indirect immunof l uorescence assay. The genome sequences of the isolates were amplif i ed with PCR ,sequenced,and gene typed. The results showed that a total of 21 PCV2 strains was isolated and identif i ed,and all the isolates belonged to genotype 2b,of which 16 isolates were grouped into cluster 1C and 5 isolates were grouped into clusters 1A/1B. The data indicated that PCV2b cluster 1C was the prevailing strain in Jiangsu.
porcine circovirus type 2;isolate;identify;genotype
S852.65
:A
:1005-944X(2014)02-0062-05

