鹿布鲁氏菌实时荧光定量PCR检测方法的建立
,,,,,,,,
(1.吉林农业大学大学动物科学技术学院,吉林长春 130118;2.吉林农业大学中药材学院,吉林长春 130118)
鹿布鲁氏菌实时荧光定量PCR检测方法的建立
郝俊伟1,张 云1,杨宇航1,刘红娜1,王文玉1,张秀丽1,时 坤2,李建明2,杜 锐2
(1.吉林农业大学大学动物科学技术学院,吉林长春 130118;2.吉林农业大学中药材学院,吉林长春 130118)
本研究依据布鲁氏菌的特异性基因Omp25c的部分片段作为靶基因,设计探针引物,且优化了反应体系,筛选出引物、探针的最优浓度配比。将扩增产物连接到PGEM-T载体上,制备标准品及标准曲线,建立鹿布鲁氏菌荧光定量PCR检测方法,并对其特异性、稳定性、敏感性进行评价。由标准曲线可知该方法的最低检测浓度可达到36拷贝/µL,比常规PCR灵敏度高出很多。
鹿;布鲁氏菌;实时荧光定量PCR
布鲁氏菌病(Brucellosis)是一种严重危害人类健康及畜牧业生产的人兽共患病,临床以怀孕母畜流产、空怀不育、子宫炎、乳房炎和公畜发生睾丸炎、关节炎等为特征。一般根据其宿主的嗜好性分为牛、羊、猪、犬、绵羊附睾和沙林鼠种布鲁氏菌6个种及20个型[1]。本病分布很广,严重损害人畜的健康。布鲁氏菌的抵抗力比较强,在土壤、水中和皮毛上能生存较长时间,但煮沸后立即死亡,常用浓度的消毒药在几分钟内能将其杀死[2]。自1940年间鹿布鲁氏菌病被首次确立以来,鹿布鲁氏菌病广泛发生于世界各地,给养鹿业带来了严重的经济损失。在我国梅花鹿群中流行的布鲁氏菌病经吉林省地方病研究所确定为羊型、牛型和猪型三种。还有其他非典型布鲁氏菌在鹿群中流行[3]。
诊断技术一直是布病研究的重要领域[4],最初检测布鲁氏菌是采用细菌培养法,但该法所需时间长,操作活菌非常危险,且需要有经验的技术人员才能完成。根据 GB/T18646—2002 国标规定,虎红平板凝集试验(RBT)、全乳环状凝集试验(MRT)、试管凝集试验(SAT)和补体结合试验(CFT)等经典试验方法为我国动物布病的诊断技术[5]。但这些方法有的特异性和敏感性不高、操作繁琐,在实际应用中不方便。随着免疫学技术的发展,诊断布鲁氏菌病多采用血清学方法,但该方法因不能区分疫苗免疫和自然感染使其运用受到限制,其灵敏度及特异性也较差[6-8],很难真正实现疾病的准确监测和诊断,而基于分子生物学的方法则能弥补这些方法的不足。实时荧光定量 PCR 检测方法是近年来应用较为普遍的一种快速检测方法,具有快速、准确的优点,适用于快速检测和排查。
1 材料与方法
1.1材料
1.1.1菌株 Mycobacterium tuberculosis、BCG、BVDV、Brucella suis(S2)、大肠杆菌DH5a均由本实验室保存。
1.1.2主要试剂以及仪器设备 PGEM-T SimpleVector购自Takara(大连)公司;蛋白酶K购自Merck公司;溶菌酶购自Bebco公司;Ex TaqTM DNA聚合酶购自Takara(大连)公司;DL2000/ DNA Marker购自Takara(大连)公司;质粒DNA提取小量试剂盒、DNA凝胶回收试剂盒均购自杭州爱思进生物技术有限公司。超微量快速核酸蛋白测定仪UV-1800(日本岛津-GL消耗品销售公司);MastercyclerR ep.Realplex4购自Eppendorf公司;梯度PCR仪,德国Eppendorf公司;全自动凝胶成像分析系统,美国Wealtec公司;高速离心机,德国Eppendorf公司;单道微量可调移液器,芬兰百德生物有限公司;其他实验耗材,杭州AXYGEN生物技术有限公司。
1.2方法
1.2.1细菌DNA的提取 本实验采用常规方法酚氯仿提取基因组,-20℃保存备用。
1.2.2探针引物的设计与合成 根据布鲁氏菌特异性基因Omp25c的保守片段,设计特异性探针和引物。探针的5'端标记荧光报告基团为FAM,3'端标记荧光淬灭基团TAMRA。

表1扩增OMP25C的引物和探针
1.2.3引物退火温度的优化 退火温度选择50~54℃之间,经对5个温度的筛选,选取扩增效率较高,即最亮条带。
1.2.4目的基因的克隆 以猪型布鲁氏菌疫苗S2株的DNA为模板,用上述引物扩增,并进行回收、纯化、转化、提取重组质粒、进行PCR扩增鉴定、测序。
1.2.5标准品的制备和拷贝数的计算 使用UV-1800(岛津)对阳性质粒进行吸光度的检测,OD260值有效范围在0.2~0.8之间,代入下列公式计算结果。若阳性质粒的OD260值不在有效范围,可将其适度稀释。

1.2.6实时荧光定量PCR的体系优化及标准曲线建立
1.2.6.1探针退火温度优化 将荧光PCR退火温度分别设置为53℃、55℃、57℃进行扩增,确定最佳的退火温度。
1.2.6.2探针浓度优化 将探针浓度分别为100、200、300、400、500 nM进行荧光定量PCR扩增,确定探针的最佳浓度。
1.2.6.3引物浓度优化 将引物浓度分别为100、200、300、400、500 nM进行荧光定量PCR扩增,确定引物的最佳浓度。
1.2.6.4标准曲线的建立 将重组质粒做10倍系列稀释,取稀释浓度依次为1×106~1×102拷贝/ µL,共五个稀释度,每稀释度设置一个对照组,以双蒸馏水为模板,设3组重复对照组,进行实时荧光定量PCR检测。检测完毕后,采用随机分析软件,分别录入相应阳性质粒拷贝数,通过收集的荧光曲线和Ct值判定结果,绘制标准曲线。
1.2.7实时荧光定量PCR的试验评价
1.2.7.1特异性试验 提取Mycobacterium tuberculosis、BCG、BVDV、Brucellosis suis(S2)基因组(其中BCDV为提取RNA后反转录为cDNA),并设置空白对照,以检测该方法的特异性。
1.2.7.2敏感性试验 取Brucellosis suis(S2)Omp25c重组质粒基因组DNA的标准品10倍梯度稀释,以其为模板进行PCR。
1.2.7.3 稳定性试验 将Omp25c特异性基因标准阳性质粒为模板,按照相同反应体系重复做5管,评价该方法的稳定性。
1.2.8临床样品检测 取东丰种公鹿场现场分离的布鲁氏菌病阳性病料10份,疑似病料3份应用本实验方法进行检测。
2 结果
2.1目的基因的克隆 以S2株的DNA为模板扩增出的目的片段为149bp(图1)
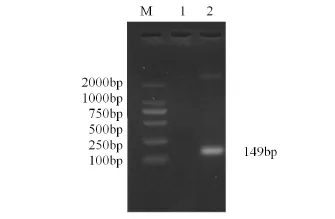
图1 Omp25cPCR扩增结果
2.1.1Omp25c重组质粒PCR扩增 PCR产物经1.5%琼脂糖凝胶电泳分析,目的片段大小为149bp,与预期结果相符(图2)
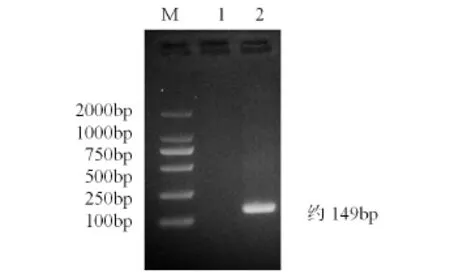
图2 Omp25c重组质粒PCR结果
2.1.2Omp25c重组质粒测序结果与Gen bank上发表的Omp25c同源性进行分析和比对,同源性为100%。
2.2Omp25c引物退火温度的优化结果 退火温度选择50~54℃之间,经对5个温度的筛选,退火温度为53℃时,扩增效率较高,条带最亮,且无非特异性条带。选择53℃为退火温度(图3)。
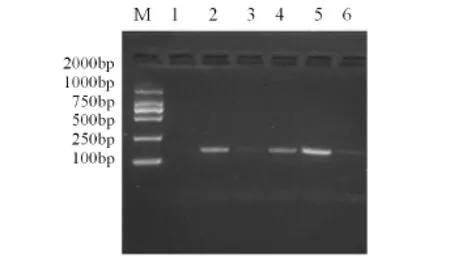
图3 Omp25c PCR退火温度优化结果
2.3实时荧光定量PCR的反应条件 采用25μL的反应体系:Premix Ex TaqTMI(2×)12.5µL;上游引物0.5µL;下游引物0.5µL;荧光探针溶液1µL;标准品DNA溶液2µL;双蒸馏水8.5µL。实时定量PCR反应参数为95℃30s,95℃20s,55℃20s,72℃20s,40个循环,在退火阶段检测荧光信号。
2.4重组质粒浓度测定 经计算获得,Omp25c重组质粒浓度为12.4µg/mL。
2.5实时荧光定量PCR的建立及标准曲线的绘制
2.5.1Omp25c的温度优化 根据3组探针浓度对应的Ct值分别为19.21、19.57、20.23以及对应曲线,Omp25c体系探针最佳退火温度为55℃(图4、5、6)
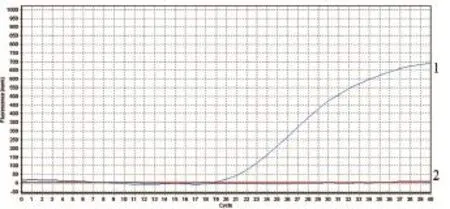
图4 Omp25c退火温度为53℃的扩增曲线
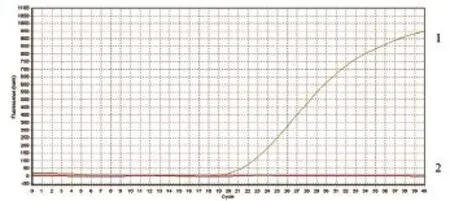
图5 Omp25c退火温度为55℃的扩增曲线
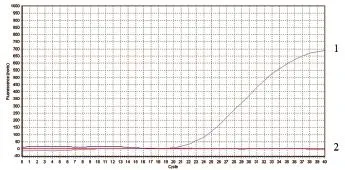
图6 Omp25c退火温度为57℃的扩增曲线
2.5.2Omp25c探针浓度的优化 据5组探针浓度对应的Ct值分别为18.79、19.38、19.71、19.91、20.01以及对应曲线,Omp25c体系探针最佳浓度为200nM(图7)。
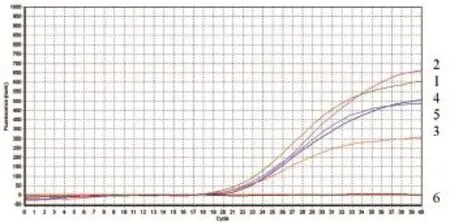
图7 Omp25c荧光PCR不同探针浓度的结果
2.5.3Omp25c引物浓度的优化 根据5组引物浓度对应的Ct值分别为9.95、11.47、1295、13.08、1351以及对应曲线,Omp25c体系探针引物最佳浓度为200nM(图8)
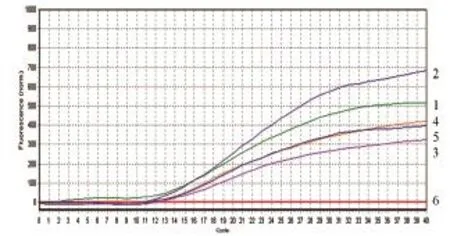
图8 Omp25c荧光PCR不同引物浓度的结果
2.5.4Omp25c标准曲线的建立 将得到的Omp25c作为标准品,采用实时荧光定量PCR方法,检测标准品的连续5个不同稀释度扩增的荧光信号,反应结束后获得动力学曲线(图9)以Ct值为纵坐标,标准品梯度稀释浓度的对数为横坐标。Omp25c获得标准曲线(图10)。Ct值分别为15.01、18.31、21.57、24.12、26.01,相关系数R2值为0.9943(R2>0.99),可见real-time PCR在稀释度范围内呈现良好的线性关系。

图9 Omp25c的标准曲线

图10 Omp25c的标准曲线
2.6 Omp25c特异性试验 根据实时荧光定量PCR的扩增曲线和Ct值,Ct值大于35为阴性样品,Ct值小于30为阳性样品,Ct值在30~35之间为可疑样品,可疑样品设三组重复组,若三组Ct值均大于30,即判定为阴性样品。重组质粒Ct值为21.68,根据Ct值判定重组质粒为阳性,而以Mycobacterium tuberculosis、BCG、BVDV为模板的Ct值均大于35,即为阴性样品。结果表明该体系对布鲁氏菌为特异性扩增(图11)。
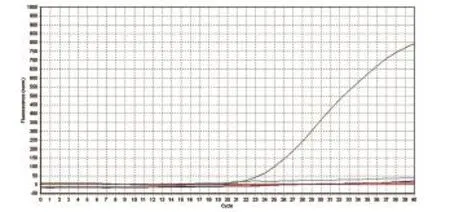
图11 Omp25c的特异性扩增曲线
2.7 Omp25c敏感性试验 取3.6µL Omp25c的模板DNA,拷贝数分别为107拷贝/µL 、106拷贝/ µL、105拷贝/µL、104拷贝/µL、103拷贝/µL、102拷贝/µL、101拷贝/µL 、进行实时荧光定量PCR反应,结果显示,最小检测拷贝数为36Copies/µL(图12)。

图12 Omp25c的敏感度扩增曲线
2.8Omp25c稳定性试验 将Omp25c标准阳性质粒为模板,重复做4管,Ct值分别为17.93、18.25、18.42、18.54、18.60,五组重复管中Ct值相对标准差小于15﹪,表明该方法重复性良好(图13)。
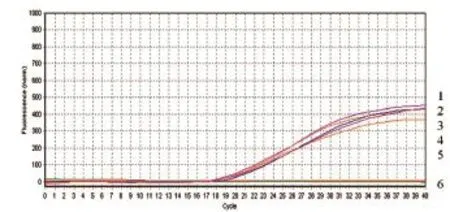
图13 Omp25c的重复性扩增曲线
2.9组织样品 的检测 分离东丰种公鹿场的10 份阳性病料和3份疑似阳性病料,利用本实验建立的方法进行检测,阳性及疑似阳性全部被检出为阳性(图14)。
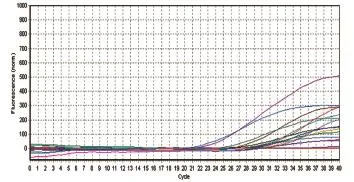
图14 Omp25c探针检测样本结果
3 讨论
本实验选取布鲁氏菌高度保守的外膜蛋白Omp25c,并应用primer5.0分析软件设计探针和引物,扩增片段长度为149bp,经过primer5.0分析没有发夹结构、二聚体等现象出现。本实验通过二步探针法,可以准确区分自然感染和人工免疫,最终进行定量分析。实验数据表明,设计的探针引物在本试验中具有较强的特异性、敏感性、稳定性和较好的扩增效率。
在应用制备的阳性质粒标准品建立标准曲线的过程中,首先将阳性质粒的吸光度确定在有效范围内:即OD260在0.2~0.8之间,OD260/OD280比值大于1.90,表明阳性质粒标准品的纯度较高,且其同源性与检测样品的同源性均为100%。其次,将引物、探针浓度以及退火温度等体系优化后,选取的阳性质粒标准品的稀释度为5个,采用Taqman实时荧光定量PCR方法,检测标准品的连续5个不同稀释度扩增的荧光信号,反应结束后获得动力学曲线,以Ct值为纵坐标,不同标准品梯度稀释浓度的对数为横坐标得到标准曲线,标准曲线方程为Y=-2.881X +32.628相关系数R2=0.9943大于0.99,可见Ct值与其对应标准品浓度对数值在稀释度范围内呈现良好的线性关系,从而可对检测样品进行定量的测定分析。
目前,国内外学者采用PCR方法检测布鲁氏菌所选取的靶基因很多,邱昌庆等[9]建立的套式PCR技术检测布鲁氏菌,徐军等[10]建立的巢式PCR检测乳中布鲁氏菌,但灵敏性都不及本实验。Gall D等[11]研究结果也表明荧光PCR方法检测布鲁氏菌要比普通PCR和血清学方法更灵敏、特异。本文所建立的实时荧光定量PCR检测方法可为特种经济动物鹿布鲁氏菌病的普查监测以及对鹿副产品的检验检疫,奠定一定的基础。
[1] Diaz-Aparicio E,Marin C,Alonso-Urmeneta B,et a1.Evaluation of serological tests for diagnosis of Brucella melitensis in-fection of goats[J].ClinMicrobiol,2004,32(5):1159-1165.
[2] 许邹亮,南文龙,周洁,等.布鲁氏菌环介导等温扩增(LAMP)可视化检测方法的建立[J].中国动物检疫,2011,28(8):37-40.
[3] 陈伟业,胡 森,黄克和,等.IS711 和omp2 作为布鲁氏菌种属及种株间分子鉴别诊断标记的研究[ J] .中国预防兽医学报,2006,28( 6):676-680.
[4] Cloeckaert A,Verger JM,Grayon M,et al.Restriction site polymorphism of the genes encoding the major 25 kDa and 36kDa outer-membrane proteins of Brucella [ J ] .Microbiology,1995,141( 9):2111-2121.
[5] 郑锦玲,蒋成砚,董仲生,等.布鲁氏菌病检测技术的研究进展[J].畜牧兽医科学,2002,22(6):25-28.
[6] Rajashekara G,Covert J,Petersen E,et al.Genomic island 2 of Brucella melitensis is a major virulence determinant :functional analyses of genomic is lands [ J ].J Bacteriol,2008,190(18):6243-6252.
[7] Wattam A R,Williams K P,Snyder E E,et al.Analysis of ten Brucella genomes reveals evidence for horizontal gene transfer despite a preferred intracellular life style[ J].J Bacteriol.2009,191( 11):3569-3579.
[8] Foster G,Osterm an B S,God froid J,et al.Brucella cetisp. nov. and Brucella pinnipedialis sp. Nov. for Brucella strains with cetaceans and seals as their preferred hosts [ J] .Int J Syst Evol Microbiol,2007,57( 11):2688-2693.
[9] Eskra L,Mathison A,Splitter G.Microarray analysis of mRNA levels from RAW264.7 macrophages infected with Brucella abortus[ J] .Infect Immun ,2003,71( 3):1125-1133.
[10] Halling S M ,Bricker B J. Characterization and occurrence of two repeated palindromic DNA element s of Brucella spp:Bru-RS 1 and Bru-RS2 [ J].Mol Microbiol ,1994 ,14(4):681-689.
[11] 张瑞华,黄志琴.浅谈奶牛布病检测体会[J].中国动物检疫,2005,22(2):30.
Establishment of a real-time fl uorescent quantitative PCR assay for Detection of Brucella of Deer
Hao Junwei1,Zhang Yun1,Yang Yuhang1,Liu Hongna1,Wang Wenyu1,Zhang Xiuli1,Shi Kun2,Li Jianming2,Du Rui2
(1.College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118;2. College of Traditional Chinese Medicinal Material, Jilin Agricultural University,Changchun 13011)
To aid in the development of a rapid assay to detect Brucella in deer,specif i c probe and primers was optimized based on the conservative Omp25c segment of Brucella and the reaction system was improved for selecting the best concentration of the primers and the probe. The amplif i ed gene was connected to PGEM-T vector,and the developed RTPCR assay was evaluated with regard to its specif i city,replicability and sensitivity via constructing standard samples and standard curve. The result showed that the detecting limit was 36 copies/µL and more sensitive than the general PCR.
deer,Brucella,realtime PCR
S852.614;S858.25
:A
:1005-944X(2014)02-0071-06
国家科技支撑计划(2011BAI03B02-1);吉林省科技创新人才培育计划(20130521023JH);吉林省科技成果转化促进计划(20125067)
杜锐

