土壤中两种手性有机氯农药的选择性降解研究
周小龙,于焕云,徐悦华,董军,李芳柏
土壤中两种手性有机氯农药的选择性降解研究
周小龙1,2,于焕云2*,徐悦华1*,董军3,李芳柏2
1. 华南农业大学理学院,广东 广州 510642;2. 广东省生态环境与土壤研究所,广东 广州 510650;3. 电子科技大学中山学院 广东 中山 528402
为了更深入的了解和阐释手性有机氯农药在土壤中的转化和环境归趋,采用实验室室内避光培养方法,研究了o,p'-DDT及o,p'-DDD 2种手性有机氯农药的外消旋体在水稻土厌氧培养体系和菜园土好氧培养体系中的选择性降解情况。为了更好的利用土壤中土著微生物的活性,我们选择了厌氧微生物比较丰富的水稻土和好氧微生物丰度比较高的菜园土来做培养实验。结果表明实验体系中o,p'-DDT及o,p'-DDD在水稻土和菜园土中的降解均没有明显的对映体选择性。这一结果与2种手性化合物不同对映体在自然环境中的含量普遍具有差异性有所不同,说明野外环境条件和室内模拟实验条件的差异会影响手性化合物的降解选择性。在2种体系中,o,p'-DDT的降解速率均高于o,p'-DDD的降解速率。这与以前的研究报道一致,DDD比DDT更难降解。通过2个体系的比较,发现DDT的降解速率在厌氧体系中高于好氧体系,而DDD的降解速率与之相反,好氧体系高于厌氧体系。这应该与DDT和DDD 2种化合物的化学结构及2种土壤中微生物群落的差异有关。对于厌氧体系中的2种水稻土,采自中山的水稻土中DDT的降解速率高于江门的水稻土,这应该与中山水稻土有机质含量高于江门的水稻土有关。有机质含量的高低直接反映了土壤中微生物的多少,进而会影响污染物的降解速率。研究发现本实验所用水稻土和菜园土总有机碳含量偏低可能是影响2种化合物的对映体无降解选择性的因素之一。此外,由于本研究采用缓冲溶液将pH调控在中性,因此本文的土壤pH对降解选择性的影响仍有待进一步研究。本研究中好氧体系和厌氧体系对目标物的降解选择性无明显差异。
滴滴涕;手性有机氯农药;厌氧培养;好氧培养;对映体选择性;有机质
本文选取2种典型的手性有机氯农药o,p'-DDT和o,p'-DDD为目标物,拟研究其在厌氧和好氧2种培养体系中不同对映体的选择性降解特征。选取本研究组以前的研究发现活性比较高、分别采自中山和江门的2种水稻土以及采自华南植物园的菜园土为室内培养实验的基质,分析外加的o,p'-DDT和o,p'-DDD在体系中随培养时间变化的降解情况,并探讨影响其选择性降解行为的可能因素。为进一步弄清手性化合物的归趋、转化机制和生态效应,更准确的评估其生态风险性和对人类健康的影响提供理论依据。
1 材料与方法
1.1仪器与试剂
气质联用仪(Thermo Fisher Trace DSQ),生化培养箱,真空冷冻干燥机,恒温水浴锅,旋转蒸发仪,循环水式真空泵,低温冷却水循环泵,氮吹仪。
o,p'-DDT(98.6%)、o,p'-DDD(100%)、PCB 67(99.0%)及PCB 82(100%)标准品均购于AccuStandard公司,正己烷(色谱纯)、二氯甲烷(色谱纯)、丙酮(色谱纯)均购于百灵威公司,无水硫酸钠(分析纯)购于广州化学试剂厂,使用前需在450 ℃的马弗炉中焙烧4 h,层析用氧化铝(分析纯)和硅胶(分析纯)均购于上海五四化学试剂有限公司。
1.2供试土样
实验中所用到的土壤样品均采自0~10 cm表层,共3个土壤样品。中山水稻土于2012年12月11日采自中山市沙溪镇沙坪村(22°29.954' N,113°20.710' E);江门水稻土于2012年12月11日采自江门市新会区三江镇五四村(22°26.872' N,113°05.544' E);菜园土于2013年3月5日采自华南植物园(23°10.764' N,113°21.679' E),其主要的理化性质如表1所示。

表1 采自中山市的水稻土(ZS)、江门市的水稻土(JM)以及华南植物园的菜园土(CY)的理化性质Table 1 Physical and chemical properties of soil samples
1.3实验方法
1.3.1 水稻土厌氧体系目标物降解实验
厌氧体系降解实验在50 mL的西林瓶中进行,称取土壤样品2 g(以干土计),加入20 mL pH=7.0的PIPES(哌嗪-1,4-二乙磺酸)缓冲液,充N230 min排净体系中的氧气,加入25 μL o,p'-DDT或o,p'-DDD(母液浓度为2 g·L-1,溶剂为丙酮),然后用橡胶塞压紧,并立即用铝盖密封。样品置于生化培养箱中(30±0.5) ℃避光静置培养,取样时间点为0 d、3 d、7 d、14 d、21 d,每个时间点有3个重复样。
1.3.2 菜园土好氧体系目标物降解实验
好氧体系降解实验在托盘中进行,取部分鲜土冷冻干燥,研磨后过100目筛,然后加入500 μL o,p'-DDT或o,p'-DDD(母液浓度为2 g·L-1,溶剂为丙酮),待丙酮挥发后混匀,然后再加入适量鲜土混匀后平铺在托盘上,土样总质量约40 g(以干土计),然后放入人工气候培养箱培养,培养温度30 ℃,湿度90%~95%,每隔7 d取3份2 g(以干土计)土样进行分析。
1.3.3 样品的前处理
对土壤样品进行冷冻干燥、研磨,转移至滤纸筒中,加入回收率指示物PCB 67,用200 mL正己烷和丙酮(V∶V=1∶1)索氏抽提24 h。提取液旋蒸约2 mL左右用中性氧化铝硅胶柱净化,淋洗剂为80 mL正己烷和二氯甲烷(V∶V=7∶3),淋洗液旋蒸浓缩,氮吹定容至1 mL,加入10 μL已知浓度的内标物PCB 82,然后进行GC-MS分析。
1.3.4 色谱条件
实验中o,p'-DDT,o,p'-DDD的手性分析采用手性色谱柱BGB-172(30 m×0.25 mm×0.25 μm; BGB Analytik, Switzerland)。色谱条件:柱温初始温度90 ℃,保持1 min,以20 ℃·min-1升至210 ℃,保持5 min,最后以5 ℃·min-1升至240 ℃,保持10 min;进样口250 ℃;高纯He流速1.3 mL·min-1,进样量为1 μL。对于手性特征的定量分析,一般通过计算手性化合物的对映体分数EF(enantiomer fraction)值来表征,EF值为右旋对映体的峰面积与2种对映体峰面积之和的比值EF=A+/(A++A-) (Harner等, 2000),EF=0.5时表示左旋与右旋对映体含量相等为外消旋体;EF大于0.5,右旋对映体的含量高于左旋对映体;EF小于0.5,左旋对映体含量高于右旋对映体。
实验中o,p'-DDT,o,p'-DDD的定量分析采用普通色谱柱DB-5MS(30 m×0.25 mm×0.25 μm; Agilent, USA),色谱条件:柱温初始温度50 ℃,保持1 min,以10 ℃·min-1升至260 ℃,最后以
50 ℃·min-1升至280 ℃,保持15 min;进样口250 ℃;高纯He流速1.3 mL·min-1,进样量为1 μL。o,p'-DDT、o,p'-DDD采用内标法定量,回收率指示物PCB 67的回收率范围为72.4%~112.5%。
质谱条件:电子轰击离子源(EI);电子能量70 eV;离子源温度250 ℃;传输线温度250 ℃;扫描范围(m/z)40~400;电子倍增器电压250 V;全扫描模式定性,选择离子模式定量。
2 结果与分析
2.1水稻土厌氧培养体系中o,p'-DDT降解实验
中山和江门水稻土样品中o,p'-DDT的浓度随时间的变化如图1所示,21 d后中山水稻土样品中的o,p'-DDT几乎全部降解,其降解率为99.4%,江门水稻土样品中o,p'-DDT大部分降解,其降解率为82.2%。按一级动力学模拟的降解反应速率常数k分别为2.7×10-1d-1和6.7×10-2d-1,半衰期T1/2分别为2.6 d和10.4 d,相关系数R2分别为0.84和0.85。与Kaushik(Kaushik, 1991)的研究结果(30 d降解了60%)相比,o,p'-DDT在本实验2种土壤中的降解速率是较高的。2种土壤中o,p'-DDT降解速率的差异可能与2个采样点土壤有机质的含量有关。有机质含量的高低直接反映了土壤中微生物的多少,进而影响微生物对农药的降解(洪青等, 2008; 黄宏等, 2008)。由表2可知,中山水稻土有机质的含量稍高于江门水稻土,且中山水稻土的含水率也高于江门水稻土,而土壤含水率对微生物的活性有重要影响(de Vries和Shade, 2013)。

图1 中山水稻土(ZS)和江门水稻土(JM)中o,p'-DDT降解动力学Fig. 1 Transformation kinetics of o,p'-DDT in paddy soil
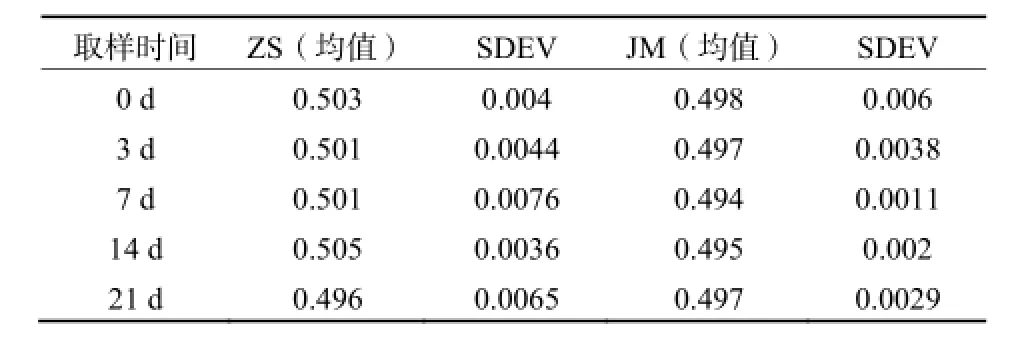
表2 中山水稻土(ZS)和江门水稻土(JM)中o,p'-DDT EF值的均值和标准偏差(SDEV)Table 2 EF value of o,p'-DDT in paddy soil collected from Zhongshan (ZS) and Jiangmen (JM)
中山水稻土和江门水稻土样品中o,p'-DDT的EF值随时间的变化如表2所示,经过21 d反应后,2种土样中o,p'-DDT的EF值均未明显变化,基本上维持在0.5左右,表明样品中o,p'-DDT未发生对映体选择性降解。
通过普通色谱柱分析,o,p'-DDT在2种土样中主要的降解产物是o,p'-DDD,生成的o,p'-DDD的浓度随时间的变化如图2所示。用手性色谱柱对生成的o,p'-DDD进行分析,样品中o,p'-DDD的EF值随时间的变化如表3所示,除0 d样品中不含有o,p'-DDD,o,p'-DDD在生成过程中EF值基本上维持在0.5左右,正好与上述o,p'-DDT的EF值结果一致;中山水稻土样品中的o,p'-DDD在7 d后发生了一定降解,降解过程中o,p'-DDD的EF值同样维持在0.5左右,表明o,p'-DDD对映体也未发生选择性降解。
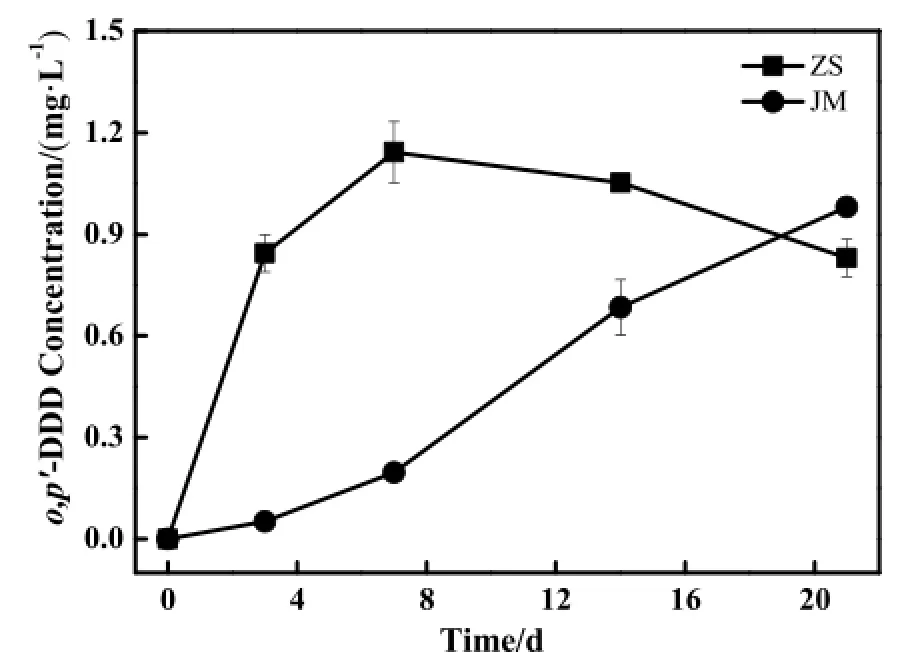
图2 中山水稻土(ZS)和江门水稻土(JM)中o,p'-DDD生成动力学Fig. 2 Formation kinetics of o,p'-DDD in paddy soil

表3 中山水稻土(ZS)和江门水稻土(JM)中o,p'-DDT降解产物o,p'-DDD EF值的均值和标准偏差(SDEV)Table 3 EF value of degradation product o,p'-DDD in paddy soil collected from Zhongshan (ZS) and Jiangmen (JM)
2.2水稻土厌氧培养体系中o,p'-DDD降解实验
中山和江门水稻土样品中o,p'-DDD的浓度随时间的变化如图3所示,o,p'-DDD在2种土样中均没有明显的降解趋势。很多的研究也表明DDD是DDT还原降解的主要产物,而DDD本身较难降解(Yu等, 2011; Cao等, 2012)。2种土壤中o,p'-DDD
的EF值随时间的变化如表4所示,2种土壤中o,p'-DDD的EF值等于0.5,表明o,p'-DDD的对映体在土壤中相对比较稳定。

图3 中山水稻土(ZS)和江门水稻土(JM)中o,p'-DDD降解动力学曲线Fig. 3 Transformation kinetics of o,p'-DDD in paddy soil
2.3 菜园土好氧培养体系中o,p'-DDT降解实验
采自华南植物园的菜园土中o,p'-DDT的浓度随时间的变化如图4所示,28 d后样品中o,p'-DDT的降解率为42.8%,一级动力学模拟的降解反应速率常数k为2.0×10-2d-1,半衰期T1/2为58.2 d,相关系数R2为0.94。与上述水稻土厌氧培养体系相比,结果表明菜园土好氧体系中o,p'-DDT的降解速率远小于水稻土厌氧体系中的降解速率。安琼等(安琼等, 2007)研究了DDT在旱地和淹水土壤中的降解,同样发现DDT在旱田土壤中降解比较缓慢。由表5可知o,p'-DDT的EF值随培养时间无明显变化。通过普通色谱柱分析能监测到少量的o,p'-DDD生成(图5)。由于生成的o,p'-DDD的浓度较低,通过手性色谱柱分离后对映体的响应较低,其EF值无法准确定量,故未在文中列出。

表4 中山水稻土(ZS)和江门水稻土(JM)中o,p'-DDD EF值的均值和标准偏差(SDEV)Table 4 EF value of o,p'-DDD in paddy soil collected from Zhongshan (ZS) and Jiangmen (JM)

图4 菜园土中o,p'-DDT降解动力学Fig. 4 Transformation kinetics of o,p'-DDT in vegetable garden soil

表5 华南植物园菜园土中o,p'-DDT及o,p'-DDD EF值的均值和标准偏差(SDEV)Table 5 EF value of o,p'-DDT and o,p'-DDD in vegetable garden soil collected from south china botanical garden

图5 菜园土中o,p'-DDD生成动力学Fig. 5 Formation kinetics of o,p'-DDD in vegetable garden soil

图6 菜园土中o,p'-DDD降解动力学Fig. 6 Transformation kinetics of o,p'-DDD in vegetable garden soil
2.4菜园土好氧培养体系中o,p'-DDD降解实验
华南植物园的菜园土中o,p'-DDD的浓度随时间的变化和EF值随时间的变化如图6、表5所示,28 d后样品中o,p'-DDD的降解率为14.1%,一级动
力学模拟的降解反应速率常数k为4.7×10-3d-1,半衰期T1/2为147 d,相关系数R2为0.86。尽管o,p'-DDD在菜园土中能够发生一定程度的降解,但相对o,p'-DDT的降解速率仍较慢。
3 讨论
通过本研究的结果发现,2种手性化合物o,p'-DDT和o,p'-DDD在厌氧和好氧培养体系中均未发生明显的对映体选择性降解现象。这一发现与我们最初的实验设想有些差异。虽然在自然环境条件下手性化合物对映体选择性降解是普遍存在的(Wiberg, 2002),但在室内实验条件下却不尽然。正如Kurt-Karakus等(Kurt-Karakus等, 2007)研究发现的,野外环境条件和室内实验条件下手性化合物的对映体降解选择性具有一定的差异性。目前认为手性化合物进入环境后,一些非生物过程,比如水解,光解、分配、浸出、挥发和沉降等都不会引起手性化合物的对映体选择性(Wiberg, 2002)。不过非生物过程-吸附是可以引起手性化合物的对映体选择性的(Hazen等, 2001)。另一方面手性化合物在环境中发生了生物化学过程后,对映体的组成一般会发生变化(Wiberg, 2002)。在自然环境条件下,微生物对农药降解起着非常重要的作用,共生或单一微生物对农药的降解作用都是在酶的参与下完成的(陈易辉, 2004)。通常来讲,酶对手性农药的降解主要存在以下几种可能性:一、可降解手性农药2种对映体的酶都存在,且对它们的转化速率一样;二、可降解手性农药2种对映体的酶都存在,但对他们的转化速率不一样;三、只存在一种可以优先降解某种对映体的酶;四、只存在一种可以优先降解某种对映体的酶,但同时也存在一种异构酶可将不被优先降解的那种对映体转化为另外一种微生物优先降解的对映体。
结合本实验的结果,o,p'-DDT和o,p'-DDD未发生选择性降解,可能的原因包括体系中存在的酶对2种对映体转化速率相同,或者存在异构酶把不被优先降解的那种对映体转化为另外一种可优先降解的对映体,然后2种对映体可同时被降解。此外,影响微生物活性的因素如pH、有机碳含量、营养元素、氧化还原条件、含水率及温度等都有可能会影响到手性化合物的降解选择性。Buerge等(Buerge等, 2003)研究发现甲霜灵(Metalaxyl)在好氧土壤pH大于5时,右旋对映体优先降解;当pH在4和5之间时,左旋和右旋对映体降解速率相同;当pH小于4时,左旋对映体优先降解。而对甲霜灵的一级降解产物甲霜灵羧酸(Metalaxyl carboxylic acid),pH与其降解选择性并没有相关性。此外,Li等(Li等, 2006)对珠三角流域土壤样品中有机氯农药的调查研究发现,o,p'-DDT的EF值与土壤样品的pH没有显著的相关性。这说明pH并不是影响所有手性化合物选择性降解的决定性因素。在本研究的过程中,体系pH是采用PIPES缓冲溶液控制在中性,因此pH是否是影响本研究目标物o,p'-DDT和o,p'-DDD降解选择性的因素之一仍有待做进一步的研究。Buerge等(Buerge等, 2003)还发现当在厌氧条件下进行甲霜灵的降解实验时,其在大部分试验土壤中的降解选择性与好氧条件下相反。这说明氧化还原条件对手性化合物的降解选择性也具有很大的影响。在本研究中,我们分别在菜园土好氧及水稻土厌氧2种体系中进行了实验,我们的实验结果表明好氧体系和厌氧体系对目标物o,p'-DDT和o,p'-DDD的降解选择性无明显差异。Koblizkova等研究发现高的有机碳含量,高的总氮含量可一定程度上促进手性有机氯农药的对映体选择性。在本研究中,中山和江门水稻土有机质含量分别为2.4%和2.3%,根据有机质和有机碳的关系(贾纪萍和丁宁, 2011),我们可以估算出中山和江门水稻土中有机碳的含量为1.4%和1.3%,约为Koblizkova等(Koblizkova等, 2008)测到的总有机碳含量(5.7%)的1/4,总氮含量本研究与Koblizkova等的结果相近,均在0.2~0.3%之间。这说明有机碳含量较低可能是本研究目标物o,p'-DDT和o,p'-DDD降解无选择性的一个影响因素。
4 结论
目标物o,p'-DDT及o,p'-DDD在上述水稻土和菜园土中的降解均没有明显的对映体选择性,表现在o,p'-DDT及o,p'-DDD在培养体系中的对映体分数EF值维持在0.5左右。研究发现o,p'-DDT在水稻土厌氧体系中比在菜园土好氧体系中更容易降解,o,p'-DDD在水稻土厌氧和菜园土好氧体系中均不易降解。土壤的理化性质中有机碳可能是影响目标物降解无选择性的因素之一,土壤pH对降解选择性的影响仍有待进一步研究。在本研究中厌氧体系和好氧体系对目标物降解选择性无明显差异。
BUERGE I J, POIGER T, MULLER M D, et al. 2003. Enantioselective degradation of metalaxyl in soils: Chiral preference changes with soil pH[J]. Environmental science & technology, 37(12): 2668-2674.
CAO F, LIU T X, WU C Y, et al. 2012. Enhanced biotransformation of DDTs by an iron- and humic-reducing bacteria aeromonas hydrophila HS01 upon addition of goethite and anthraquinone-2,6-disulphonic disodium salt (AQDS)[J]. Journal of Agricultural and Food Chemistry, 60(45): 11238-11244.
DE VRIES F T, SHADE A. 2013. Controls on soil microbial community stability under climate change[J]. Frontiers in Microbiology, 4: 1-16.
FALLER J, HUEHNERFUSS H, KOENIG W A, et al. 1991. Do marine bacteria degrade alpha-hexachlorocyclohexane stereoselectively?[J]. Environmental science & technology, 25(4): 676-678.
HARNER T, WIBERG K, NORSTROM R. 2000. Enantiomer fractions are preferred to enantiomer ratios for describing chiral signatures in environmental analysis[J]. Environmental science & technology, 34(1): 218-220.
HAZEN R M, FILLEY T R, GOODFRIEND G A. 2001. Selective adsorption of L- and D-amino acids on calcite: Implications for biochemical homochirality[J]. Proceedings of the National Academy of Sciences of the United States of America, 98(10): 5487-5490.
KAUSHIK C P. 1991. Persistence and metabolism of HCH and DDT in soil under subtropical conditions[J]. Soil Biology & Biochemistry, 23(2): 131-134.
KOBLIZKOVA M, DUSEK L, JARKOVSKY J, et al. 2008. Can physicochemical and microbial soil properties explain enantiomeric shifts of chiral organochlorines?[J]. Environmental Science and Technology, 42(16): 5978-5984.
KURT-KARAKUS P B, STROUD J L, BIDLEMAN T, et al. 2007. Enantioselective degradation of organochlorine pesticides in background soils: Variability in field and laboratory studies[J]. Environmental science & technology, 41(14): 4965-4971.
LI J, ZHANG G, QI S H, et al. 2006. Concentrations, enantiomeric compositions, and sources of HCH, DDT and chlordane in soils from the Pearl River Delta, South China[J]. Science of the Total Environment, 372(1): 215-224.
LIN T, HU Z H, ZHANG G, et al. 2009. Levels and mass burden of DDTs in sediments from fishing harbors: The importance of DDT-containing antifouling paint to the coastal environment of China[J]. Environmental science & technology, 43(21): 8033-8038.
MENG X Z, GUO Y, MAI B X, et al. 2009. Enantiomeric signatures of chiral organochlorine pesticides in consumer fish from South China[J]. Journal of Agricultural and Food Chemistry, 57(10): 4299-4304.
QIU X H, ZHU T, YAO B, et al. 2005. Contribution of dicofol to the current DDT pollution in China[J]. Environmental science & technology, 39(12): 4385-4390.
WANG C, LI Z Y, ZHANG Q, et al. 2013. Enantioselective induction of cytotoxicity by o,p '-DDD in PC12 cells: Implications of chirality in risk assessment of POPs metabolites[J]. Environmental science & technology, 47(8): 3909-3917.
WANG J, GUO L L, LI J, et al. 2007. Passive air sampling of DDT, chlordane and HCB in the Pearl River Delta, South China: Implications to regional sources[J]. Journal of Environmental Monitoring, 9(6): 582-588.
WIBERG K. 2002. Enantiospecific analysis and environmenta behavior of chiral persistent organic pollutants. http: //www. diva-portal. org/smash/get/diva2:144968/FULLTEXT01.pdf. (accessed September 2 2014).
YANG Y H, ZHOU S S, LI Y Y, et al. 2011. Residues and chiral signatures of organochlorine pesticides in sediments from Xiangshan Bay, East China Sea[J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 46(2): 105-111.
YU H Y, BAO L J, LIANG Y, et al. 2011. Field validation of anaerobic degradation pathways for dichlorodiphenyltrichloroethane (DDT) and 13 metabolites in marine sediment cores from China[J]. Environmental science & technology, 45(12): 5245-5252.
ZHANG A P, CHEN Z Y, AHRENS L, et al. 2012. Concentrations of DDTs and enantiomeric fractions of chiral DDTs in agricultural soils from Zhejiang province, China, and correlations with total organic carbon and pH[J]. Journal of Agricultural and Food Chemistry, 60(34): 8294-8301.
安琼, 董元华, 魏峰, 等. 2007. 旱地和淹水土壤中DDT的降解及DDMU和DDMS的形成趋势[J]. 环境科学, 28(12): 2794-2799.
陈易辉. 2004. 手性农药敌草胺和异丙甲草胺及其高效体金都尔的微生物降解研究. 硕士. 浙江工业大学, 杭州.
洪青, 蒋新, 李顺鹏. 2008. 微生物降解DDT研究进展[J]. 土壤, 40(3): 329-334.
黄宏, 肖乾芬, 王连生. 2008. 淮河沉积物中有机氯农药的残留与风险评价[J]. 环境科学研究, 21(1): 41-45.
贾纪萍, 丁宁. 2011. 泰州海陵区土壤有机质的测定[J]. 考试周刊, 67: 239-240.
李朝阳, 武彤, 李景印, 等. 2008. 手性农药对映体选择性环境行为的研究进展[J]. 生态环境, 17(3): 1268-1275.
魏峰, 董元华. 2011. DDT引发的争论与启示[J]. 土壤, 43(5): 698-702.
Enantioselective Degradation of Two Types of Chiral Organochlorine Pesticides in Soils
ZHOU Xiaolong1,2, YU Huanyun2*, XU Yuehua1*, DONG Jun3, LI Fangbai2
1. College of Science, South China Agricultural University, Guangzhou 510642, China; 2. Guangdong Institute of Eco-Environment and Soil Sciences, Guangzhou 510650, China 3. Zhongshan Institute, University of Electronic Science and Technology of China, Zhongshan, 528403, China
Our research examined the degradation of racemic mixture of o,p'-DDT and o,p'-DDD in paddy soil under anaerobic culture condition and in vegetable soil under aerobic culture condition, respectively with the objective of understanding and
Dichlorodiphenyltrichloroethane (DDT); chiral organochlorine pesticides; anaerobic culture; aerobic culture; enantioselectivity; organic matters
X131.3
A
1674-5906(2014)07-1210-07
国家自然科学基金项目(41201505);广东省自然科学基金(S2011010006107);863计划(2013AA06A209);省科技攻关项目(2011B030900004;2011B030900005)
周小龙(1989年生),男,硕士研究生,主要研究方向为持久性有机污染物的降解机制研究。E-mail:zhouxiaolong0716@163.com
*通讯联系人,yuyu0917@163.com;xuyuehua@scau.edu.cn
2014-03-28
周小龙,于焕云,徐悦华,董军,李芳柏. 土壤中两种手性有机氯农药的选择性降解研究[J]. 生态环境学报, 2014, 23(7): 1210-1216.
ZHOU Xiaolong, YU Huanyun, XU Yuehua, DONG Jun, LI Fangbai. Enantioselective Degradation of Two Types of Chiral Organochlorine Pesticides in Soils [J]. Ecology and Environmental Sciences, 2014, 23(7): 1210-1216.
有机氯农药滴滴涕(DDT)是一种典型的持久性有机污染物。从上世纪70年代初期开始,许多国家开始限制DDT的生产和使用,我国也于1983年起禁止大范围使用,但目前为止滴滴涕的使用在我国并未完全停止,在三氯杀螨醇、渔船防污漆及卫生防疫等3个方面仍在使用(Qiu等, 2005; Wang等, 2007; Lin等, 2009)。滴滴涕工业品中含有20%左右的o,p'-DDT(魏峰和董元华, 2011)。据研究,斯德哥尔摩公约中列入的十二种持久性有机污染物中有9种都是具有手性的(Wang等, 2013)。手性化合物其不同的对映体在生物活性、代谢及毒性等方面往往存在着显著差异(李朝阳等, 2008),但以往的研究很少将手性化合物的不同对映体区别看待。即使有部分针对手性化合物的研究也主要集中在自然环境条件下手性化合物不同对映体的监测方面(Li等, 2006; Meng等, 2009; Yang等, 2011; Zhang等, 2012)。其中α-六六六(α-HCH)是研究最早也是最多的一种手性有机氯农药。1991年,Faller等人(Faller等, 1991)测定了北海海水中α-HCH的对映体浓度比值且确认为非外消旋,从而首次证实了手性污染物在环境中的对映体选择性降解。虽然目前在野外条件下监测到的大部分手性化合物不同对映体的比值为非外消旋,但Kurt-Karakus等人(Kurt-Karakus等, 2007)研究发现手性化合物在野外环境条件下和室内模拟实验条件下的选择性降解具有差异性。比如他们研究发现同一土壤加入反式氯丹在野外条件下左旋与右旋对映体降解速率相近,而在室内实验中右旋对映体优先降解。这说明手性化合物的选择性降解受到多种因素的影响。目前的研究普遍认为手性化合物环境行为的差异性
主要由微生物引起的(李朝阳等, 2008)。也有研究发现土壤有机碳的含量、土壤质地、pH及氧气条件等都会影响手性化合物的选择性降解行为(Buerge等, 2003; Koblizkova等, 2008),但何种因素起决定性作用仍不清楚。因此手性化合物选择性降解行为的影响机制仍有待进一步研究。
elucidating the transformation and environmental fate of chiral organochlorine pesticides in soil. In order to biostimulate the activities of indigenous microbial communities in soil being capable of degrading o,p'-DDT or o,p'-DDD, paddy soil with high abundance of anaerobic microorganism and vegetable garden soil consisting of abundant aerobic microorganism were chosen as experimental matrices. Results showed that there is no significantly enantioselective degradation in anaerobic culture system or aerobic culture system for o,p'-DDT and o,p'-DDD. Enantiomeric shifts are very common in field environment, different with our results, indicating that the differences between laboratory experimental and natural conditions can result in the difference of enantioselective degradation of chiral compounds. In both anaerobic and aerobic systems, the degradation rates of o,p'-DDT are higher than those of o,p'-DDD, which is consistent with the previous report that DDD is more difficult to be degraded than DDT. Comparing the two culture systems, the degradation rate of o,p'-DDT in anaerobic system is higher than that in aerobic system, while contrary to DDT, the degradation rate of o,p'-DDD in aerobic system is higher than that in anaerobic system. This may be related to the difference between the chemical structure of DDT and DDD and the difference between the microbial communities in paddy soil and vegetable garden soil. For the two paddy soils in anaerobic system, the degradation rate of DDT in the paddy soil from Zhongshan (ZS) is higher than that in Jiangmen (JM). This may be attributable to the contents of organic matters in ZS soil is higher than that in JM soil. The content of organic matters can reflect the quantity of microorganism in soil directly and then affect the degradation rate of contaminant. Our results indicated that the lower contents of organic matters may be a factor affecting the non-enantioselective degradation of o,p'-DDT and o,p'-DDD in soils. In addition, pH in our study was controlled by 1,4-piperazinediethanesulfonic acid (PIPES) buffer solution, therefore the effect of soil pH on enantioselective degradation of o,p'-DDT and o,p'-DDD needs further study. No significant difference was found between the enantioselective degradation of o,p'-DDT and o,p'-DDD in anaerobic culture system and aerobic culture system.

