超声波法对燕麦β-葡聚糖提取及性质的影响
董兴叶,孙 楚,刘 瑶,吴 非,*
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.东北农业大学经济管理学院,黑龙江哈尔滨150030)
β-葡聚糖主要存在于谷物及酵母菌细胞壁中,大麦和燕麦含量最高。脱壳燕麦中(1-3)(1-4)-β-D-葡聚糖含量为3%~7%,因品种及生长环境不同而不同。β-葡聚糖具有降血脂、降血糖、抗氧化、抑菌、清肠道及增强免疫力等功能[1-2],而且在食品体系中可以起到增稠乳化等作用,广泛应用于色拉酱、冰激凌及无脂肪酸奶中[3]。
基于β-葡聚糖具有良好的生理功能及在食品体系中重要作用,提出一种提取β-葡聚糖省时节能的方法至关重要。国内外有运用微波法、超声波法、冻融法等方法提取燕麦麸皮中β葡聚糖的报道[4-5],但均未对新的提取方法对其性质是否有不利影响进行研究,且提取原料均集中在燕麦麸皮上。β-葡聚糖的持水性与乳化性、起泡性、黏度、生理功能性等都有必然关系,持油性作为衡量食品添加剂性能重要指标之一,因此检验持水性、持油性非常必要。
本论文对超声波法提取燕麦全粉中β-葡聚糖工艺进行初探,并对提取的产品与水提法得到的产品进行持水性与持油性的对比,旨在为超声波法提取β-葡聚糖的应用奠定理论基础[6]。
1 材料与方法
1.1 材料与仪器
燕麦 市售;大麦β-葡聚糖标准品 Sigma公司;无水乙醇、盐酸、碳酸钠等 均为分析纯。
R-1005型旋转蒸发器 北京瑞成伟业仪器设备有限公司;722S型分光光度计 上海菁华科技仪器有限公司;SC-3614型低速离心机 安徽中科中佳科学仪器有限公司;KQ-800GKDV型超声恒温数控超声波清洗器(40kHz) 昆山市超声仪器有限公司;PHS-25C型酸度计 上海大普仪器有限公司
1.2 实验方法
1.2.1 指标测定
1.2.1.1 燕麦β-葡聚糖得率的测定 采用刚果红标准曲线法[7]对β-葡聚糖浓度进行测定,燕麦β-葡聚糖得率的计算公式如下:
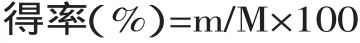
式中:m为粉末状成品中燕麦β-葡聚糖质量,g;M为提取质量为m的β葡聚糖所需的燕麦粉质量(干重),g。
1.2.1.2 燕麦β葡聚糖持水性及持油性的测定 燕麦β-葡聚糖持水性以吸水率为指标,测定按文献[8]中的方法,持油性以吸油率为指标,测定按文献[9]中的方法。
1.2.2 超声波对燕麦β-葡聚糖得率影响的单因素实验 影响超声波提取效果的因素很多,如超声的功率、时间、液料比、频率、温度、作用方式等都会产生一定的影响[10]。此外,提取效果还与提取对象密切相关[11]。根据预实验结果及前人相关实验结果(β-葡聚糖和多糖的提取影响因素)[12-14],选择液料比、超声波功率、超声波时间、提取温度和提取液pH为影响因素,研究不同水平下对燕麦β-葡聚糖得率的影响。
1.2.2.1 超声功率对燕麦β-葡聚糖得率影响 提取温度50℃,提取时间30m in,液料比20∶1,pH 9.0,研究超声功率480、560、640、720、800W时对β-葡聚糖得率的影响。
1.2.2.2 pH对燕麦β-葡聚糖得率影响 提取温度50℃,提取时间30m in,液料比20∶1,超声功率为上述优化出的结果,研究pH7、8、9、10、11、12时对β-葡聚糖得率的影响。
1.2.2.3 超声时间对燕麦β-葡聚糖得率影响 提取温度50℃,液料比20∶1,超声功率及pH为上述优化出的结果,研究超声时间15、25、35、45、55m in时β-葡聚糖得率的影响。
1.2.2.4 液料比对燕麦β-葡聚糖得率影响 提取温度50℃,超声功率、超声时间及pH为上述优化出的结果,研究不同液料比12∶1、16∶1、20∶1、24∶1、28∶1对燕麦β-葡聚糖得率的影响。
1.2.2.5 提取温度对燕麦β-葡聚糖得率影响 超声功率、液料比、超声时间及pH为上述优化出的结果,研究不同温度30、40、50、60、70℃对燕麦β-葡聚糖得率的影响。
1.2.3 超声波对燕麦β-葡聚糖得率影响的正交实验
在单因素实验的基础上,选择三个影响较大的因素并各取3个水平,以β-葡聚糖得率为实验指标,进行L9(34)正交实验,实验因素与水平编码见表1。
1.2.4 燕麦β-葡聚糖的制备 燕麦的预处理:燕麦粉经80%乙醇回流3h后,干燥备用。
1.2.4.1 超声波法 按照优化出的实验条件,在超声波清洗器中提取燕麦粉中的β-葡聚糖。提取液按如下方法处理得到β-葡聚糖产品:提取液离心(3500r/min, 20min)分离得到上清液1和残渣,残渣二次提取,得到提取液2,合并提取液1和2,上清液经去淀粉、去蛋白质,活性炭脱色后,醇沉得到沉淀。沉淀加水复溶,离心去除不溶物后,上清液中加入硫酸铵,并使其最终浓度达到20%,沉淀出的燕麦β-葡聚糖再次溶解于蒸馏水中,透析袋透析,截留液真空浓缩后冷冻干燥得到粉末状成品。
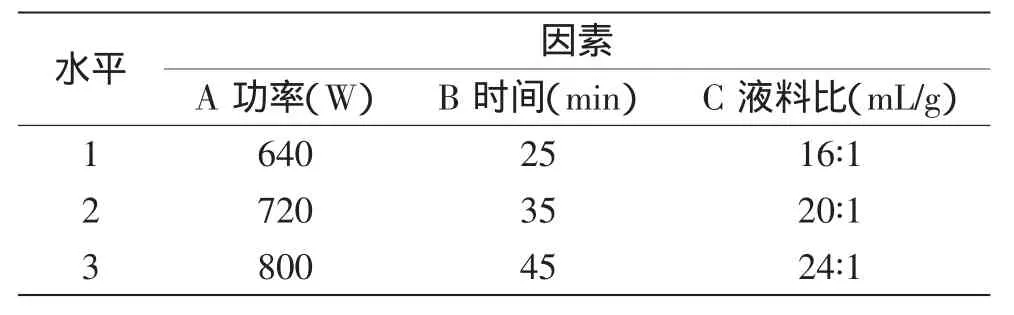
表1 超声波提取的实验因素与水平编码表Table1 Factors and levels of orthogonal experimenton ultrasonic extraction
1.2.4.2 水提法 按照本实验室前期实验确定的水提法提取β-葡聚糖的最优工艺条件(提取温度80℃,时间3h,pH 11,提取次数2次,液料比25∶1),在水浴锅中提取燕麦粉中的β-葡聚糖,提取液按超声波方法处理得到粉末状成品。
1.3 统计分析
所有实验均平行3次,采用Excel 2003对单因素条件进行分析,采用SPSS 18.0进行正交分析。
2 结果与分析
2.1 刚果红法测定β-葡聚糖含量的标准曲线
以β-葡聚糖质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,结果见图1。
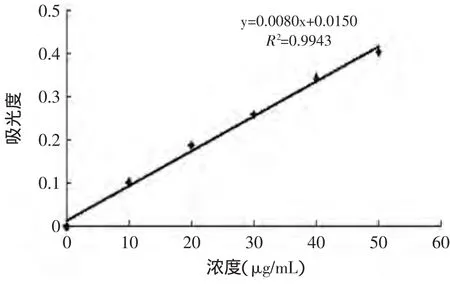
图1 刚果红法测定β-葡聚糖含量的标准曲线Fig.1 The standard curve of determination of the β-glucan contentby congo red method
2.2 超声波对燕麦β-葡聚糖得率影响的单因素实验
2.2.1 超声功率对燕麦β-葡聚糖得率的影响 由图2可知,随着超声功率的增大,β-葡聚糖的得率也随之增大。这是由于功率增大时提取液循环加速,β-葡聚糖溶解与扩散速度增加,提取液与物料的接触机会也会增多,同时超声功率增大时空化作用能有效地破坏物料的细胞壁,使β-葡聚糖得率增加[11,15]。但超声功率超过720W时,得率有所下降。这是由于功率过大时空化气泡没有足够的时间爆破,超声空化作用减弱[11],也有可能是大功率时物理剪切作用大致使糖苷键被打断[12],β-葡聚糖结构被破坏使得率下降。因此,超声波法提取时功率选取720W为宜。
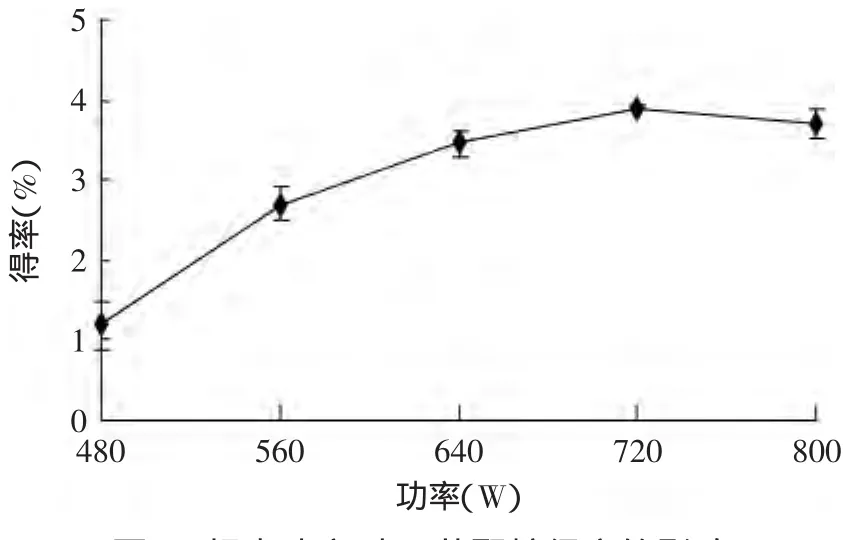
图2 超声功率对β-葡聚糖得率的影响Fig.2 Effectof the ultrasonic power on oatβ-glucan yield
2.2.2 提取液的pH对燕麦β-葡聚糖得率的影响 由图3可知,随着提取液pH升高,β-葡聚糖的得率随之增加。这是由于β-葡聚糖本身具有碱溶性,碱性较强时有利于其从细胞中溶出,使得提取率增加,可见弱碱性的条件有利于β-葡聚糖的提取。但当提取液的pH超过10时,得率反而下降,这是由于β-葡聚糖在强碱性条件下发生糖苷键的断裂,其他的杂质也被提取出来使得溶液变成糊状,游离水数量变少,从而使β-葡聚糖溶出受阻[13]。另外,pH升高时提取液颜色逐渐加深,可能是体系中发生了美拉德反应。因此,本实验选择提取的pH为10。

图3 提取液pH对β-葡聚糖得率的影响Fig.3 Effect of the pH on oatβ-glucan yield
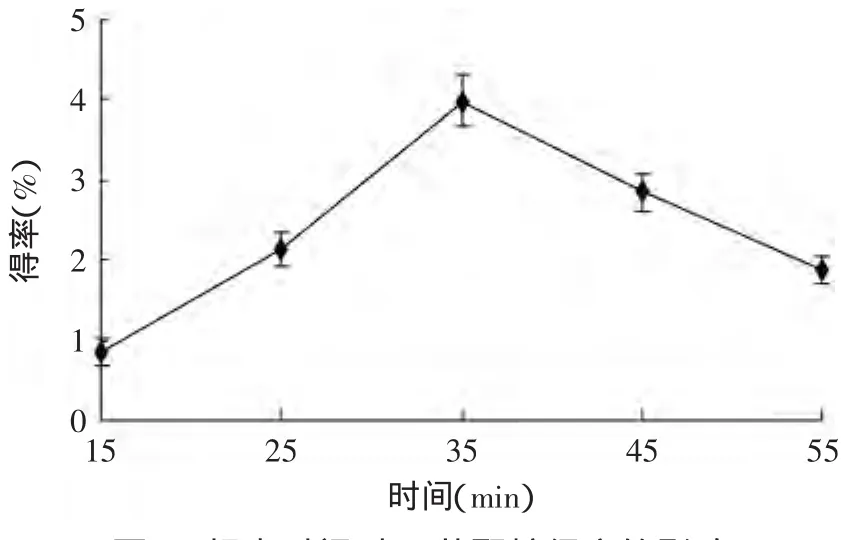
图4 超声时间对β-葡聚糖得率的影响Fig.4 Effect of the ultrasonic time on oatβ-glucan yield
2.2.3 超声时间对燕麦β-葡聚糖得率的影响 由图4可知,随着超声时间的增加,β-葡聚糖的得率随之增加。这是由于破坏所有原料的细胞壁及β-葡聚糖与提取液达到扩散平衡需要一定的时间,在一定限度内,随时间的增加得率会增加。但当超声时间超过35m in时,得率反而下降。这可能是由于超声作用时间过长时,局部温度积累过高使β-葡聚糖发生降解[11],杂质相应的也被提取出来导致β-葡聚糖的溶出受到一定程度的影响[14],还有可能是超声作用过程中,β-葡聚糖先析出后被重新吸附导致β-葡聚糖得率下降[11]。因此,本实验超声时间选取35min。
2.2.4 液料比对燕麦β-葡聚糖得率的影响 由图5可知,随液料比的增加,β-葡聚糖的得率随之增加。这是由于液料比越大,燕麦细胞内外溶质的浓度差越大,这样传质的推动力也相应的增大,有利于β-葡聚糖的浸出。但液料比超过20∶1时,得率不但没有增加反而略微下降的趋势。可能是传质推动力的加大,杂质浸出量也相应增加,在醇沉过程中,杂质包埋了一部分β-葡聚糖使得β-葡聚糖没有被沉淀出来,致使得率下降。因此,本实验液料比选取20∶1。
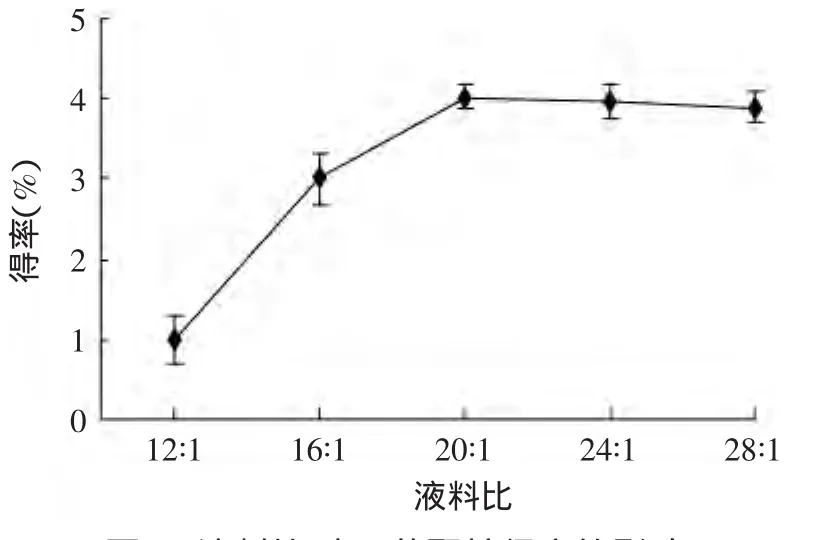
图5 液料比对β-葡聚糖得率的影响Fig.5 Effectof the ratio ofwater tomaterial on oatβ-glucan yield
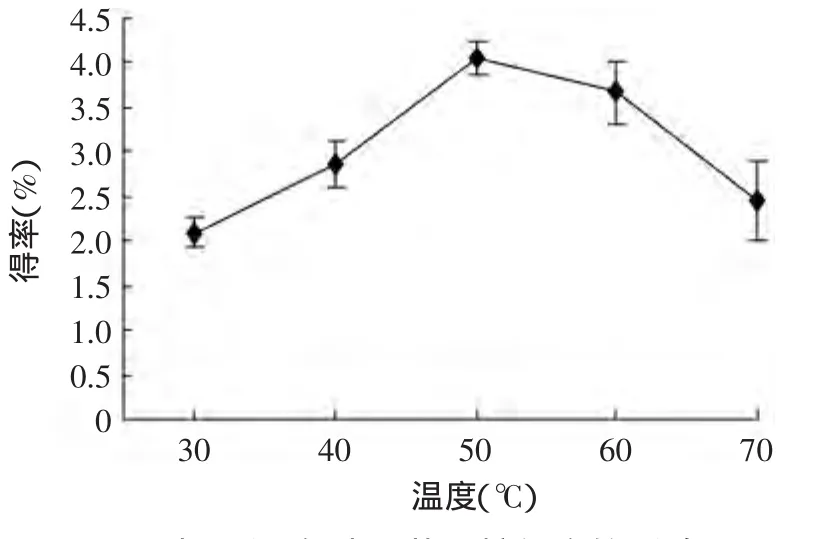
图6 提取温度对β-葡聚糖得率的影响Fig.6 Effect of the extraction temperature on oatβ-glucan yield
2.2.5 提取温度对燕麦β-葡聚糖得率的影响 由图6可知,随提取温度的增加,β-葡聚糖的得率随之增加。这是由于温度升高时溶质分子与溶剂分子运动速率加大,同时也促进了溶质的扩散作用,从而有利于提高β-葡聚糖得率。但提取温度超过50℃时,得率反而下降。这是由于温度过高时可能引起β-葡聚糖的降解[16-18],进而活性会降低,更重要的会引起淀粉的糊化,体系黏度升高,不利于β-葡聚糖的浸出,糊化的淀粉还会包埋一些β葡聚糖[19]。因此,本实验提取温度选取50℃。
2.3 超声波对燕麦β-葡聚糖得率影响的正交实验
由单因素实验结果可知,pH、提取温度对燕麦β-葡聚糖的得率影响较小,因此选择液料比、超声功率和超声时间三个对燕麦β-葡聚糖的得率影响较大的因素进行正交实验,结果见表2。
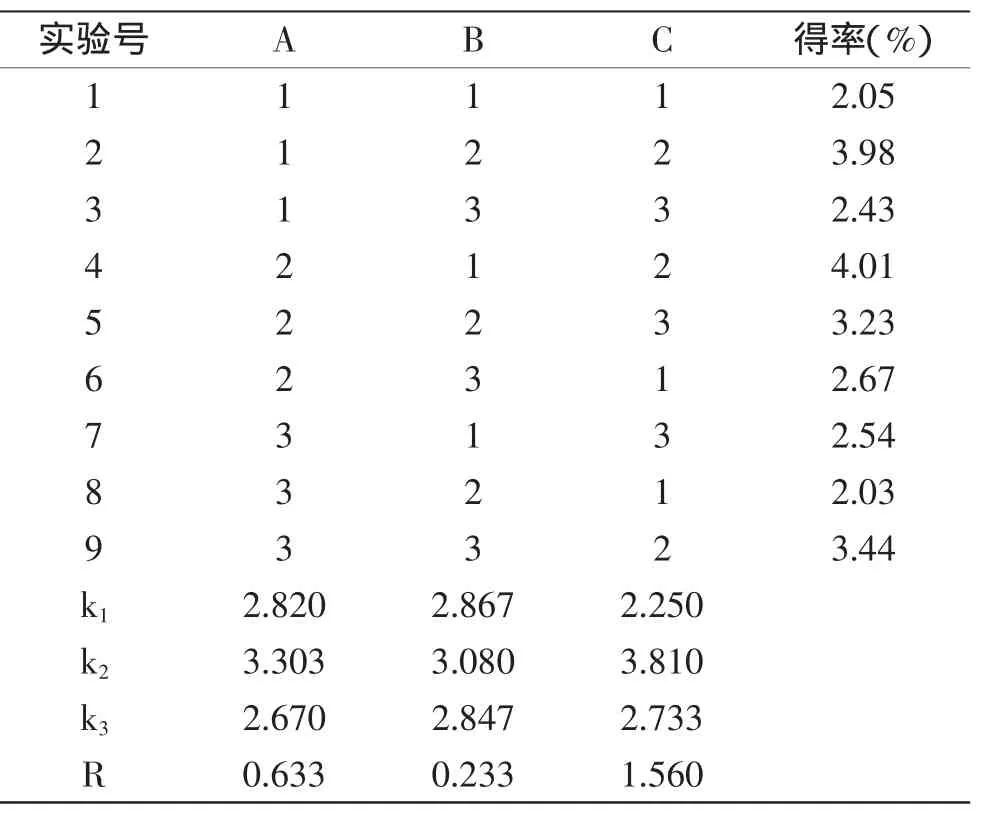
表2 超声波提取正交实验结果Table2 Results of orthogonal experimenton ultrasonic extraction
由表2实验结果得知,各提取因素对β-葡聚糖得率影响的顺序为液料比>超声功率>超声时间。提取燕麦β-葡聚糖的最优方案为A2B2C2,即超声功率720W,超声时间35m in,液料比20∶1,由于该组合不在实验计划内,因此,在最优条件下进行三次平行验证性实验,平均得率高达4.09%。而常规水提法得率仅为3.05%。
2.4 超声波法与水提法得到的β-葡聚糖性质比较
利用超声波法及水提法提取燕麦β-葡聚糖,由于提取方法不同,提取出产品的性质不尽相同,表3为产品性质比较。

表3 超声波法与水提法提取的β-葡聚糖性质比较Table3 Comparison of the properties ofβ-glucan between by watermethod extraction and by ultrasonic treatmentextraction
由表3可知,超声波法提取的β-葡聚糖吸水率及吸油率较水提法略高。推测是由于超声处理影响了多糖的网状结构,更容易吸附贮存水分子及油分子,这一结论需要进一步扫描电镜图实验验证。这种推测的依据是超声法提取的玉竹多糖较水题法得到的持水力和持油力高,通过扫描电镜观察发现超声法得到的多糖形成空隙更大,这种结构更容易吸附贮存水分子及油分子[20]。物化结构及性质影响多糖的持水力及持油力[21],还有可能是超声波法所需的时间短且提取液的pH较水提法低,降低了多糖分子在提取过程中的损伤[14,22],分子量较大,较易与油水分子紧密结合[23]。超声波法提取的β-葡聚糖的吸水率及吸油率较水提法略高的原因还需通过相应的实验得以确证。
3 结论
超声波提取燕麦β-葡聚糖的最优工艺条件为:液料比20∶1,超声功率720W,超声时间35m in,温度50℃,pH10,在最优工艺条件下β-葡聚糖得率为4.09%。水提法的最优工艺条件为:提取温度80℃,时间3h,pH11,提取次数2次,液料比25∶1,在最优工艺条件下β-葡聚糖得率为3.05%(本实验室测得)。因此,超声波法是一种提取率高、省时节能且对产品持水性和持油性不产生不利影响的提取方法。
[1]李进.燕麦的营养价值与保健功效[J].新疆农业科技,1993(5):38-39.
[2]马晓凤,陕方,刘森,等.膨化燕麦麸对大鼠血脂水平的影响及营养品质研究[J].营养学报,1999,21(2):196-199.
[3]刘永,周家华,曹颢.碳水化合物型脂肪替代品的研究进展[J].食品科技,2002(2):40-43.
[4]Damshkain L G,Simenel I A,Lozinsky V I.Study of cryostructuration of polymer systems.XV.Freeze-thaw induced formation of cryoprecipitatematter form low-concentrated aqueous solutions of poly(vinyl alcohol)[J].Journal of Applied Polymer Science,1999,74(8):1978-1986.
[5]Giannouli P,Morris E R.Cryogelation of xanthan[J].Food Hydrocolloid,2003,17(4):495-501.
[6]李小平.燕麦β-葡聚糖的提取纯化及功能特性研究进展[J].麦类作物学报,2010,3(6):1180-1183.
[7]张娟,杜先锋,饶砚琴.刚果红法测定燕麦中β-葡聚糖含量的研究[J].安徽农业大学学报,2007(1):23-26.
[8]王言.玉米皮膳食纤维的制备、功能活化及活性研究[D].长春:吉林大学,2010.
[9]Lin M J Y,Humbert ES.enain functional properties of sunflower meal products[J].Journal of Food Science,1974,39:368-370.
[10]杨景峰,罗志刚,罗发兴.物理波在真菌多糖提取中的应用[J].粮油食品科技.2007,15(5):55-58.
[11]胡爱军,郑捷.食品工业中的超声提取技术[J].食品与机械,2004,20(4):57-60.
[12]查宝萍,王莉,陈正行.超声波辅助提取燕麦麸中多糖的方法研究[J].粮食与饲料工业,2010(8):28-30.
[13]翟爱华,张莉姝,王东.777超声辅助提取燕麦麸皮中β-葡聚糖的工艺研究[J].黑龙江八一农垦大学学报,2008,20(5):61-64.
[14]马国刚,王建中.超声波辅助提取青稞β-葡聚糖的工艺条件优化[J].食品科技,2009(11):168-174.
[15]康田田,董海洲,侯汉学,等.响应面法优化紫麦麸中水溶性β-葡聚糖提取工艺研究[J].中国食物与营养,2013,19(1):40-45.
[16]孟宪军,李冬男,汪艳群,等.五味子多糖超声波提取条件的研究[J].食品工业科技,2010,31(4):313-315.
[17]李桂娟,李冲,姜雪,等.松籽壳多糖超声辅助溶剂法提取及抗氧化性研究[J].食品与机械,2012,28(6):133-137.
[18]钟秋平,林美芳,戴梓茹,等.超声波辅助提取扁藻多糖工艺的优化[J].南方农业学报ISTIC,2013,44(10):1714-1717.
[19]赖小玲,郑秀玲,郑浩文,等.超声波提取茶薪菇β-葡聚糖的工艺[J].食品与发酵工业,2007,33(6):145-148.
[20]蓝高爽.玉竹多糖的理化性质及其活性研究[D].天津:天津大学,2012.
[21]高宇萍,韩育梅,李周永,等.超声波处理对水不溶性膳食纤维膨胀力及持水力的影响[J].食品工业科技,2012,33(16):299-301.
[22]涂宗财,寇玉,王辉,等.荷叶多糖的超声波辅助提取和抗氧化活性[J].食品科学,2013,34(16):108-112.
[23]宫艳艳,徐学明.不同提取方法对酵母葡聚糖性质的影响[J].食品工业科技,2008,29(9):162-165.

