竹叶黄酮与谷胱甘肽对食源性非酶糖基化的抑制
孙 涛,张亦鸣,谢 晶,薛 斌
(上海海洋大学食品学院,上海水产品加工储藏工程研究中心,上海201306)
非酶糖基化反应(NEG)又称美拉德反应,是氨基化合物蛋白质、氨基酸与羰基化合物还原糖之间发生的一系列非酶促反应,它会使蛋白质发生交联而失去活性,生成不可逆的非酶糖基化末端产物(AGEs)[1]。NEG可改变蛋白质结构和功能影响脂质代谢、修饰核酸及胞内蛋白以及诱导氧化应激等,AGEs最终会导致动脉粥样硬化、白内障、糖尿病肾病及其并发症[2]。生物体自身新陈代谢会产生AGEs,而通过食物摄入是体内积累AGEs的另一个重要来源[3]。通过抑制食品中的美拉德反应来减少AGEs摄入和积累,对其引发的相关疾病的研究提供新思路。
某些抗氧化剂能明显抑制蛋白质糖基化[4]。黄酮在生理条件下对蛋白质非酶糖基化有抑制作用[5]。谷胱甘肽可减少肾组织糖基化终产物的生成,对糖尿病大鼠的肾脏具有保护作用[6],并抑制生理条件下糖基化产物的生成[7]。生理条件下抑制非酶糖基化而减少AGEs的积累是目前的一个研究热点,而对食源性非酶糖基化抑制的研究较为罕见。
本文通过对果糖胺、二羰基化合物、小分子醛类物质、荧光性终产物以及5-羟甲基糠醛(5-HMF)等不同阶段糖基化产物的检测,考察了竹叶黄酮与谷胱甘肽对食源性非酶糖基化的抑制作用,以期为抑制食源性非酶糖基化的研究提供一定参考。
1 材料与方法
1.1 材料与仪器
30%竹叶黄酮 食品级,购自东莞金色盆地生物科技有限公司;98%谷胱甘肽 生物试剂,购自上海如吉生物科技发展有限公司;氨基胍盐酸盐(aminoguanidine,AG)、5-羟甲基糠醛(5-HMF) 购自梯希爱(上海)化成工业有限公司;D-果糖(BR)、L-谷氨酸(BR)、磷酸二氢钠(AR)、无水碳酸钠(GR)、碳酸氢钠(AR)、甲酸(AR)、甲酸钠(AR)、Girard-T(吉拉尔特试剂,CP)、氯化硝基四氮唑蓝(NBT,BR)等 均购自于国药集团化学试剂有限公司。
DELTA-320-S型pH计 梅特勒-托利多仪器上海有限公司;WFZ UV 2000型紫外分光光度计 上海合利仪器有限公司;RF-530型PC荧光分光光度计日本岛津公司;WatersTMAlliance 2695-2489型高效液相色谱仪 美国Waters公司。
1.2 实验方法
1.2.1 食源性非酶糖基化体系的建立 0.04mol/L果糖与0.2mol/L谷氨酸溶于0.2mol/L pH=5.50的磷酸缓冲溶液中,置于沸水浴中回流加热作为食源性非酶糖基化体系[8],竹叶黄酮(0.01、0.1、1.0g/L)和谷胱甘肽(0.01、0.1、1.0g/L)分别为抑制剂,有糖基化反应物,添加抑制剂的糖基化抑制组;只有糖基化反应物,不添加抑制剂的糖基化反应组;以及用磷酸盐缓冲溶液代替糖基化体系且添加各浓度抑制剂的空白反应组。同时,以1.0g/L氨基胍作为阳性对照。将上述糖基化反应体系于6、9、12h取样,迅速冰水冷却后,分别检测其中的果糖胺、二羰基化合物、小分子醛类物质、荧光产物以及5-HMF的含量,并计算抑制率。
1.2.2 NBT还原检测果糖胺 将0.6m L糖基化产物和6.0m L 0.6mmol/L NBT置于0.1mol/L Na2CO3-NaHCO3缓冲溶液(pH=10.35)中,于37℃水浴20m in[9]。用紫外-可见分光光度计于530nm处检测吸光度。按下式计算糖基化反应中对果糖胺的抑制率:
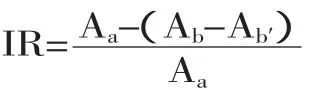
其中:Aa:不添加抑制剂糖基化反应组的吸光度;Ab:添加糖基化反应物,且添加抑制剂的糖基化抑制组的吸光度Ab′:不添加糖基化反应物,只添加抑制剂的空白反应组的吸光度。
1.2.3 Girard-T法检测二羰基化合物 将0.5m L糖基化物质和0.5m L 0.5mol/L Girard-T试剂置于7.0m L HCOOH-HCOONa缓冲溶液(pH=2.90)中,于30℃水浴中温浴10m in[9]。用紫外-可见分光光度计于295nm处检测吸光度。抑制率计算公式参照1.2.2。
1.2.4 紫外A295检测小分子醛类 取糖基化物质0.4m L,稀释至10.0m L,用紫外-可见分光光度计于295nm处检测吸光度[10]。抑制率计算公式参照1.2.2。1.2.5 荧光检测终期蛋白质交联物质AGEs 取糖基化物质10.0m L,于激发波长Ex=370nm和发射波长Em=440nm处,检测其荧光强度[9]。
1.2.6 HPLC检测5-HMF 色谱条件[11]:色谱柱:WatersTMAtlantis C18分析柱(250×4.6mm,5μm);流动相:超纯水∶甲醇(90∶10);流速:1.0m L/m in;检测波长:284nm;柱温:25℃;进样量:10μL。5-HMF标准品用甲醇溶解,稀释至40μg/m L,按上述方法过柱分离,作为定性依据。取t=6、9、12h的反应液,过滤去除细微不溶性杂质,进行液相分析,检测5-HMF。
1.2.7 数据统计 所有实验重复三次,最终数据为三次实验数据的算术平均值。两组间比较采用t检验(p<0.05)。
2 结果与讨论
2.1 竹叶黄酮与谷胱甘肽对果糖胺的抑制
糖基化早期,果糖与谷氨酸的游离氨基发生反应,生成西弗碱,然后经过环化、异构化重排生成Amadori产物。Amadori产物之一的果糖胺是一种具有酮胺结构的物质,在碱性条件下能还原NBT,形成蓝紫色甲臜类化合物[12],在530nm处有最大吸收峰[13]。所以检测糖基化反应物与NBT反应后在可见光区域的吸光度可以判断果糖胺的含量。表1为竹叶黄酮和谷胱甘肽对果糖胺的抑制效果。由此可知,竹叶黄酮对非酶糖基化初期生成的果糖胺有抑制作用,与生理条件下的糖基化研究结果相似[14],且其抑制率基本随抑制剂浓度增加而增加,1.0g/L竹叶黄酮反应6h抑制效果最明显,为52.13%。而谷胱甘肽对果糖胺的生成有促进作用,浓度越大促进效果越明显。
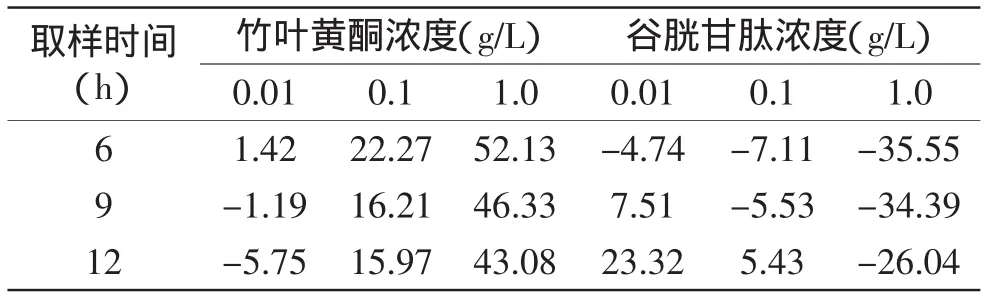
表1 竹叶黄酮与谷胱甘肽对果糖胺的抑制(%)Table1 Inhibition effect of bamboo-leaf-flavonoids and glutathione on Fructosamine(%)
2.2 竹叶黄酮与谷胱甘肽对二羰基化合物的抑制
Amadori产物通过氧化、水解反应降解成乙二醛、甲基乙二醛和脱氧葡萄糖醛酮等二羰基化合物。这些化合物比葡萄糖更容易与游离的氨基发生反应,形成糖基化终产物。据报道40%~50%的糖基化终产物来源于二羰基化合物[15],Girard-T试剂在温和的酸或碱性条件下可与含有二羰基基团的醛或酮反应,生成的加成化合物在紫外光下有较强吸收[10]。所以检测糖基化反应物与Girard-T反应后紫外区的吸光度可以判断二羰基化合物的含量。竹叶黄酮和谷胱甘肽对二羰基化合物的抑制情况见表2,可知两者对二羰基化合物均有抑制作用,且抑制率都随抑制剂浓度增加而增加。但两组相比较而言,相同浓度下谷胱甘肽的抑制率比竹叶黄酮高。1.0g/L谷胱甘肽作为抑制剂,其12h抑制率可达到近90%,略低于1.0g/L氨基胍。

表2 竹叶黄酮与谷胱甘肽对二羰基化合物的抑制(%)Table2 Inhibition effect of bamboo-leaf-flavonoids and glutathione on dicarbonyl compound(%)
2.3 竹叶黄酮与谷胱甘肽对小分子醛类的抑制
糖基化中期,会生成无色小分子中间体,如:Amadori重排产物裂解的丙酮醛、丁二酮、丙酮醇等,以及它们在Strecker降解后小分子醛类,它们在295nm处有紫外吸收。紫外吸收值越高,糖基化反应就越充分,由此可衡量糖基化反应的进程。竹叶黄酮与谷胱甘肽对小分子醛的抑制见表3,谷胱甘肽在这一阶段对糖基化反应有明显抑制作用,其抑制率随浓度的增加而增加,0.01g/L与0.1g/L谷胱甘肽,其抑制率随时间延长而增加,1.0g/L谷胱甘肽,其抑制率基本不随时间变化。0.1g/L与1.0g/L谷胱甘肽对小分子醛类物质的抑制率远高于1.0g/L氨基胍。而竹叶黄酮对小分子醛类物质的生成有促进作用,其促进率随时间延长而降低,随浓度增大而升高。
2.4 竹叶黄酮与谷胱甘肽对晚期AGEs的抑制
二羰基化合物继续与游离的氨基作用,通过氧化、水解和环化反应形成不可逆的荧光性终产物(AGEs)[15]。图1为竹叶黄酮与谷胱甘肽对荧光性终产物AGEs的影响,可知竹叶黄酮在这一阶段对AGEs荧光强度有明显的猝灭效果,1.0g/L竹叶黄酮,三个时间段内的猝灭效果均优于1.0g/L氨基胍。反应12h,几乎可完全猝灭,与生理条件下研究结果一致[5]。而谷胱甘肽对AGEs有部分促进作用,促进效果随抑制剂的浓度增加而增加,随反应时间的延长而降低,0.01g/L与0.1g/L谷胱甘肽在反应的9~12h逐渐抑制晚期AGEs,抑制效果随浓度升高而降低,随反应时间延长而升高。

图1 竹叶黄酮与谷胱甘肽对晚期AGEs的影响Fig.1 The influence effectof bamboo-leaf-flavonoids and glutathione on AGEs
2.5 竹叶黄酮与谷胱甘肽对5-HMF的抑制
目前,在酸催化条件下六碳糖脱水生成HMF的反应机理并不十分清楚。一般认为六碳糖在酸催化过程中第一步会生成烯醇互变结构体这样的中间产物,再进一步脱水生成HMF,反应过程主要经历异构化、双键断裂和脱水这3个步骤(在以葡萄糖为反应物时)[16]。
图2为竹叶黄酮与谷胱甘肽对5-HMF的影响,可知谷胱甘肽对5-HMF有明显的抑制作用,且抑制效果随谷胱甘肽浓度的增加而增加;1.0g/L谷胱甘肽作为抑制剂,在三个时间段内5-HMF的生成量几乎不变。竹叶黄酮对5-HMF的生成有微弱的促进作用。1g/L氨基胍作为抑制剂,HPLC没有检测出5-HMF,说明氨基胍几乎可以完全抑制5-HMF的生成。
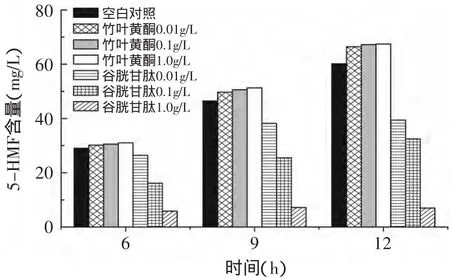
图2 竹叶黄酮与谷胱甘肽对5-HMF的影响Fig.2 The influence effectof bamboo-leaf-flavonoids and glutathione on 5-HMF
目前竹叶黄酮和谷胱甘肽对食源性非酶糖基化的抑制机理尚未明确。在本文实验条件下,竹叶黄酮与谷胱甘肽都不和果糖发生糖基化反应,其对非酶糖基化的抑制作用可能与它们的抗氧化性能有关,反应前期和中期,糖基化反应会产生较多活性自由基[17],作为良好的抗氧化剂,竹叶黄酮和谷胱甘肽可以与这些自由基反应,从而抑制糖基化反应。竹叶黄酮和谷胱甘肽对晚期糖基化产物抑制可能由于二者都含有羟基,而糖基化终产物AGEs含有二酮结构,亲核性的羟基进攻糖基化中间产物的羰基,加成反应生成不稳定的中间体,此中间体发生多次重排后裂解,促使AGEs交联物断裂[18],从而使糖基化反应得到抑制。
3 结论

表3 竹叶黄酮与谷胱甘肽对小分子醛类的抑制(%)Table3 Inhibitory effectof bamboo-leaf-flavonoids and glutathione onmicromolecule aldehydes(%)
本文研究了竹叶黄酮与谷胱甘肽对食源性非酶糖基化体系的抑制作用。竹叶黄酮对NEG早期产物果糖胺和终期产物AGEs有较强抑制效果,对二羰基化合物有微弱的抑制效果;而谷胱甘肽对二羰基化合物和5-HMF有很强的抑制效果,对小分子醛类物质有较强的抑制效果。两者皆可适当抑制食源性糖基化反应,减少通过食物直接摄取AGEs,从而降低AGEs引起的相关疾病。而两者抑制效果的差别可能与其自身结构差别有关,相关机理还需要进一步研究。
[1]Martin S,Jongen W,Boekel M.A review of Maillard reaction in food and implications to kinetic modeling[J].Trends in Food Science&Technology,2001(11):364-373.
[2]Jasper W H.Advanced glycation end-products(AGEs)and heart failure pathophysiology and clinical implications[J].European Journal of Heart Failure,2007(9):1146-1153.
[3]金成,章宇,陆柏益,等.食品中Maillard反应伴生化学危害物的形成机制与控制技术研究.中国食品学报,2011,11(9):171-175.
[4]魏海峰,魏雁虹,李相军,等.单宁酸对糖尿病大鼠抗氧化能力及体外蛋白质非酶糖基化作用的影响[J].中国实验诊断学,2011,15(6):977-979.
[5]Matsuda H,Wang T,Managi H,et al.Structural requirements of flavonoids for inhibition of protein glycation and radical scavenging activities[J].Bioorganic&Medicinal Chemistry,2003(11):5317-5323.
[6]包蓓艳,沈汉超.谷胱甘肽抗氧化系统在早期糖尿病肾病中的变化[J].医师进修杂志内科版,2005,28(2):20-23.
[7]Billaud C,Brun-Merimee S,Louarme L,et al.Effect of glutathione and Maillard reaction products prepared from glucose or fructose with glutathione on polyphenoloxidase from apple—I Enzymatic browning and enzyme activity inhibition[J].Food Chemistry,2004,84:223-233.
[8]彭善丽,张根义.茶多酚对蛋白质糖基化作用的影响[J].食品工业科技,2011,32(12):183-186,209.
[9]张良栓,李丽静,王焕,等.泥鳅分泌多糖抗蛋白质非酶糖基化活性研究[J].哈尔滨医科大学学报,2010(10):436-439.
[10]孙丽平,庄永亮,张莉,等.酶解小麦蛋白产物-还原糖美拉德反应的光谱研究[J].分析化学研究简报,2009,37(9):1359-1362.
[11]Gogus F,Bozkurt H,Eren S.Kinetics ofmaillard reactions between themajor sugars and amino acids of boiled grape juice [J].LWT-Food Science and Technology,1998,31(2):196-200.
[12]高铁俊,董捷,张守文,等.氯化硝基四氮唑蓝比色法测定蜂王浆中糖化蛋白含量[J].食品科学,2009,30(24):256-259.
[13]Baker JR,Zyzak D V,Thorpe SR,et al.Chemistry of the Fructosamine assay:D-glucosone is the product of oxidation of amidori compounds[J].Clinical Chemical,1994,40(10):1950-1955.
[14]Kim H Y,Moon B H,Lee H J,et al.Flavonol glycosides from the leavesof Eucommia ulmoidesO.with glycation inhibitory activity[J].Journal of Ethnopharmaco1ogy,2004,93(2-3):227-230.
[15]Ruggiero L D,Lecomte M,Moinet G,et al.Reaction ofmet form in with dicarbonyl compounds.Possible implication in the inhibition of advanced glycosylation end product form ation[J].Biochem Pharmacol,1999,58(11):1765-1773.
[16]刘力谦.单糖转化制备5-羟甲基糠醛的研究[D].北京:北京化工大学,2010.
[17]Eriksson C.Maillard reactions in food[M].Cornell University:Pergamon,1981:81-91.
[18]吴茜,陈亨业,胡贝,吕哲娟,等.晚期糖基化终末产物的抑制机理及抑制剂的研究进展[J].中国实用医药,2012(11):237-239.

