硫化氢对大鼠肝纤维化的抑制作用及机制探讨
丁彦光,郑如恒,肖祥之
(复旦大学附属中山医院青浦分院,上海201700)
肝纤维化是各种慢性肝病共有的病理改变,是各种慢性肝病发展至肝硬化的必经阶段,是在病毒性肝炎、慢性乙醇或药物中毒、血吸虫肝病以及营养缺乏等多种因素的作用下,引起肝细胞变性、坏死,导致炎症反应,刺激纤维组织增生而形成的。肝纤维化的病理特征是胶原的生成与降解失衡,导致细胞外基质(ECM)合成增多,降解相对不足,ECM的过度沉积。目前认为,肝星状细胞(HSC)是肝脏中产生胶原等外基质的主要细胞,而肝损伤—肝实质炎症—坏死-HSC激活—大量ECM沉积是肝纤维化发生机制的中心环节[1]。当前众多研究资料表明,如能早期发现并及时治疗肝纤维化,病情可得到有效控制,肝纤维化尚有逆转的可能,因此阻断肝纤维化的进一步发展成为治疗慢性肝病的关键[2,3]。硫化氢(H2S)是当前生物医学领域中的又一崭新课题,其具有扩张血管、抑制血管平滑肌增殖和抗氧化应激等多种生物学效应。目前关于这一新的气体信号分子在肝纤维化发生、发展过程中的作用机制尚不多见。2011年10月~2013年10月,我们观察了外源性H2S对四氯化碳(CCL4)诱导大鼠肝纤维化的抑制作用,并探讨其机制。
1 材料与方法
1.1 动物 雄性SD大鼠50只,体质量为200~220 g,购自复旦大学医学院实验动物中心。
1.2 试剂 硫氢化钠(NaHS,美国Sigma公司);透明质酸(HA)、层黏连蛋白(LN)、Ⅲ型前胶原(PCⅢ)及Ⅳ型胶原(CⅣ)放射免疫检测试剂盒(上海海军医学研究所);超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化酶(GSH-Px)检测试剂盒(南京建成生物工程研究所有限公司);兔抗鼠Ⅰ型、Ⅲ型胶原单克隆抗体试剂盒(上海广锐生物科技有限公司)。
1.3 大鼠肝纤维化模型制备及处理 将50只雄性SD大鼠随机分为5组各10只,空白对照组皮下注射花生油2.0 mL/kg体质量,肝纤维化组注射同剂量40%CCL4花生油,NaHS低剂量组注射同剂量40% CCL4花生油+NaHS 7μmol/kg,NaHS高剂量组注射同剂量40%CCL4花生油+NaHS 14μmol/kg,秋水仙碱组注射相同剂量40%CCL4花生油+秋水仙碱0.25 mg/kg灌胃,每周2次,共8周[4]。
1.4 标本采集 实验第8周末处死大鼠,留取血液及肝组织标本,取出肝脏后用冷的等渗盐水灌注冲洗,选取部分肝脏组织,然后用10%中性甲醛固定,留做病理及免疫组化检查,镜检观察肝细胞变性与胶原纤维增生程度。
1.5 肝功能与脂质过氧化指标检测 留取大鼠血液后分离血清,采用全自动生化检测仪检测ALT、AST。选取肝左叶同一部位组织,制备成肝匀浆,采用放射免疫法检测肝脏组织HA、LN、PCⅢ、CⅣ;按试剂盒说明书操作步骤检测肝组织SOD、MDA、 GSH-Px的酶活性。
1.6 肝脏病理学检查 常规HE染色观察肝组织学改变,网状纤维和masson染色观察肝纤维组织增生状况。每张切片随机观察10个视野。根据肝组织病理变化,将大鼠肝纤维化的程度分为4期:0期为无纤维化;Ⅰ期为汇管区纤维化扩大,局部窦周及小叶内纤维化;Ⅱ期为汇管区周围纤维化,纤维间隔形成,小叶结构保留;Ⅲ期为纤维间隔伴小叶结构紊乱,无肝硬化;Ⅳ期为早期肝硬化,纤维结缔组织在全小叶多处弥漫性增生,假小叶形成。
1.7 肝组织Ⅰ型、Ⅲ型胶原检测 采用免疫组化法。所有肝组织标本均经10%甲醛溶液固定、石蜡包埋、4μm厚度连续切片。实验步骤严格按照免疫组化试剂盒说明书进行,以PBS代替一抗作阴性对照,DAB显色、苏木素复染、脱水、透明、封片、光镜下观察结果。
1.8 统计学方法 采用SPSS19.0统计软件。计量资料以±s表示,采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组肝功能与脂质过氧化指标比较 结果见表1。
表1 各组肝功能与脂质过氧化指标比较(±s)
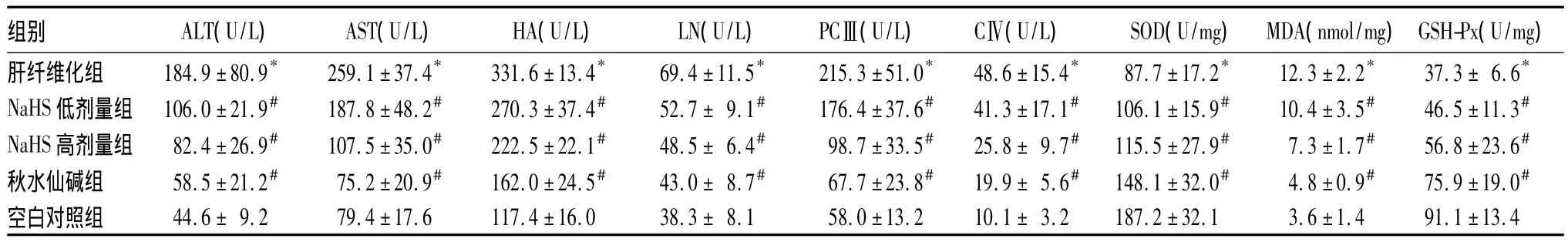
表1 各组肝功能与脂质过氧化指标比较(±s)
注:与空白对照组比较,*P<0.05;与肝纤维化组比较,#P<0.05
组别 ALT(U/L) AST(U/L) HA(U/L) LN(U/L) PCⅢ(U/L) CⅣ(U/L) SOD(U/mg) MDA(nmol/mg)GSH-Px(U/mg)肝纤维化组 184.9±80.9* 259.1±37.4* 331.6±13.4* 69.4±11.5* 215.3±51.0* 48.6±15.4* 87.7±17.2* 12.3±2.2* 37.3±6.6* NaHS低剂量组 106.0±21.9# 187.8±48.2# 270.3±37.4# 52.7±9.1# 176.4±37.6# 41.3±17.1# 106.1±15.9# 10.4±3.5# 46.5±11.3# NaHS高剂量组 82.4±26.9# 107.5±35.0# 222.5±22.1# 48.5±6.4# 98.7±33.5# 25.8±9.7# 115.5±27.9# 7.3±1.7# 56.8±23.6#秋水仙碱组 58.5±21.2# 75.2±20.9# 162.0±24.5# 43.0±8.7# 67.7±23.8# 19.9±5.6# 148.1±32.0# 4.8±0.9# 75.9±19.0#空白对照组 44.6±9.2 79.4±17.6 117.4±16.0 38.3±8.1 58.0±13.2 10.1±3.2 187.2±32.1 3.6±1.4 91.1±13.4
2.2 各组肝脏病理形态 对照组大鼠肝组织的肝组织结构正常,肝小叶结构完整,肝细胞索由中央静脉向四周排列整齐,中央静脉及汇管区结缔组织未见增生。肝纤维化组肝小叶结构紊乱,肝细胞广泛脂肪性变,汇管区炎性细胞、坏死细胞增多,纤维间隔向小叶内伸展形成大小不一纤维包绕,细胞索排列紊乱,纤维间隔增厚,可见假小叶形成,可见明显的大量炎细胞浸润。NaHS低剂量组、NaHS高剂量组及秋水仙碱组均明显减轻肝纤维化程度,肝细胞脂肪变性程度减轻,双核肝细胞较少,库普弗细胞增生、肥大,汇管区胶原纤维较肝纤维化组显著减少,少量炎细胞浸润,对炎性细胞浸润、胶原纤维的增生以及肝小叶的破坏和假小叶的形成等均有明显的改善。
2.3 各组肝脏胶原增生程度比较 对照组大鼠肝组织肝小叶完整、肝索排列整齐,结构正常,肝细胞无脂肪变性,在汇管区与中央静脉周围有微量胶原纤维分布。肝纤维化组肝细胞广泛脂肪变性,肝索排列紊乱,汇管区炎性细胞、坏死细胞增多,汇管区和小叶内出现局限性的纤维化,部分区域出现纤维分隔,肝小叶结构破坏,甚至有假小叶形成。与肝纤维化组比较,NaHS低剂量组、NaHS高剂量组、秋水仙碱组肝组织胶原纤维异常分布明显减少,变性坏死肝细胞减少,结缔组织轻度增生。对照组肝纤维化分级均为0级;肝纤维化组大多为3~4级;NaHS低剂量组、NaHS高剂量组及秋水仙碱组大多为1~2级,与肝纤维化组比较纤维化程度明显减轻(P均<0.05)。
2.4 各组肝组织Ⅰ型、Ⅲ型胶原表达 空白对照组肝脏Ⅰ型胶原阳性染色只见于汇管区和中央静脉管壁,Ⅲ型胶原主要存在于大血管周围;肝纤维化组肝脏Ⅰ型、Ⅲ型胶原广泛存在于纤维间隔及肝细胞内。与肝纤维化组比较,NaHS低剂量组、NaHS高剂量组及秋水仙碱组大鼠肝脏中Ⅰ型、Ⅲ型胶原明显减少,纤维间隔较薄。
3 讨论
肝纤维化是多种类型细胞、氧化应激、细胞因子和生长因子等一系列复杂作用的结果,是以ECM成分的过度增生与异常沉积为主要特征。HSC是肝脏ECM的主要来源,是肝纤维化形成的细胞学基础,肝损伤—肝实质炎症—坏死-HSC激活—大量ECM沉积,是肝纤维化发生机制的中心环节。因此,阻断肝纤维化的发生和发展,对防治肝硬化和肝癌具有重要意义。氧化应激、脂质过氧化与肝纤维化形成的关系密切,氧化和抗氧化损伤的失衡可以促进HSC的增殖,导致胶原合成增加。各种因素造成的肝损伤产生了大量的脂质过氧化物,超出了机体的清除能力,使其发生脂质过氧化、MDA水平提高、SOD含量减少。脂质过氧化产物还可以损伤Kuppfer细胞、肝细胞,引起变性坏死,使氧自由基以及各种细胞因子大量释放,致HSC被激活,大量ECM沉积,进而导致肝纤维化的发生。几乎所有临床和实验性肝纤维化都被证实与氧化应激有关。
H2S是一种无色、易燃、能溶于水的,具有臭鸡蛋气味的气体,数十年来,H2S只是作为一种污染环境的有毒气体而被关注。20世纪90年代,Abe等[5]首次证明人体内源性H2S可作为一种神经活性物质而存在,而越来越多的实验证据表明,H2S不仅可以在人和动物组织内被代谢和生成,而且还广泛参与机体多种生理和病理过程,H2S不仅可以调节学习、记忆及神经元的兴奋性,而且H2S还同NO和CO一样,具有扩张血管和消化道平滑肌、抑制平滑肌细胞增殖和清除氧自由基的作用。内源性H2S作为气体小分子可以自由通过细胞膜,其作用不依赖于相应的质膜受体,而是在吡多醛-5'-磷酸依赖性酶包括胱硫醚-β-合成酶、胱硫醚-γ-裂解酶的作用下催化产生,并发生相应的调控作用[6]。H2S其细胞学效应可以依赖或不依赖第二信使cAMP的介导,具有特定的细胞和分子作用的靶点[7]。
近年来研究[8]证实,H2S在肝纤维化及门脉高压的发生、发展过程中起重要的保护性作用。有研究[9]发现,肝硬化患者血浆H2S降低与肝功能有关,能明显降低肝脏谷氨酸转氨酶和天冬氨酸转氨酶的水平。本研究显示,肝纤维化组ALT、AST较空白对照组升高,NaHS低剂量组、NaHS高剂量组、秋水仙碱组ALT、AST较肝纤维化组降低,此与沈钦海等[10]研究一致。
研究[11]证明,氧应激下H2S对HSC具有保护作用,可抑制肝纤维化的发生、发展,提示H2S能够参与氧化应激反应。SOD、GSH是机体抗氧化损伤防御体系中最重要的抗氧化酶,其反映了机体清除氧自由基的能力[12]。MDA是脂质过氧化的重要终产物,反映了机体细胞受自由基攻击的严重程度,它可促进Ⅰ型胶原的mRNA表达,与HSC增殖和胶原合成密切。本研究显示,肝纤维化组MDA较空白对照组升高,SOD、GSH-Px较空白对照组降低; NaHS低剂量组、NaHS高剂量组、秋水仙碱组MDA较肝纤维化组降低,SOD、GSH-Px较肝纤维化组升高,此与王宏宾等[13]研究结果相同。
另外有研究发现,HA、LN、PCⅢ及CⅣ与肝纤维化形成关系密切相关[14]。本研究显示,肝纤维化组HA、LN、PCⅢ、CⅣ较空白对照组升高,NaHS低剂量组、NaHS高剂量组、秋水仙碱组HA、LN、PCⅢ、CⅣ较肝纤维化组降低;且NaHS低剂量组、NaHS高剂量组、秋水仙碱组肝纤维化程度较肝纤维化组减轻,肝组织胶原纤维异常分布较肝纤维化组减少。均提示外源性H2S能减少胶原的生成,抑制肝纤维化的进程,其机制可能是通过抑制HSC的激活,减少ECM的合成,从而发挥抗纤维化作用。
肝纤维化是以HSC的大量增殖,ECM过度沉积,胶原合成与表达增多,并在肝脏间质内聚集为重要表现,其中Ⅰ型和Ⅲ型胶原是肝内主要的间质型胶原。本研究显示,NaHS低剂量组、NaHS高剂量组、秋水仙碱组Ⅰ型、Ⅲ型胶原较肝纤维化组减少。其机制可能是NaHS在抑制肝脏HSC增殖的同时还抑制其胶原的合成与表达,此与刘文东等[15]研究结果一致。
总之,外源性H2S能有效抑制肝纤维化的发生、发展,其机制可能与其清除自由基、提高抗氧化物酶的活性、抑制HSC的胶原合成、减少ECM在肝脏中的沉积有关。
[1]Friedeman SL.Liver fibrosis-from bench to bedside[J].JHepatol,2003,38(Suppl1):38-53.
[2]Loguercio C,Federico A.Oxidative stress in viral and alcoholic hepatitis[J].Free Radic Biol Med,2003,34(1):1-10.
[3]Kitade Y,Watanabe S,Masaki T,etal.Inhibition of liver fibrosis in LEC rats by acarotenoid,lycopene,or aherbalmedicine,shosaiko-to[J].Hepatol Res,2002,22(3):196-205.
[4]Yan H,Du J,Tang C.The possible role of hydrogen sulfide on the pathogenesis of spontaneous hypertension in rats[J].Biochem Biophys Res Commun,2004,313(1):22-27.
[5]Abe K,Kimura H.The possible role of hydrogen sulfide as an endogenous neuromodulator[J].J Neurosci,1996,16(3):1066-1071
[6]Geng B,Yang JH,Qi YF,et al.H2S generated by heart in rat and its effect on cardiac function[J].Biochem Biophys Res Commun,2004,313(2):362-368.
[7]Wang R.The gasotransmitter role of hydrogen sulfide[J].Antioxid Redox Signal,2003,5(4):493-501.
[8]Zhang N,Zheng Y,Wang YL,etal.Role ofendogenoushydrogen sulfide in rats with hepatic cirrhosis at different stages[J].World Gastroenterology,2009,17(3):307-311.
[9]Kang K,Zhao M,Jiang H,et al.Role of hydrogen sulfide in hepatic ischemia-repedusion injury in rats[J].Liver Transpl,2009,15(10):1306-1314.
[10]沈钦海,秦召敏,逯爱梅.硫化氢对大鼠肝纤维化的预防作用[J].中南大学学报(医学版),2013,37(9):911-915.
[11]阳丹才让,邓勇,任利,等.硫化氢对MDA及GSH在大鼠肝星状细胞氧应激中表达的影响[J].世界华人消化杂志,2009,17 (36):3725-3728.
[12]Salvemini D,Riley DP,Cuzzocrea S.SODmimetics are coming of age[J].Nat Rev Drug Discov,2002,1(5):367-374.
[13]王宏宾,樊海宁,邓勇.硫化氢对大鼠肝星形细胞增殖和氧应激的影响[J].青海医学院学报,2008,29(4):228-232.
[14]孔宪涛.肝纤维化诊断指标及评价[J].中华肝脏病杂志,1998,6(4):243-244.
[15]刘文东,李英娴,娄婷婷,等.青蒿琥酯对肝纤维化大鼠肝组织基金属蛋白酶表达的影响[J].天津医科大学学报,2013,19 (5):362-364.

