罗曼鹤鸡骨髓间充质干细胞的分离培养和鉴定
李双星,朴丰源,戚 媛,刘晓辉,李亚晨,刘 爽,李双月
(1哈尔滨医科大学附属第一医院,哈尔滨150001;2大连医科大学)
骨髓间充质干细胞(BMSCs)是一类来源于中胚层、具有多向分化潜能的成体干细胞,可向骨、神经、肝、心肌、内皮等多种胚层细胞分化,已经成为组织工程和细胞移植的重要细胞来源,在组织功能/结构重建、创伤修复及人工器官等领域具有广阔的应用前景[1,2]。有关BMSCs的研究目前多集中于人、大鼠和小鼠,鸡BMSCs相关的研究报道不多见。鸡作为首个进行基因组测序的禽类,已揭示了众多胚胎发育机制,动物肿瘤可由病毒引起亦是以鸡为模型首次证明,鸡是胚胎发育、肿瘤和免疫系统等研究的重要模型,鸡BMSCs已成为相关研究不可替代的体外模型[3~5]。2009年,Mahesh等首次分离培养出鸡BM-SCs,但其采用的密度梯度离心法操作繁琐,同时亦破坏了BMSCs的生长微环境,限制了BMSCs的培养和应用[6,7]。2012年11月~2013年5月,我们利用全骨髓贴壁法对鸡BMSCs进行分离培养和鉴定,以期建立一种简单、高效的鸡BMSCs分离、培养体系,为鸡BMSCs的进一步研究和应用提供实验基础。
1 材料与方法
1.1 材料 罗曼鹤鸡,1~14天龄,由大连韩伟集团提供。DMEM培养基、胎牛血清、胰蛋白酶(Hyclone公司),二苯基四氮唑溴盐(MTT)、青霉素、链霉素(上海生工生物工程有限公司),地塞米松、β-磷酸甘油、抗坏血酸、谷氨酰胺、胰岛素、异丁基甲基黄嘌呤、吲哚美辛(Sigma公司),FITC-CD29抗体、PE-CD34抗体(e-Bioscience公司)。
1.2 鸡BMSCs的分离培养 鸡脱臼处死,无菌分离完整的股骨及胫骨,清除附着的肌肉组织,暴露骨髓腔并反复冲洗,尤其是干骺端。将冲出的骨髓细胞过筛网制成单细胞悬液,离心后用含10%FBS的DMEM培养液重悬并接种于培养皿,于37℃、CO2饱和湿度培养箱中培养。接种24 h后全量换液,以后每3 d换液1次。待细胞达到80%~90%融合,0.25%胰酶消化并按1∶2进行传代,利用差速贴壁特性逐步纯化BMSCs。
1.3 鸡BMSCs的鉴定
1.3.1 形态学观察 倒置显微镜下观察细胞形态及贴壁状况,并记录。
1.3.2 增殖能力检测 取生长状态良好的第3代BMSCs,以4×103/mL接种于96孔板,每组6复孔,每3 d换液1次,采用MTT法检测其生长增殖能力。从培养第1天到第7天,每天相应复孔加入20μL MTT(5 g/L)溶液,37℃孵育4 h,小心弃去上清液,每孔加入150μL DMSO,微量振荡器震荡10 min,使结晶物充分溶解,酶标仪检测490 nm波长处各孔光密度值(OD值),以时间为横坐标,OD值为纵坐标绘制生长曲线。
1.3.3 表面标志物检测 第3代BMSCs胰蛋白酶室温消化,离心收集细胞,PBS清洗细胞并制成单细胞悬液。各样本分别加入抗CD29和CD34的荧光标记抗体,同时设立同型阴性对照,4℃避光孵育,用流式细胞仪进行检测。
1.4 鸡BMSCs分化能力检测
1.4.1 鸡BMSCs成骨诱导分化 将2×108/L生长状况良好的第3代BMSCs接种于培养板,待细胞长至80%~90%融合时,在各诱导孔加入成骨诱导培养基(DMEM培养液含10%胎牛血清、5μg/mL抗坏血酸、10 mmol/Lβ-磷酸甘油、100 nmol/L地塞米松),对照孔加入含10%胎牛血清的DMEM常规完全培养液,每3天换液1次。诱导分化第21天进行茜素红染色。
1.4.2 鸡BMSCs成脂诱导分化 选用第3代生长状态良好的 BMSCs,2×108/L接种,待细胞长至80%~90%融合时,在各诱导孔加入成脂诱导培养基(DMEM培养液含10%胎牛血清、5μg/mL胰岛素、1μmol/L地塞米松、10 mmol/L异丁基甲基黄嘌呤、600 nmol/L吲哚美辛),对照孔加入DMEM常规完全培养液,每3天换液1次。诱导分化第14天进行油红O染色。
2 结果
2.1 鸡BMSCs形态学变化 鸡骨髓细胞初始接种时悬浮于培养液中,24 h后部分细胞贴壁,呈短梭形、多角形等形态;6 d后部分细胞形成散在集落,细胞突起变长、变大,并且长短不一、粗细不均(图1A);14 d左右细胞集落相互靠近并融合成片(图1B)。传代后细胞生长速度明显变快,细胞形态趋向均一,长梭形、束状或漩涡状排列(图1C)。
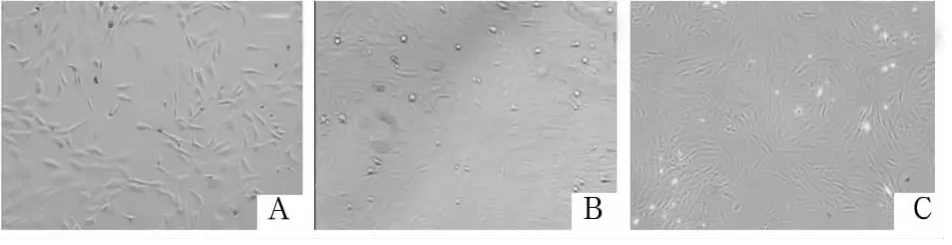
图1 鸡BMSCs的形态学变化
2.2 鸡BMSCs生长曲线 见图2。由图2可见,鸡BMSCs的生长潜伏期为1~3 d,之后进入对数生长期,第6天以后开始进入平台期。

图2 第3代鸡BMSCs生长曲线
2.3 鸡BMSCs表面标志物 流式检测结果显示,BMSCs的表面标志物 CD29的阳性表达率为92.10%,造血系细胞的表面标志CD34表达率仅为0.80%(图3),提示第3代贴壁细胞主要是BMSCs。
2.4 鸡BMSCs成骨诱导分化情况 成骨诱导第7天可见部分细胞聚集成团、呈放射状排列,10 d左右出现细胞聚集形成的结节,之后结节逐渐增多,部分细胞轮廓不清、透光性差。鸡BMSCs诱导分化进行第21天茜素红染色,阳性区域呈现鲜红色,有明显的矿化结节形成,见图4。对照孔内未见着色区域。
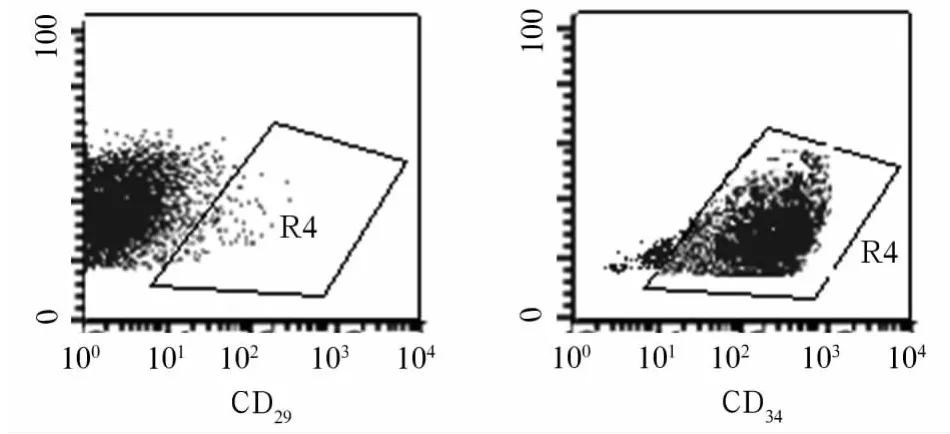
图3 鸡BMSCs表面标志物表达情况
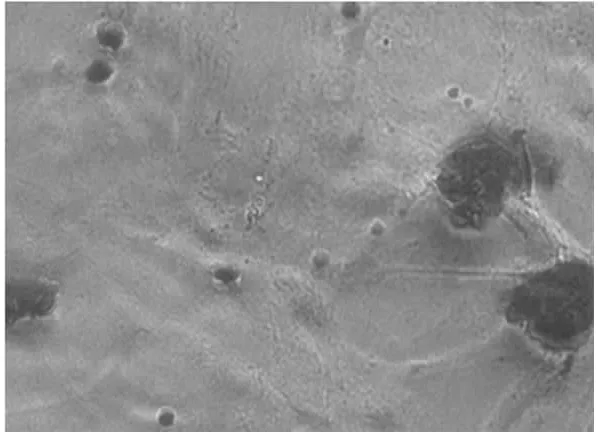
图4 鸡BMSCs来源的成骨细胞茜素红染色(×200)
2.5 鸡BMSCs成脂诱导分化情况 BMSCs成脂诱导14 d后,细胞密度减低,细胞间空隙增大,可见圆形高亮细胞,有些椭圆形细胞内可见呈串珠样排列分布的脂样小滴,脂滴变大并合并呈串珠状。油红O染色显示胞质内有大量鲜红色串珠样或大的融合脂滴,细胞体积较大呈圆形(图5)。对照细胞染色无脂质沉积。

图5 鸡BMSCs来源的成脂细胞油红O染色(×100)
3 讨论
鸡胚是发育生物学、肿瘤学、血管药理学等研究的理想模型,成年鸡更是迟发性神经毒性等研究不可替代的动物模型。而有关BMSCs的研究目前多集中于人和啮齿类动物,家禽中多集中于猪,鸡BMSCs的相关报道较少。本研究利用差速贴壁法,从罗曼鹤鸡的骨髓中分离培养出高纯度、高分化潜能的BMSCs。
目前,BMSCs体外分离培养体系主要包括密度梯度离心法、流式细胞仪分选法、免疫磁珠法、全骨髓贴壁法。密度梯度离心法可根据细胞密度的不同提取出单核细胞进行培养,但操作较繁琐、细胞获得量较低。流式细胞术和免疫磁珠法虽可获得纯度较高的BMSCs,但对细胞活性有较大损伤,且价格昂贵,难以普及[8]。差速贴壁培养法是根据BMSCs的贴壁特性,通过定期换液去除骨髓中的不贴壁细胞的分离方法。此种方法筛选出的BMSCs活性高,损伤小,而且骨髓中的其他干细胞和基质细胞能分泌生长因子和细胞外基质,模拟体内微环境,促进BMSCs贴壁生长,BMSCs能较快适应体外培养环境,细胞增殖迅速[9]。要获得较大数量、活性较高的BMSCs,全骨髓贴壁法更为可取。
各种属来源的BMSCs目前均缺乏特异性的检测指标,通常根据细胞形态、细胞增殖特点、相对特异的表面标记和多向分化潜能等方面相结合来对其进行鉴定,鸡BMSCs亦是如此。本实验罗曼鹤鸡骨髓中分离的单个核细胞,通过差速贴壁筛选能够生长形成长梭形或成纤维细胞样、呈束装或旋涡状排列的细胞克隆,与间充质干细胞的形态学特征一致[10]。细胞生长曲线是判断细胞活性的重要指标。细胞传代后,一般先是短暂的悬浮然后贴壁,随后度过长短不同的潜伏期,即进入大量分裂的对数生长期。在细胞达到饱和密度后,停止生长,进入平顶期,然后退化衰亡。本研究用MTT法检测并绘制了第3代鸡BMSCs的生长曲线,经过3~6 d的对数生长期后进入平台期。田少囡等[11]报道,北京油鸡肺间充质干细胞在最佳培养体系内对数生长期可持续约4 d,品系及组织来源可能会影响间充质干细胞的细胞活性。高健等[12]报道,家禽中猪BMSCs的细胞活性也受品系影响,进一步证实了本实验结果。
BMSCs目前缺乏特异性的表面标记物,一般认为CD29、CD90、CD105等都可作为BMSCs的重要标记物,而CD34、CD45等为造血系细胞的表面标志物,在BMSCs上不表达[13~16]。本实验参考相关文献报道,选择CD29和CD34作为甄别BMSCs的标记物。结果证明,本研究得到了纯度较高的BMSCs。
判定BMSCs的另一个重要指标是看其是否具有多向分化能力。分离的鸡BMSCs向成骨细胞分化21 d后,细胞出现明显的钙化结节,茜素红染色阳性,显示细胞分化为成骨细胞并有分泌钙质的功能。鸡BMSCs向脂肪细胞分化14 d后,细胞油红O染色阳性,细胞内出现明显的脂质小滴,证明细胞已向成脂细胞分化。
总之,本实验成功分离培养出罗曼鹤鸡BMSCs并进行了相关鉴定,建立了适合鸡BMSCs的体外培养和鉴定体系,为进一步深入研究提供了实验基础。
[1]Pittenger MF,Mackay AM,Beck SC,etal.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284 (5411):143-147.
[2]Herzog EL,Chai L,Krause DS,etal.Plasticity ofmarrow-derived stem cells[J].Blood,2003,102(10):3483-3493.
[3]Cooper MD,Raymond DA,Peterson RD,et al.The functions of the thymus system and the bursa system in the chicken[J].JExp Med,1966,123(1):75-102.
[4]Silveira P,Marin SY,Moreira PA,etal.Interactions of plasmodium juxtanucleare and chicken anaemia virus:establishing amodel[J].Parasitology,2013,140(14):1777-1788.
[5]Wang JX,Zhou JY,Yang QW,et al.An improved embryonated chicken eggmodel for the evaluation of antiviral drugs against influenza a virus[J].JVirol Methods,2008,153(2):218-222.
[6]KhatriM,O'Brien TD,Sharma JM.Isolation and differentiation of chicken mesenchymal stem cells from bone marrow[J].Stem Cells,2009,18(10):1485-1492.
[7]Hung SC,Chen NJ,Hsieh SL,etal.Isolation and characterization of size-sieved stem cells from human bonemarrow[J].Stem Cells,2002,20(3):249-258.
[8]Deryugina EI,Muller-Sieburg CE.Stromal cells in long term cultures to the elucidation of hematoporetic development[J].Crit Rev Immunol,1993,13(2):115-119.
[9]陈凯,康现江,张平,等.SD大鼠骨髓间充质干细胞的体外培养及表型、纯度鉴定[J].山东医药,2010,50(11):34-36.
[10]Friedenstein AJ,Petrakova KV,Kurolesova AI,et al.Heterotopic of bonemarrow.Analysisof precursor cells for osteogenic and hematopoietic tissues[J].Transplantation,1968,6(2):230-247.
[11]田少囡,候玲玲,关伟军,等.北京油鸡肺间充质干细胞的分离培养及鉴定[J].生物技术通报,2011,12(233):139-145.
[12]高健,梁桂金,朴英姬,等.猪骨髓间充质干细胞分离培养及生物学特性[J].中国兽医学报,2013,33(5):788-793.
[13]Colter DC,Class R,DiGirolamo CM,etal.Rapid expansion of recycling stem cells in cultures of plastic-adherent cells from human bonemarrow[J].Proc Natl Acad Sci USA,2000,97(7):3213-3218.
[14]Morikawa S,Mabuchi Y,Kubota Y,et al.Prospective identification,isolation,and systemic transplantation ofmultipotentmesenchymal stem cells in murine bonemarrow[J].JExp Med,2009,206(11):2483-2496.
[15]Hennrick KT,Keeton AG,Nanua S,et al.Lung cells from neonates show a mesenchymal stem cell phenotype[J].Am JRespir Crit Care Med,2007,175(11):1158-1164.
[16]Strem BM,Hicok KC,Zhu M,et al.Multipotential differentiation of adipose tissue-derived stem cells[J].Keio J Med,2007,54 (3):132-141.

