胃癌组织中MMP-9 mRNA、TIMP-1 mRNA的表达变化及意义
葛夫军
(山东医学高等专科学校附属医院,山东临沂276000)
胃癌的浸润与侵袭是多因子、多通路共同作用与调控的结果,细胞外基质浸润和基底膜破坏则为其重要原因之一。基质金属蛋白酶9 (MMP-9)能够特异性降解与破坏细胞外基质及基底膜的重要成分Ⅳ型胶原,是参与肿瘤转移的重要介导因子[1];基质金属蛋白酶组织抑制剂1 (TIMP-1)是一种分布广泛的内源性MMP抑制剂,可抑制 MMP蛋白水解作用[2]。本研究通过RT-PCR法检测胃癌、癌旁胃黏膜组织及胃溃疡组织中MMP-9 mRNA、TIMP-1 mRNA表达,探讨两者与胃癌浸润、转移的关系。
1 资料与方法
1.1 临床资料 2009年10月~2012年10月于山东医学高等专科学校附属医院普外科行胃癌手术的患者43例(胃癌组),男24例,女19例;年龄29~72岁,中位年龄53岁。术中同时留取胃癌组织43份及距肿瘤边界>5 cm的癌旁组织35份。均经术后病理检查确诊,其中肿瘤直径<5 cm者29例、≥5 cm者14例;按照2011版NCCN胃癌临床实践指南[3]高中分化15例、低分化28例,浸润深度在T1~T3级22例、T4级21例,临床分期为Ⅰ+Ⅱ期18例、Ⅲ期25例,有淋巴结转移30例。设同期手术的8例胃溃疡穿孔患者为对照组,男5例,女3例;年龄27~68岁,中位年龄51岁。以上病例全部排除冠心病、高血压、糖尿病、结核、脑血管病及其他肿瘤病史,并排除半年内有手术史者;两组性别、年龄均无统计学差异,具有可比性。两组胃黏膜标本取出后一部分浸泡于RNAstore保存液(北京天根生化科技有限公司)中,另一部分置于液氮中,于-80℃冰箱保存备用。
1.2 MMP-9 mRNA、TIMP-1 mRNA的检测方法
1.2.1 组织总RNA提取和cDNA合成 总RNA提取试剂盒和Quant cDNA第一链合成试剂盒均购自天根生化科技公司。RNA完整性采用琼脂糖凝胶电泳检测,其透过率与纯度采用紫外分光光度计检测。以Oligo-dT15为引物,参照20μL反应体系合成cDNA第一链。以上所有步骤均严格参照说明书操作。
1.2.2 PCR反应 根据NCBI GenBank中人源cDNA序列,内参β-actin及MMP-9、TIMP-1引物序列由金斯瑞科技公司合成并提供。其中β-actin上游引物为5'-GGGACGACATGGAGAAAATC-3',下游引物为5'-GATCTGGGTCATCTTCTCGC-3',扩增产物为131 bp;MMP-9正义链为5'-CCTTCTACGGCCACTACTGT-3',反 义 链 为 5'-TCCACCTGGTTCAACTCACT-3',扩增产物为575 bp;TIMP-1正义链为5'-ACTTCCACAGGTCCCACAAC-3',反义链为5'-AGAAAGATGGGAGTGGGAAC-3',扩 增 产 物405 bp。PCR反应条件:变性94℃ 1 min,退火55℃1 min,延伸72℃ 2 min,共30个循环;72℃5 min。紫外灯下观察PCR产物琼脂糖凝胶电泳结果,采用Kodak DC 290凝胶成像系统分析。各组βactin和MMP-9、TIMP-1的扩增产物条带的净像素值及目的基因的相对表达水平采用Kodak1D1图像分析软件分析。
1.3 统计学方法 采用SPSS17.0软件进行统计分析。计量资料以±s表示,多组比较用方差分析法,两两比较用最小显著差异LSD法;相关性检验应用直线相关分析法。P≤0.05为差异有统计学意义。
2 结果
2.1 不同胃黏膜组织中 MMP-9 mRNA、TIMP-1 mRNA的表达 三种胃黏膜组织中MMP-9 mRNA和TIMP-1 mRNA的琼脂糖凝胶电泳均出现长约为575 bp和405 bp的条带,明亮度以胃癌组织中T4级、有淋巴结转移、Ⅲ期者为著(见图1);两指标相对表达量比较见表1。
2.2 MMP-9 mRNA、TIMP-1 mRNA表达与胃癌临床病理特征的关系 MMP-9 mRNA、TIMP-1 mRNA的表达均与患者性别、年龄、肿瘤大小及分化程度无关(P均>0.05),与浸润深度、淋巴结转移及临床分期有关(P均<0.05)。详见表2。
2.3 胃癌组织中MMP-9 mRNA和TIMP-1 mRNA表达的相关性 在胃癌T4级、有淋巴结转移、Ⅲ期组织中MMP-9 mRNA和TIMP-1 mRNA表达呈显著负相关,P均<0.05(r分别为-0.32、-0.51、-0.48)。

图1 MMP-9 m RNA、TIMP-1 m RNA琼脂糖凝胶电泳图
表1 三种胃黏膜组织中MMP-9 mRNA、TIMP-1 m RNA的表达比较(±s)

表1 三种胃黏膜组织中MMP-9 mRNA、TIMP-1 m RNA的表达比较(±s)
注:与其他两种组织比较,*P<0.05
胃黏膜组织MMP-9 mRNA TIMP-1 mRNA胃癌组织 0.901 7±0.108 2* 0.487 6±0.071 1*癌旁组织 0.765 9±0.119 6 0.365 9±0.085 2胃溃疡组织0.748 5±0.104 2 0.328 5±0.067 1
表2 MMP-9 m RNA和TIMP-1 mRNA相对表达与胃癌临床病理特征的关系(±s)
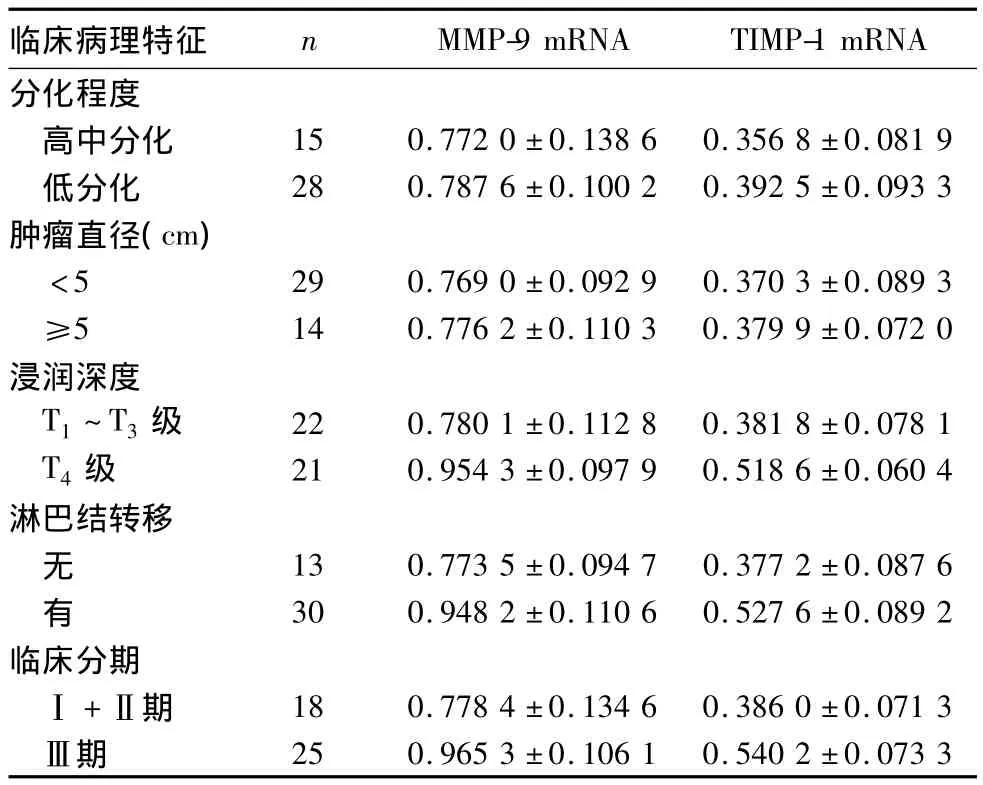
表2 MMP-9 m RNA和TIMP-1 mRNA相对表达与胃癌临床病理特征的关系(±s)
临床病理特征 n MMP-9 mRNA TIMP-1 mRNA分化程度高中分化 15 0.772 0±0.138 6 0.356 8±0.081 9低分化 28 0.787 6±0.100 2 0.392 5±0.093 3肿瘤直径(cm)<5 29 0.769 0±0.092 9 0.370 3±0.089 3≥5 14 0.776 2±0.110 3 0.379 9±0.072 0浸润深度T1~T3级 22 0.780 1±0.112 8 0.381 8±0.078 1 T4级 21 0.954 3±0.097 9 0.518 6±0.060 4淋巴结转移无13 0.773 5±0.094 7 0.377 2±0.087 6有30 0.948 2±0.110 6 0.527 6±0.089 2临床分期Ⅰ+Ⅱ期 18 0.778 4±0.134 6 0.386 0±0.071 3Ⅲ期25 0.965 3±0.106 1 0.540 2±0.073 3
3 讨论
据统计,胃癌复发患者中腹膜转移占60%,是胃癌治疗的难点[4];发生复发转移的胃癌患者,5年生存率接近0[5]。分子生物学研究[1]发现,恶性肿瘤的转移和侵袭涉及多基因、多步骤,而肿瘤细胞发生脱落和转移的重要先决条件之一就是其细胞外基质降解和基底膜破坏。MMP是一类Zn2+依赖性蛋白酶家族,主要由结缔组织分泌,参与降解细胞外基质,目前发现的类型已超过20种。MMP-9为MMP超家族的重要成员,因能特异性降解和破坏Ⅳ型胶原在肿瘤浸润、侵袭中发挥重要作用[1]。此外,MMP-2降解后的Ⅰ型胶原能够激活MMP-9,后者可再与MMP-13协同降解与破坏其他基底膜成分。
已有多项研究[1,6,7]表明,MMP及其抑制剂TIMP在恶性肿瘤的转移和侵袭中起重要作用。TIMP在肿瘤及其间质组织中均有表达,被认为是MMP的天然抑制剂。TIMP主要在酶原活化及活化MMP阶段调控 MMP的表达与活性。TIMP-1与MMP-9酶原所形成的稳定复合物能够阻止后者的自我活化;而TIMP-1与活化MMP-9结合能够直接抑制后者的催化活性[8~10]。Mroczko等[11]和Zhang等[12]研究均发现,在胃癌组织中可检测到TIMP-1表达,且表达水平与肿瘤的浸润深度、淋巴结转移、临床分期密切相关。本研究显示,胃癌组织中MMP-9 mRNA、TIMP-1 mRNA表达均显著高于癌旁组织和胃溃疡组织,尤以T4级、有淋巴结转移、Ⅲ期者为著;MMP-9 mRNA、TIMP-1 mRNA表达均与患者性别、年龄、肿瘤大小及分化程度无关,与浸润深度、淋巴结转移及临床分期有关。表明MMP-9及TIMP-1在胃癌浸润和转移中发挥重要作用,与多篇文献[8,11,12]报道类似。本研究还显示,在胃癌 T4级、有淋巴结转移、Ⅲ期组织中MMP-9 mRNA和TIMP-1 mRNA表达呈显著负相关。说明MMP-9与TIMP-1之间存在着平衡与制约。MMP-9低表达、TIMP-1高表达时,MMP-9活性受到抑制,TIMP-1发挥主导作用,保护基底膜的完整,促使肿瘤局限; MMP-9高表达、TIMP-1低表达时,MMP-9降解和破坏细胞外基质及基底膜,促进肿瘤细胞的脱落、转移。研究[13,14]认为,TIMP-1和MMP-9之间的动态平衡在影响肿瘤浸润与侵袭过程中更有意义,两者比例失衡较其中某一单独因素的改变更为重要。MMP和TIMP在机体内的动态平衡被打破,TIMP较MMP表达降低或活性降低时,TIMP对MMP的抑制能力相对减弱,导致MMP活性增强,促使细胞外基质及基底膜的降解与破坏,为肿瘤细胞突破基底膜提供条件,甚至造成淋巴或血行转移。
综上所述,胃癌组织中MMP-9 mRNA、TIMP-1 mRNA的表达升高,且与肿瘤浸润、侵袭有关。
[1]Velinov N,Poptodorov G,Gabrovski N,et al.The role ofmatrix metalloproteinases in the tumor growth and metastasis[J].Khirurgiia(Sofiia),2010,45(1):44-49.
[2]王丽燕,张冬梅.鼻腔鳞状细胞癌组织中MMP-2、MMP-9、TIMP-1、TIMP-2的表达变化及意义[J].山东医药,2013,53(3):74-75.
[3]Visse R,Nagase H.Matrixmetalloproteinases and tissue inhibitors ofmetalloproteinases:structure,function,and biochemistry[J].Circ Res,2003,92(8):827-839.
[4]陈峻青.胃癌综合治疗的新理念与新认识[J].中华外科杂志,2009,47(17):1281-1284.
[5]Yonemura Y,Fujimura T,Nishimura G,et al.Effects of intraoperative chemohyperthermia in patientswith gastric cancerwith peritoneal dissemination[J].Surgery,1996,119(4):437-444.
[6]Watanabe H.Extracellularmatrix-regulation of cancer invasion and metastasis[J].Gan To Kagaku Ryoho,2010,37(11):2058-2061.
[7]Bourboulia D,Stetler-Stevenson WG.Matrix metalloproteinases (MMPs)and tissue inhibitors of metalloproteinases(TIMPs): positive and negative regulators in tumor cell adhesion[J].Semin Cancer Biol,2010,20(3):161-168
[8]de Mingo M,Morán A,Sánchez-Pernaute A,et al.Expression of MMP-9 and TIMP-1 as prognostic markers in gastric carcinoma[J].Hepatogastroenterology,2007,54(73):315-319.
[9]Mroczko B,Lukaszewicz-Zajac M,Groblewska M,et al.Expression of tissue inhibitors ofmetalloproteinase 1(TIMP-1)in gastric cancer tissue[J].Folia Histochem Cytobiol,2009,47(3):511-516.
[10]Zhang M,Zhu GY,Gao HY,et al.Expression of tissue levels of matrixmetalloproteinases and tissue inhibitors ofmetalloproteinases in gastric adenocarcinoma[J].JSurg Oncol,2011,103(3):243-247.
[11]Yang S,Zhao Z,Wu R,et al.Expression and biological relationship of vascular endothelial growth factor-A and matrixmetalloproteinase-9 in gastric carcinoma[J].J Int Med Res,2011,39(6): 2076-2085.
[12]毕立志.胃癌组织中MMP-2、MMP-9、VEGF的表达变化及意义[J].山东医药,2011,51(14):40-41.
[13]Waveren C,Sun Y,Cheung HS,et al.Oxidative phosphorylation dysfunction modulates expression of extracellularmatrix-remodeling genes and invasion[J].Carcinogenesis,2006,27(3):409.
[14]武莉丽,高玉环,李涛,等.MMP-2、TIMP-2基因启动子区多态性与NHL临床特点及预后的关系[J].山东医药,2013,53 (18):1-5.

