奶牛乳房炎3种主要致病菌三重PCR检测方法的建立
,,,,,,,,
(广西大学动物科学技术学院,广西南宁 530001)
奶牛乳房炎3种主要致病菌三重PCR检测方法的建立
陈亚明,杜玉兰,聂培,任怡静,贺婷,杜向宏,杨蓉,左宗辉,何宝祥
(广西大学动物科学技术学院,广西南宁 530001)
金黄色葡萄球菌、大肠杆菌和蜡样芽孢杆菌是引起奶牛乳房炎的三种常见致病菌,本研究根据金黄色葡萄球菌的nuc基因、大肠杆菌的16S-23SrRNA基因和蜡样芽孢杆菌的hblA基因,设计合成3对特异性引物,通过单纯PCR 和多重PCR体系和条件优化,建立奶牛乳房炎主要致病菌三重PCR检测方法,并对50 份临床乳房炎乳样分别用传统细菌学培养法和三重PCR方法进行对比检测。结果:建立的三重PCR 方法能对同一样品中的3种病原菌以及与沙门氏菌等其他6种细菌的DNA模板进行扩增,均无交叉反应。对金黄色葡萄球菌、大肠杆菌和蜡样芽孢杆菌的检测灵敏度分别为0.1pg/uL、0.01pg/uL、0.1pg/uL。该PCR方法对50份临床乳房炎乳样检测结果,表面该方法的检出率比传统培养法的高。
质奶牛; 乳房炎;PCR;诊断;致病菌
奶牛乳房炎是危害世界奶牛业的主要疾病之一,它不仅影响产奶量,而且影响牛奶品质,危害人类健康,造成奶牛场经济损失。病原微生物感染是引起奶牛乳房炎的主要原因,病原微生物很多,其中金黄色葡萄球菌、大肠杆菌和蜡样芽孢杆菌是导致奶牛乳房炎的3种重要致病菌[1-2]。传统的病原菌分离鉴定耗时较长,且方法繁琐,因此需要创建更加准确快速的检测方法,对奶牛乳房炎,尤其是隐性乳房炎的诊断与防治具有重要意义[3-5]。本实验通过多重PCR体系的建立,实现了同时对奶牛乳房炎3种重要致病菌的快速检测,为奶牛乳房炎的快速诊断提供参考。
1 材料
1.1 菌株
金黄色葡萄球菌标准菌株ATCC33591、大肠杆菌标准菌株ATCC44102、蜡样芽孢杆菌标准菌株ATCC14579 ,对照用的沙门氏菌、白色念珠菌,肺炎克雷伯氏菌、沙雷氏菌、绿脓杆菌、枯草芽孢杆菌购自杭州天和微生物试剂有限公司。
1.2 主要仪器
手提式压力蒸汽灭菌器购自上海博讯实业有限公司;超净工作台购自苏州净化设备厂;电热恒温培养箱购自上海精宏实验设备有限公司;光学显微镜购自Motic;电子天平购自岛津;微量移液枪购自Eppendorf;-80℃超低温冰箱购自海尔集团;离心机购自长沙湘仪离心机仪器有限公司。
1.3 主要试剂
普通营养琼脂培养基、麦康凯培养基、三糖铁琼脂培养基、细菌生化微量鉴定管购自杭州天和微生物试剂有限公司;金黄色葡萄球菌显色培养基购自法国科玛嘉微生物显色培养基公司;革兰氏染色液购自潍坊汉唐生物工程有限公司。
2 方法
2.1 细菌培养和模板制备
分别挑取金黄色葡萄球菌、大肠杆菌和蜡样芽孢杆菌三株标准菌单菌落接种于营养肉汤,37℃振荡过夜培养。取2mL菌液,12000 r/min离心10min,收集沉淀的细菌-20℃保存备用或抽提DNA用。
2.2 引物设计
根据金黄色葡萄球菌的nuc基因、蜡样芽孢杆菌的hblA 基因、大肠杆菌的16S-23SrRNA基因序列,利用Primer 510软件设计各细菌特异性PCR引物(表1)。

表 1 引物的核苷酸序列
2.3 单一PCR体系的优化
以金黄色葡萄球菌、大肠杆菌、蜡样芽孢杆菌三株标准菌DNA模板,分别进行PCR检测。经优化的反应体系为:2.5μL的10×PCR buffer,2μL的1.5mmol/ L MgCl2,0.5μL的10mmol/L dNTPs,各引物50μmol/L 0.5μL,0.5μL的Taq酶(5U),1μL模板,加ddH2O至25μL。扩增程序:95℃预变性4min;95℃变性1min,50℃退火1min,72℃延伸40s,35个循环;72℃终延伸10min。温育15℃90min。
2.4 多重PCR体系的建立及优化
多重PCR反应体系:2.5μL的10×PCR buffer、2μL的10mmol/LdNTPs、1.5μL的10mmol/ L MgCl2、0.5μL的Taq酶5U、DNA模板各1μL,加入50pmol/μL的金黄色葡萄球菌上、下游引物各0.1μL,50pmol/μL的大肠杆菌上、下游各0.3μL,50pmol/μL的蜡样芽孢杆菌上、下游引物各0.5μL,加ddH2O13.7μL至25μL;扩增程序:94℃预变性5min;94℃变性1min,56.8℃退火1min,72℃延伸40s,35个循环;72℃延伸7min。
2.5 特异性及灵敏性检测
2.5.1 特异性试验 将金黄色葡萄球菌、大肠杆菌及蜡样芽孢杆菌标准株和对照用的沙门氏菌、白色念珠菌、沙门氏菌、肺炎克雷伯氏菌、沙雷氏菌、绿脓杆菌DNA作为模板, 进行PCR扩增。
2.5.2 灵敏度试验 将已测定浓度的金黄色葡萄球菌、大肠杆菌、蜡样芽孢杆菌的模板DNA按100~10-5梯度进行稀释后分别混合,在优化的多重PCR体系下进行扩增,观察单一PCR和多重PCR扩增的灵敏度。
2.6 三重PCR临床检测
采用该试验所设计的多重PCR方法对50份患乳房炎的奶样进行检测。同时参照国标法对比,以验证建立的多重PCR检测方法的可行性与准确性。
2.7 琼脂糖电泳分析
用2.0% 琼脂糖凝胶电泳进行检测PCR产物,电泳时间40min,电压为100 V。然后用EB替代进行染色,观察并分析出现的特异性条带,保存结果。
3 结果与分析
3.1 PCR产物结果在Gen-Bank的BLAST中进行序列比对,各特异性基因片段序列与金黄色葡萄球菌同源性达100%,与大肠杆菌同源性为99%,与蜡样芽孢杆菌同源性为99%。
3.2 引物特异性检测 根据3种致病菌的特异性引物与其他对照菌株的DNA进行PCR扩增检测,结果显示金黄色葡萄球菌、大肠杆菌以及蜡样芽孢杆菌均可以扩增出特定大小的条带,其他对照菌株均呈阴性(图1)。
3.3 PCR 敏感性检测
将提取的DNA稀释为10ng/μL,以此浓度的DNA为模板,逐次10倍梯度稀释后进行单重PCR以及多重PCR敏感性实验,观察扩增敏感性(图2)。
3.4 奶样品检测
对送检的50份奶牛乳房炎奶样进行三重PCR检测,检测出阳性奶样16份,而细菌学检测方法检测出的阳性奶样为12份(表2)。三重PCR检测方法与细菌分离鉴定方法对金黄色葡萄球菌、大肠杆菌和蜡样芽孢杆菌的检出符合率均为92%(表3),且PCR方法检出率明显高于细菌学检测方法。
4 讨论
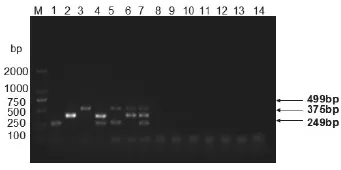
图1 引物特异性检测结果

图2 单重和多重PCR敏感性试验
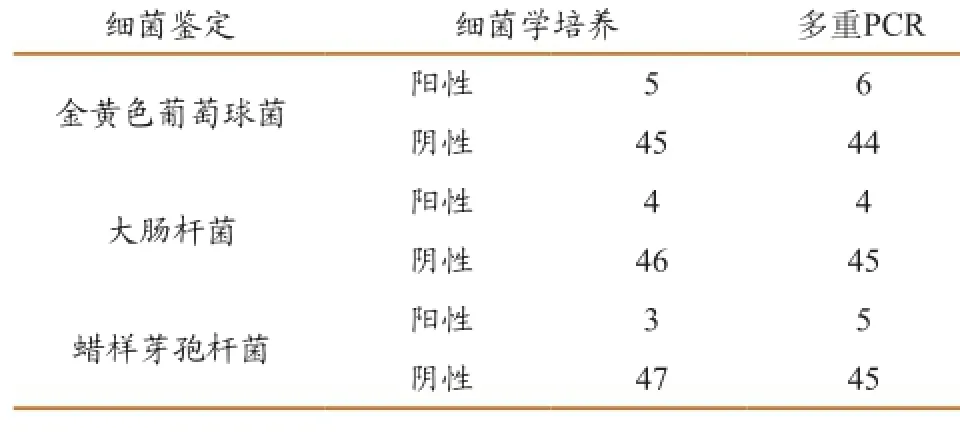
表 2 用培养法和多重PCR对临床样品的检测结果

表 3 三重PCR检测方法的敏感性和符合率
本实验建立了检测乳房炎3种主要病原的三重PCR检测技术,对临床乳样中的金黄色葡萄球菌、大肠杆菌、蜡样芽孢杆菌3种奶牛乳房炎主要致病菌进行了检测,结果表明3重PCR的特异性好,在被检的3种菌间以及与沙门氏菌、白色念珠菌、枯草芽孢杆菌、肺炎克雷伯氏菌、沙雷氏菌、绿脓杆菌之间均无交叉反应,特异性强。对临床样品的检测与传统的细菌分离鉴定相比较,明显缩短了检测时间,且检出率高[6-8]。
通过以上实验可知,金黄色葡萄球菌单重PCR扩增的敏感性可达0.1pg/μL(图2A)。大肠杆菌单重PCR扩增的敏感性可达0.01pg/μL(图2B)。蜡样芽孢杆菌单重PCR扩增的敏感性可达0.1pg/μL(图2C)。运用已优化的反应体系及程序进行三重PCR敏感性试验,结果表明三重PCR对金黄色葡萄球菌、大肠杆菌和蜡样芽孢杆菌的最低同时检出量为10pg/μL(图2D),说明了多重PCR的敏感性比单重PCR的敏感性低。这可能是由于多重PCR引物间相互作用或多对引物间形成了二聚体,影响了引物与模板DNA的有效结合,因而使得多重PCR扩增效率下降,敏感度降低。本实验结果也符合上述结论,即本实验中三重PCR敏感性〈二重PCR敏感性〈单重PCR敏感性,因此设计多重PCR反应体系,引物间的兼容性至关重要,引物-引物和引物-模板间相互作用会直接降低PCR反应的敏感度,因此寻求兼容性最好的引物对是提高多重PCR反应效率和监测敏感性的最中要的问题。
金黄色葡萄球菌、大肠杆菌、蜡样芽孢杆菌引起高产奶牛的乳房炎较多,临床兽医很难确诊其病原,应用本研究建立的三重PCR检测方法,可以进行临床诊断。此外,这3种病原引发的乳房炎,病初的症状不明显,常表现为隐性乳房炎[9-10],不易被人们发现,运用本实验所建立的3重PCR检测方法可以快捷准确检测出金黄色葡萄球菌、大肠杆菌、蜡样芽孢杆菌引起的早期奶牛隐性乳房炎,这对奶牛乳房炎早期进行监控具有临床意义[11-12]。
[1] 马保臣,秦卓明,蔡玉梅,等. 多重PCR检测奶牛乳腺炎金黄色葡萄球菌、无乳链球菌、停乳链球菌和酵母菌方法的建立与应用[J]. 畜牧兽医学报,2006(11):1202-1208.
[2] 王晓兰,孙庆华. 奶牛乳房炎病原菌的分离鉴定与药物敏感性试验[J]. 畜牧与兽医,2005(10):43-44.
[3] Dubuc J, Duffield T F, Leslie K E, et al. Effects of postpartum uterine diseases on milk production and culling in dairy cows[J]. J Dairy Sci, 2011, 94(3):1339-1346.
[4] Phuektes P, Mansell P D, Browning G F. Multiplex Polymerase Chain Reaction Assay for Simultaneous Detection of Staphylococcus aureus and Streptococcal Causes of Bovine Mastitis[J]. Journal of Dairy Science. 2001, 84(5):1140-1148.
[5] 马保臣,李建基,刘锡武. 奶牛急性乳腺炎病原菌的分离与鉴定研究[J]. 黑龙江畜牧兽医,2003(1):35-36.
[6] Bes M, Guerin-Faublee V, Meugnier H, et al. Improvement of the identification of staphylococci isolated from bovine mammary infections using molecular methods[J]. Vet Microbiol, 2000, 71(3/4):287-294.
[7] 谢志勤,谢芝勋,唐小飞,等. 多重PCR快速检测奶牛乳房炎3种主要病原体[J]. 畜牧与兽医, 2006(7):4-7.
[8] 郑浩. 南京地区奶牛乳房炎流行调查与病原分析及PCR检测[D]. 南京农业大学, 2004.
[9] Sun D B, Wu R, He X J, et al. Development of a Multiplex PCR for Diagnosis of Staphylococcus aureus, Escherichia coli and Bacillus cereus from Cows with Endometritis[J]. Agricultural Sciences in China[J]. 2011, 10 (10):1624-1629.
[10] 王建军,税 丽. 奶牛乳房炎致病机理研究进展[J]. 中国畜牧兽医,2009(12):100-103.
[11] Kao C C, Liu M F, Lin C F, et al. Antimicrobial susceptibility and multiplex PCR screening of AmpC genes from isolates of Enterobacter cloacae, Citrobacter freundii,and Serratia marcescens[J]. J Microbiol Immunol Infect. 2010,43(3):180-187.
[12] Taniuchi M, Verweij J J,Noor Z, et al. High throughput multiplex PCR and probe-based detection with Luminex beads for seven intestinal parasites[J]. Am J Trop Med Hyg. 2011, 84(2):332-337.
Development of a Triplex PCR Assay for Detection of Three Major Bovine Mastitis Pathogens
Chen Yaming,Du Yulan,Nie Pei,Ren Yijing,He Ting,Du Xianghong,Yang Rong,Zuo Zonghui,He Baoxiang
(College of Animal Science and Technology,Guangxi University,Nanning,Guangxi 530005)
Staphylococcus aureus,Escherichia coli and Bacillus cereus are three common pathogens dairy cow mastitis. Three pairs of specifc oligonucleotide primers were designed according to the DNA sequences of gene nuc in Staphylococcus aureus,gene 16S-23SrRNA in Escherichia coli and gene hb1A in Bacillus cereus,and a triplex polymerase chain reaction(PCR)assay was developed by improving the systems and procedures of three single PCRs and multiplex PCR. The triplex PCR and traditional bacterial cultivation were evaluated by examining 50 clinical mastitis milk samples. The result showed no cross reaction was detected by the triplex PCR among these 3 bacteria and the other common bacteria. The sensitivity of triplex PCR to Staphylococcus aureus,Escherichia coli and Bacillus cereus was 0.1pg/uL、0.01pg/uL and 0.1pg/ uL respectively. The results showed that mutiplex PCR was more sensitive than culture method.
Dairy cows;Mastitis;PCR;Diagnosis;Pathogens
S855.1
A 文章编号:1005-944X(2014)07-0082-04
教改项目“广西高等学校动物医学优势专业及课程一体化建设”(编号:GXTSZY141),国家自然科学基金(项目批准号:31260631)
何宝祥

