多聚左旋精氨酸对NCI-H292细胞炎症介质的调节
唐 伟,范晓云,陆兆双,霍龙
多聚左旋精氨酸对NCI-H292细胞炎症介质的调节
唐 伟,范晓云,陆兆双,霍龙
目的研究多聚左旋精氨酸(PLA)对NCI-H292细胞分泌白细胞介素(IL)-6、IL-8、IL-13、嗜酸性粒细胞趋化因子(Eotaxin)的影响。方法将NCI-H292细胞分为对照组(培养液)、脂多糖(LPS)组(5 μg/ml)、PLA组(Max=40 μg/ml)、LPS+PLA组、LPS+PLA+肝素组。采用ELISA法检测各组IL-6、IL-8、IL-13、Eotaxin的水平,并比较各组间的差异。结果LPS+PLA组IL-6、IL-8、Eotaxin的水平明显高于对照组、LPS组、PLA组(P<0.05),而LPS组、PLA组与对照组比较,IL-6、IL-8、Eotaxin的水平差异无统计学意义(P>0.05);各组IL-13的水平差异无统计学意义(P>0.05);而肝素能够降低LPS+PLA组IL-6、IL-8、Eotaxin的水平(P<0.05)。结论PLA促进LPS诱导NCI-H292细胞IL-6、IL-8、Eotaxin的表达,但肝素可抑制其表达;而PLA对IL-13的表达没有影响。
哮喘;多聚左旋精氨酸;白细胞介素-6;白细胞介素-8;白细胞介素-13;嗜酸性粒细胞趋化因子;肝素
支气管哮喘是一种以多种炎性细胞浸润及气道高反应为特征的可逆性气道阻塞性疾病[1],其中嗜酸性粒细胞(eosinophil,Eos)在气道黏膜的浸润是以哮喘为主要特征。在患者支气管活检组织、肺泡灌洗液和外周血中均发现活化的Eos,其活化后释放的颗粒主要是嗜酸性粒细胞阳离子蛋白(eosinophil cationic protein,ECP),而在支气管哮喘气道高反应性(airwayhyperresponsiveness,AHR)的病理过程中,上皮细胞起着重要作用。ECP通过改变上皮细胞功能或直接细胞毒作用而影响气道上皮细胞,释放多种细胞因子如:白细胞介素(interleukin,IL)-6、IL-8、IL-13、嗜酸性粒细胞趋化因子(Eotaxin)等参与AHR。作为ECP的类似物,多聚左旋精氨酸(poly-L-arginine,PLA)具有与ECP相似的生物学活性。该实验旨在通过气道上皮细胞来研究PLA在气道炎症反应中的作用以及肝素对其影响。
1 材料与方法
1.1 细胞来源上皮细胞系NCI-H292是一种人肺腺癌细胞系,属于肺泡Ⅱ型上皮细胞,单层贴壁生长,购自美国ATCC公司。
1.2 主要试剂脂多糖(lipopolysaccharide,LPS)、PLA均购自美国Sigma公司;肝素购自江苏万邦生化医药公司;胎牛血清、RPMI 1640购自美国Gibco公司;ELISA(IL-6、IL-8、IL-13、Eotaxin)试剂盒购自上海森雄公司。
1.3 细胞培养NCI-H292细胞在常规培养基(RPMI 1640+10%胎牛血清+100 U/ml青霉素+100 μg/ml链霉素)中培养[2],37℃含5%CO2培养箱中孵育,当细胞长至70%~80%时开始传代,每周传代2次,用于后续试验。
1.4 ELISA法检测细胞因子IL-6、IL-8、Eotaxin、IL-13的表达准备一定量的NCI-H292细胞过夜,在加入刺激物之前,用不含血清的RPMI 1640再洗1次,以去除内源性细胞因子和排除血清的影响[3],以不加任何刺激物的细胞作为阴性对照,依照试验设计加入LPS(5 μg/ml)、PLA(Max=40 μg/ml)、肝素(100 U/ml),37℃孵育20h后,收集上清液,采用ELISA法分别检测各组IL-6、IL-8、Eotaxin、IL-13的水平。
1.5 统计学处理采用SPSS 16.0统计软件分析,数据以±s表示。多组间比较采用单因素方差分析(one-way ANOVA);两两比较方差齐时采用LSD检验,方差不齐时采用Dunnett’s T3检验。
2 结果
2.1 PLA在LPS刺激后增加IL-6、IL-8的释放一定浓度的PLA(5~20 μg/ml)明显促进LPS诱导的NCI-H292细胞IL-6、IL-8的水平(P<0.01);与对照组比较,LPS组、PLA组IL-6、IL-8的水平差异无统计学意义(P>0.05),且在PLA为5 μg/ml时IL-6、IL-8的水平最高,但差异无统计学意义(P>0.05)。见图1。

图1 PLA与LPS联合刺激NCI-H292细胞其IL-6、IL-8的水平
2.2 PLA在LPS刺激后增加Eotaxin的释放一定浓度的PLA(5~40 μg/ml)明显促进LPS诱导的NCI-H292细胞Eotaxin的水平(P<0.01,P<0.05);与对照组比较,LPS组、PLA组Eotaxin的水平差异无统计学意义(P>0.05),且在PLA=20 μg/ml时Eotaxin的水平最高,但差异无统计学意义(P>0.05)。见图2。
2.3 PLA在LPS刺激后对IL-13的水平无影响不论有无LPS刺激,不论PLA浓度多大,各组IL-13的水平差异无统计学意义(P>0.05)。见图3。
2.4 肝素降低PLA与LPS联合刺激下IL-6、IL-8、Eotaxin的水平当LPS、PLA均为5 μg/ml时,IL-6、IL-8的表达水平出现高峰,一定浓度的肝素(100 U/ml)降低LPS(5 μg/ml)+PLA(5 μg/ml)组IL-6、IL-8水平(P<0.01),而Eotaxin的表达在PLA=20 μg/ml时出现高峰,100 U/ml的肝素降低LPS(5 μg/ml)+PLA(20 μg/ml)组Eotaxin水平(P<0.05)。见图4。
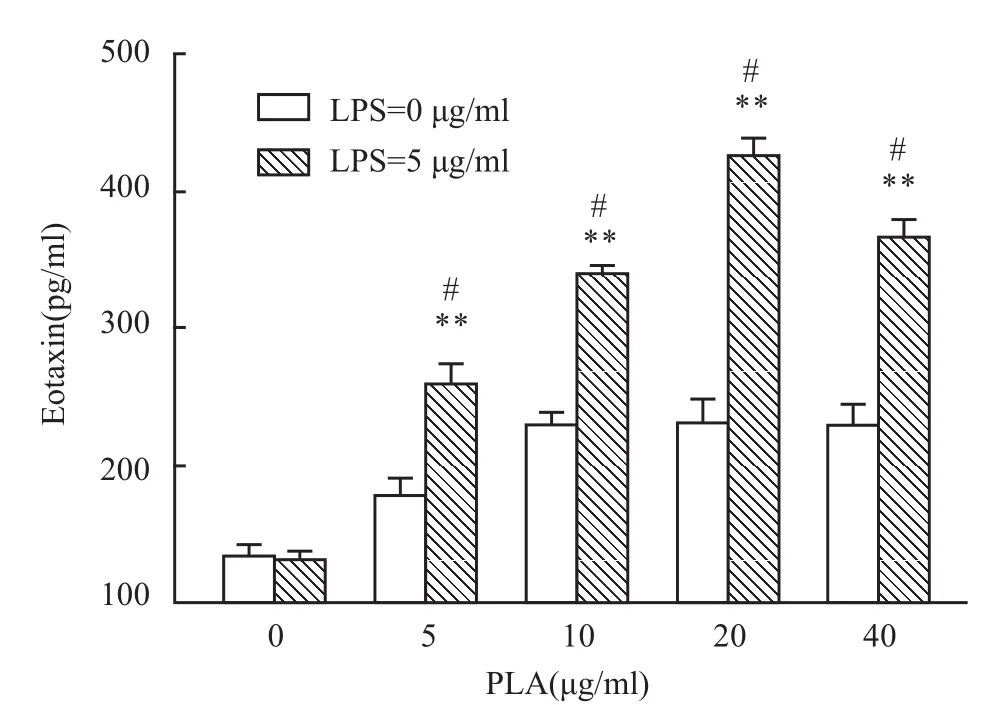
图2 PLA与LPS联合作用NCI-H292细胞其Eotaxin的水平
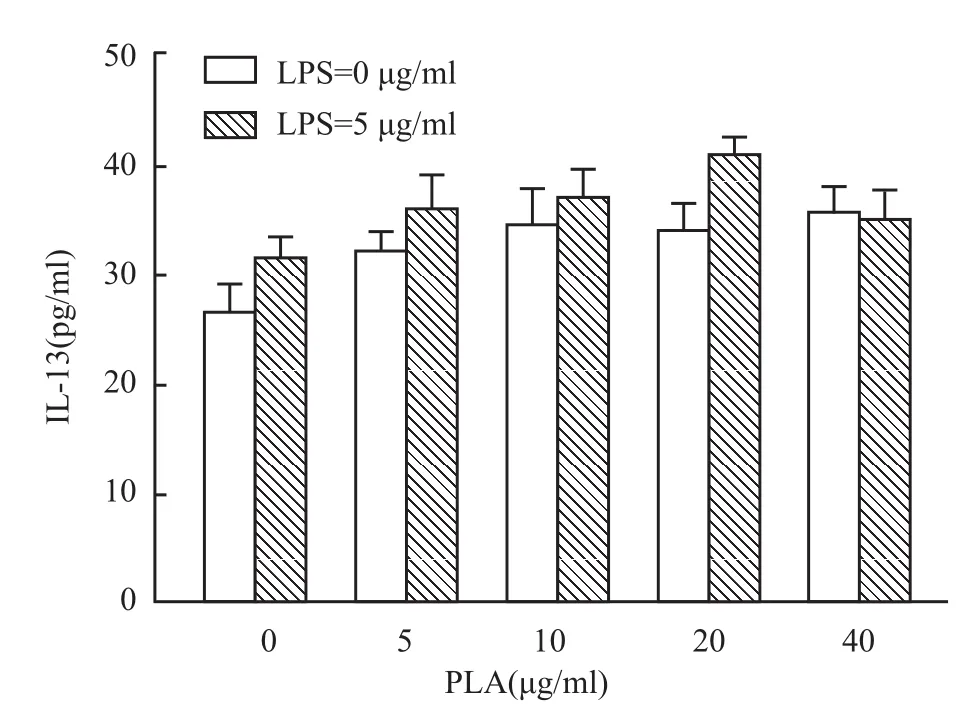
图3 PLA与LPS联合作用NCI-H292细胞其IL-13的水平
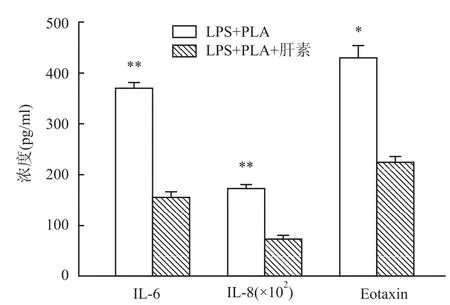
图4 肝素降低PLA与LPS共同作用NCI-H292细胞IL6、IL-8、Eotaxin的水平
3 讨论
支气管哮喘是一种由多种细胞及细胞因子参与的慢性气道炎症,其发生过程是气道炎症、AHR、气道重构三联征;其发病及演变主要受控于Th2型细胞因子[4]。病理检查显示有大量炎症细胞的浸润,在此过程中,一些细胞因子起重要的促进作用,如IL-6、IL-8、IL-13、Eotaxin等促进炎症细胞的聚集、活化和炎症介质的释放。在正常的情况下,其表达及分泌受机体严格调控,但在病理情况下会出现异常表达,如细胞因子表达过高,从而引起炎症、自身免疫性疾病、超敏反应等。
IL-6是一种多活性、调节急性相反应和炎症的重要因子,主要参与哮喘的急性发作;在血清及肺泡灌洗液中均可发现IL-6水平明显升高,IL-6可反映气道炎症情况,作为支气管哮喘急性发作的指标之一。IL-8又称中性粒细胞趋化因子,能够选择性趋化中性粒细胞进入气道,并诱导和增强中性粒细胞脱颗粒和杀菌作用,同时吸引Eos、淋巴细胞向炎症部位聚集,并促使其释放ECP等炎症介质,参与气道炎症及AHR形成。该研究显示:哮喘大鼠血清、肺泡灌洗液中IL-8水平明显升高;用外源性抗IL-8抗体中和IL-8能抑制中性粒细胞的聚集及其介导的组织损伤。IL-13是Th2类细胞因子,主要通过STAT6信号途径调控基因表达引起AHR[5];但对缺乏IL-13的小鼠,IL-13对诱导AHR是必须的,同时引入外源性IL-13可直接激活引起AHR的途径,可不需要Eos及IL-4的表达。
Eotaxin是近年发现的趋化因子,主要来源于气道上皮细胞,在参与哮喘发生的众多趋化因子中,唯有Eotaxin对Eos具有特异性趋化活性,主要促进Eos在肺内募集并使其活化,从而引起组织损伤。研究[6]显示,在大鼠血清、肺泡灌洗液及肺组织中均发现Eotaxin呈高表达,在典型哮喘及咳嗽变异性哮喘患者血清中Eotaxin的浓度明显升高,且与Eos计数呈正相关[7]。
本实验研究显示,在LPS的诱导下,一定浓度的PLA显著升高NCI-H292细胞IL-6、IL-8、Eotaxin的水平,并且IL-6、IL-8在PLA为5 μg/ml时出现高峰;而Eotaxin水平在PLA 0~40 μg/ml之间逐渐升高,在PLA为20 μg/ml时出现高峰,可能与PLA联合LPS诱导NCI-H292细胞释放细胞因子的机制不同有关。推测PLA可促进IL-6、IL-8、Eotaxin表达,从而趋化中性粒细胞、Eos、淋巴细胞等向气道聚集,引起气道炎症反应;但IL-13的水平在LPS与PLA联合作用下未见明显变化,推测IL-13可能不通过Eos发挥作用,可能直接作用于气道上皮细胞或通过其他信号通路等引起AHR。
肝素作为最有效的抗凝剂之一,在体内外均能延缓或阻止血液凝固;肝素已用于治疗支气管哮喘,特别是难治性哮喘,其治疗作用是改善血流动力学从而改善肺循环[8];肝素具有阴离子电荷及黏多糖结构;而内源性肝素能够抑制Eos向炎性区域聚集,并且使阳离子蛋白引起的组织损伤减轻。在本实验中,肝素能够抑制PLA在LPS诱导下IL-6、IL-8、Eotaxin释放,肝素可能中和PLA对细胞的毒性作用,抑制PLA对细胞因子的表达。
综上所述,PLA能够显著促进炎症介质IL-6、IL-8、Eotaxin的释放,引起或加重气道炎症反应,从而引起哮喘发作;而肝素能够拮抗PLA的作用。随着对支气管哮喘研究的不断深入,信号传导对各种细胞因子、炎症介质的调节已成为热点研究之一[9],而阻断这些炎症介质引起哮喘发作的信号通路为哮喘的治疗提供了更广阔的思路。
[1] 齐胤良,桂淑玉,王勇生,等.哮喘大鼠模型支气管肺组织骨桥蛋白表达的变化及其调控机制的初探[J].安徽医科大学学报,2010,45(1):9-12.
[2] Fan X Y,van den Berg A,Snoek M,et al.Arginine deficiency augments inflammatory mediator production by airway epithelial cells in vitro[J].Respir Res,2009,10:62.
[3] Rhee C K,Kang C M,You M B,et al.Effect of fudosteine on mucin production[J].Eur Respir J,2008,32(5):1195-202.
[4] Goetzl E J.Changing paradigms in the immunological science of allergy[J].Curr Allergy Asthma Rep,2008,8(1):28-31.
[5] 辛 琪,李浩嫙.IL-13与气道高反应的作用机制及研究进展[J].中国医药指南,2012,10(17):88-9.
[6] 汪 浩,武晓兰,范晓云,等.IL-8和Eotaxin在哮喘大鼠中的表达及地塞米松的作用[J].安徽医科大学学报,2012,47(3):270-3.
[7] 武晓兰,唐 伟,范晓云,等.咳嗽变异性哮喘患者Eotaxin的表达及其与肺功能的关系[J].实用医学杂志,2013,29(2):199-201.
[8] 李 峰,于 颖,张立红.肝素钙综合治疗婴幼儿哮喘的疗效及机制[J].第四军医大学学报,2008,29(14):1301-12.
[9] Botero T M,Son J S,Vodopyanov D,et al.MAPK signal is required for LPS-induced VEGF in pulp stem cells[J].J Dent Res,2010,89(3):264-9.
Poly-L-arginine regulate inflammatory mediator production by airway epithelial cells NCI-H292 in vitro
Tang Wei,Fan Xiaoyun,Lu Zhaoshuang,et al
(Dept of Geriatric Pulmonology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
ObjectiveTo study the effect of interleukin(IL)-6,IL-8,IL-13,Eotaxin epithelial cells NCI-H292 by poly-L-arginine(PLA).MethodsNCI-H292 cells were divided into control group(culture solution),lipopolysaccharide(LPS)group(5 μg/ml),PLA group(Max=40 μg/ml),LPS+PLA group and LPS+PLA+heparin group.The expressions of IL-6,IL-8,IL-13 and Eotaxin were determined by ELISA,and compared the differences among the groups.ResultsIL-6,IL-8 and Eotaxin levels in LPS+PLA group were significantlyhigher than other groups(P<0.05);but there was no statistical significance among LPS group,PLA group and the control group(P>0.05);and also no statistical significance on IL-13 among each group(P>0.05);butheparin could reduce the levels of cytokines in LPS+PLA group(P<0.05).ConclusionPLA can increase the expression of IL-6,IL-8,Eotaxin in NCI-H292 cells association with LPS,butheparin can inhibit the expression of cytokines;and therehas no effect on IL-13.
asthma;poly-L-arginine;interleukin-6;interleukin-8;interleukin-13;Eotaxin;heparin
R 256.12
A
1000-1492(2014)04-0427-04
2013-12-12接收
国家自然科学基金青年科学基金(编号:81100027);安徽省高校省级自然科学研究项目(编号:KJ2011A176);安徽医科大学第一附属医院博士启动基金;安徽省人社厅第九批学术和技术带头人及后备人选学术科研活动资助
安徽医科大学第一附属医院老年呼吸内科,合肥 230022
唐 伟,女,硕士研究生;范晓云,女,副教授,副主任医师,硕士生导师,责任作者,E-mail:smallcloud2@126.com

