二倍体马铃薯试管苗的培养及对叶肉原生质体融合的影响
李凤云,蔡兴奎,盛万民,王立春,田国奎,娄树宝,徐洪岩,王海艳,姜俊凤
(1.黑龙江省农业科学院克山分院,黑龙江克山161606;2.华中农业大学园艺林学学院,湖北武汉430070;
3.黑龙江省农业科学院作物育种研究所,黑龙江哈尔滨150086)
遗传育种
二倍体马铃薯试管苗的培养及对叶肉原生质体融合的影响
李凤云1*,蔡兴奎2,盛万民3,王立春1,田国奎1,娄树宝1,徐洪岩1,王海艳1,姜俊凤1
(1.黑龙江省农业科学院克山分院,黑龙江克山161606;2.华中农业大学园艺林学学院,湖北武汉430070;
3.黑龙江省农业科学院作物育种研究所,黑龙江哈尔滨150086)
以35份二倍体马铃薯试管苗为试验材料,对二倍体马铃薯试管苗培养的影响因素进行研究,目的是使试管苗的叶片增大,叶面积增加,并有利于进行叶肉原生质体的融合。结果表明:含有AgNO3的培养基(MS +0.5 mg∕L NAA+1 mg∕L AgNO3)适合22份供试二倍体马铃薯试管苗的培养;添加AgNO3比不添加AgNO3的试管苗的叶片明显增大,叶面积显著增加,添加2%蔗糖和2 mg∕L AgNO3的培养基的试管苗叶面积最大;以二倍体野生种S.chacoense和二倍体材料DY4-5-10为亲本进行电融合,以添加2%蔗糖和1 mg∕L AgNO3的培养基培养其试管苗,获得的融合产物可再生出完整植株,该培养基适合用于分离原生质体的二倍体马铃薯试管苗的培养。
二倍体马铃薯;AgNO3;叶肉原生质体融合
二倍体马铃薯野生种、栽培种含有抗病虫害、霜冻、干旱和病毒的基因,同时,由普通四倍体栽培种经花药培养诱导出的双单倍体品系具有早熟、高产和高淀粉等优良农艺性状,它们均是重要的马铃薯育种材料。但在常规育种应用方面存在一定困难。利用原生质体培养及细胞融合将野生种资源及双单倍体所具有的优良性状引入栽培种,并定向聚合有益基因是现代育种的重要途径之一,但该技术受基因型的影响较大,能够再生的基因型有限。
研究发现,供体的生理状态对原生质体培养很重要,Shepard[1]建议用于分离原生质体的马铃薯植株必须生长在光、温、湿可控的条件下,否则无论采用何种培养基原生质体也不能进行分裂。而试管苗取材容易,不受季节限制,本身无菌,叶肉组织比较疏松,酶液容易起作用,获得原生质体在生理和遗传特性上也比较一致,因此无菌试管苗叶片是分离马铃薯原生质体最常用的供体材料[2-5]。但不同培养基对试管苗的影响也存在很大差异,何亚文等[6]报道了马铃薯野生种试管苗在MS培养基上普遍生长不好,主要表现为无菌苗生长快、茎段细、节间长,叶片小而稀,发根能力特弱,生长缓慢等。Perl等[7]认为产生这种现象的根本原因是培养器皿中乙烯的积累。硝酸银(AgNO3)作为乙烯生理作用拮抗剂,常被用来抑制乙烯的生理作用[8-11],被应用于马铃薯试管苗长期保存和原生质体供体材料培养上[12-14]。
本文旨在通过对二倍体马铃薯试管苗培养的影响因素进行研究,包括植物生长调节剂、硝酸银和蔗糖对供体试管苗生长的影响,目的是筛选适合二倍体马铃薯试管苗扩繁的培养基,使试管苗的叶面积增加,并有利于进行叶肉原生质体的融合,为更多地筛选出能够再生的基因型奠定基础。
1 材料与方法
1.1 供试材料
以35份二倍体马铃薯试管苗为试验材料,详见表1。
1.2 试验方法
1.2.1 植物生长调节剂对二倍体马铃薯试管苗生长的影响
以35份二倍体马铃薯试管苗为试验材料,各培养基成分见表2。
以MS培养基为对照(CK),试管苗采用单茎段繁殖,培养基中还需加入20 g∕L蔗糖和0.7%琼脂,pH 5.8。培养条件为:每天光照16 h,光照强度3 000~4 000 lx,温度(20±1)℃,相对湿度60%,培养3周。
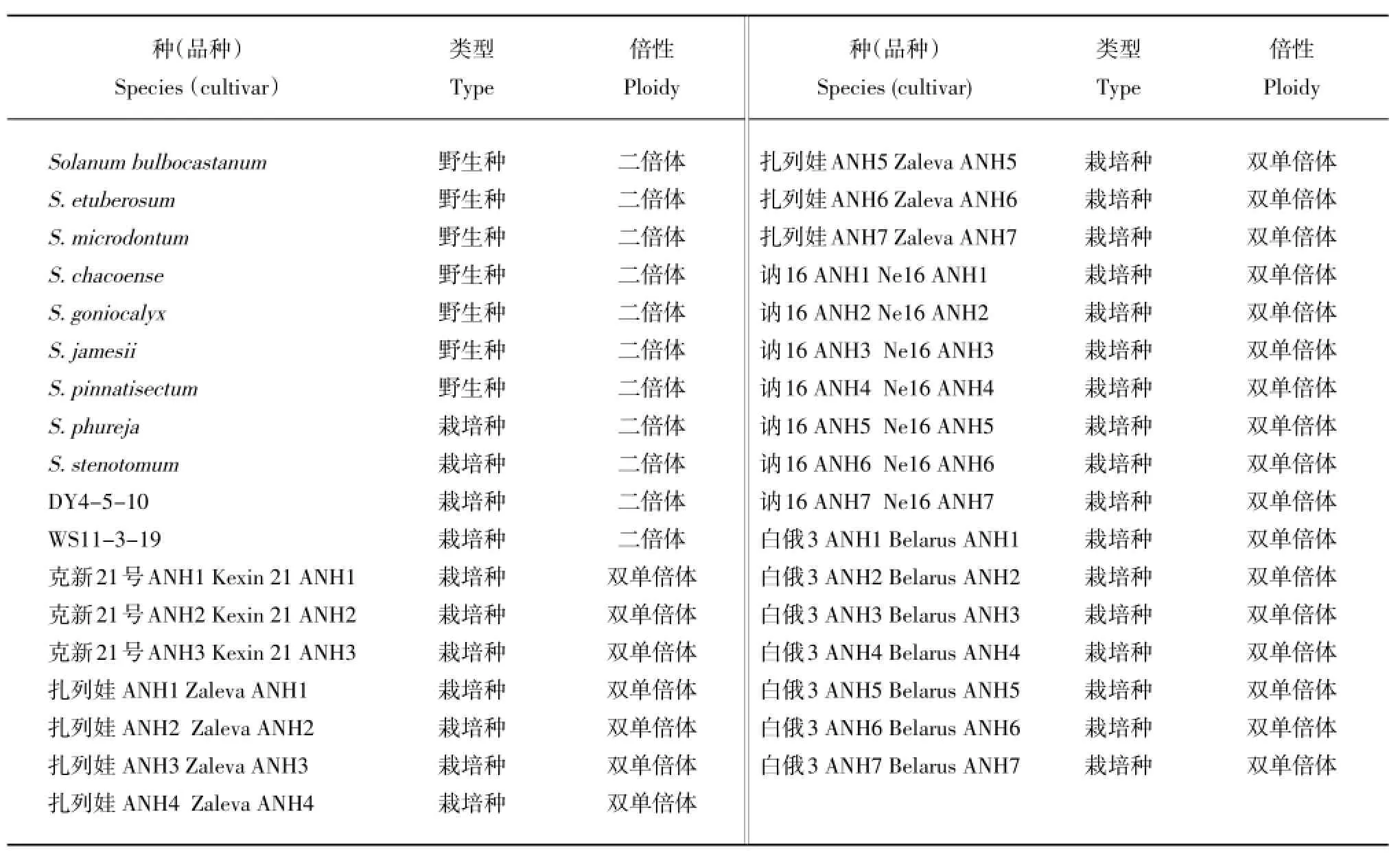
表1 供试材料Table 1Experimental materials used
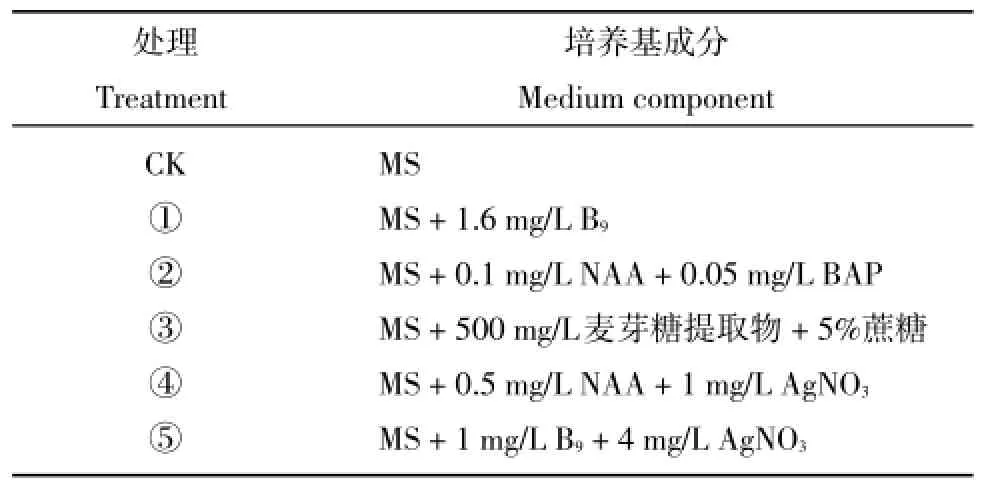
表2 培养基的组成Table 2Medium component of various treatments
1.2.2 AgNO3对二倍体马铃薯试管苗生长的影响
以S.chacoense和二倍体材料DY4-5-10的试管苗为试验材料,单茎段分别接种在MS附加1,2,3和4 mg∕L AgNO3,以及20 g∕L蔗糖的固体培养基上繁殖,以不加AgNO3为对照,每处理6瓶,每瓶接种10个茎段,重复6次。
1.2.3 蔗糖和AgNO3对二倍体马铃薯试管苗的叶面积的影响
以S.chacoense的试管苗为试验材料,单茎段接种在MS分别附加1%、2%、3%、4%蔗糖和1,2,3和4 mg∕L AgNO3,以及MS+0.5 mg∕L NAA+1 mg∕L AgNO3的固体培养基上繁殖,每处理6瓶,每瓶接种10个茎段,重复6次。
1.2.4 AgNO3对叶肉原生质体融合的影响
生态文明建设是为了缓解人口与资源环境之间的矛盾,尤其是要改变人类社会发展进程中所带来的资源枯竭、环境污染破坏、生态失衡等现状,最终实现人与自然的和谐共生。
以二倍体材料DY4-5-10和S.chacoense的试管苗为试验材料,单茎段接种在MS分别附加1,2,和4 mg∕L AgNO3,并附加2%蔗糖的固体培养基上繁殖,以不加AgNO3为对照,试验重复3次。培养3周时取试管苗上部充分展开的3~4个叶片进行酶解,原生质体的分离和纯化参照周宇波等[15]报道的方法,测定原生质体产量和活力,电融合方法及参数参照田国奎等[16]报道的方法,融合产物的培养参照蔡兴奎等[17,18]报道的方法,统计植板率、愈伤数量和再生植株数量。
1.3 数据统计和分析
茎高、单株鲜重和叶片数的测定:按常规方法测定。
叶面积的测定:利用数字图像法测定试管苗叶面积,参照袁华玲[19]的方法。
茎高、单株鲜重、叶片数和叶面积的试验数据采用DPS统计软件和EXCEL 2007进行处理分析。
原生质体产量的测定:用血球计数板测定原生质体产量,依次逐个计数中央大方格内25个中方格里的原生质体。然后根据下式求出1 mL中的原生质体数,1 mL悬浮液中的原生质体数=1个大方格悬浮液中的原生质体数×10×1000。
原生质体活力的测定采用0.1%伊文思蓝染色法。
原生质体活力(%)=(未染色的原生质体数∕观察到的原生质体总数)×100
原生质体植板率(%)=培养10 d时形成的细胞克隆数∕培养的原生质体总数×100
2 结果与分析
2.1 植物生长调节剂对二倍体马铃薯试管苗生长的影响
以35份二倍体马铃薯试管苗为试验材料进行试验,各处理最适合材料份数差别很大,④号培养基适合大多数二倍体马铃薯试管苗的培养(表3)。以4份试验材料为例,如图1,S.jamesii的试管苗在④号培养基上苗壮且高,叶片大且叶色浓绿;‘白俄3 ANH3’的试管苗适于在③号培养基上生长,苗较高且叶色绿,而在④号培养基上叶片虽大,但黄化;‘讷16 ANH1’的试管苗在①和③培养基上均长满瓶,苗高但叶片小,而在④号培养基上苗虽矮但叶片大且绿;S.bulbocastanum的试管苗在①~④号培养基上长势均好,最好的是④号培养基,叶片大而浓绿。而S.etuberosum和‘克新21号ANH2’在6种培养基上均长势不好,还需用其它的培养基培养。有5份材料在MS上长势良好,添加植物生长调节剂后反而有不良影响。总之,①~③号培养基适于切段扩繁,④号培养基适于增大叶面积。
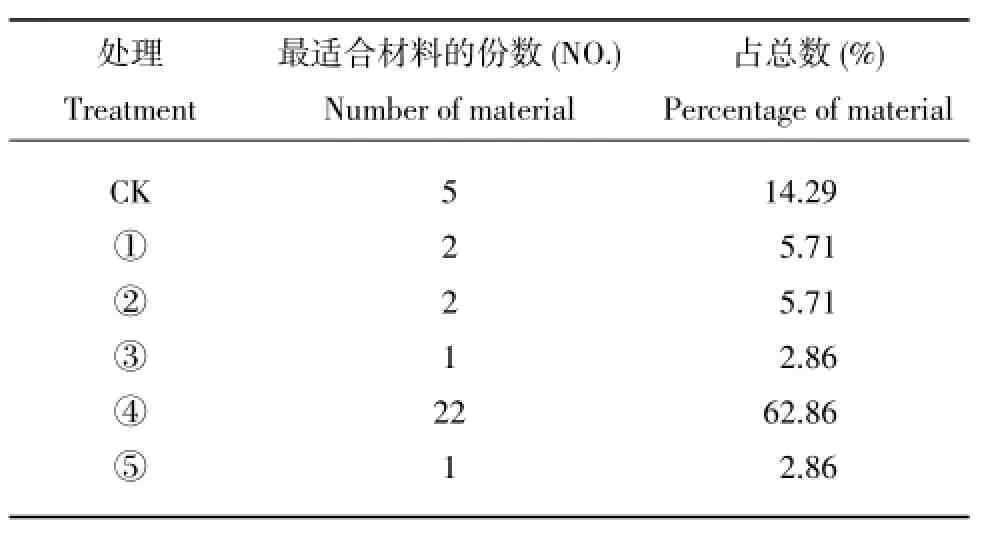
表3 不同处理培养基适合材料的份数Table 3Number of materials suitable in various media

图1 二倍体马铃薯试管苗在不同处理培养基上的生长状况Figure 1Growth of diploid potato plantlets in vitro in various media

图2 5份试验材料在MS培养基上的叶片(CK)和各处理的叶片的比较Figure 2Comparison of treatment media with control medium for leaves of five materials
图2是5份试验材料在MS培养基上的叶片和各处理中最大的叶片的比较,各处理的叶片明显大于MS(CK),可能是AgNO3起作用的结果。⑤号培养基可能浓度过大而使试管苗矮化,仅有‘扎列娃ANH6’适合。
2.2 AgNO3对二倍体马铃薯试管苗生长的影响
以二倍体材料DY4-5-10的试管苗为试验材料进行试验,可以看出,2个材料试管苗苗长都以CK的苗长最长,添加AgNO3有使苗长下降的趋势;叶片数以S.chacoense的CK最多;培养基中附加AgNO3也促进试管苗单株鲜重的增加,单株鲜重以2 mg∕L AgNO3最重;培养3周后2个材料间的叶片大小差异很大,S.chacoense的叶片明显大于DY4-5-10,培养基中附加1 mg∕L AgNO3对试管苗叶面积的促进作用非常明显,但2个材料均以添加2 mg∕L AgNO3的叶面积最大,而AgNO3在2~4 mg∕L浓度范围内对叶面积的影响差距不大(表4)。附加4 mg∕L AgNO3使试管苗有的叶片形成愈伤,有的叶片黄化(图3)。
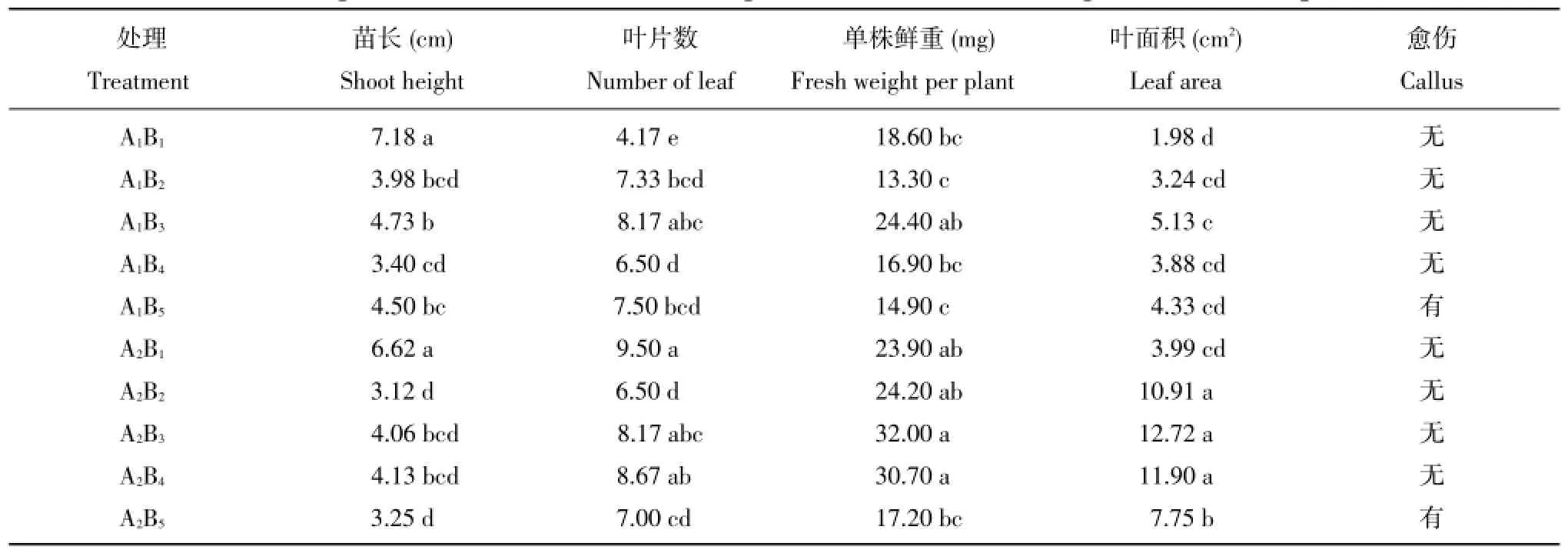
表4 AgNO3对二倍体马铃薯试管苗生长的影响Table 4Effects of AgNO3concentration on shoot height,leaf number,fresh weight and callus of plantletsin vitro

图3 ‘DY4-5-10’叶片上的愈伤和黄化Figure 3Callus and fading on leaf of‘DY4-5-10’
2.3 蔗糖和AgNO3对二倍体马铃薯试管苗的叶面积的影响
以S.chacoense的试管苗为试验材料进行试验,结果见表5,培养基中不加AgNO3时,试管苗叶面积随着蔗糖浓度的提高而提高,培养基中加AgNO3时,试管苗叶面积随着蔗糖浓度的提高先升后降,2%蔗糖浓度下试管苗叶面积最大。试管苗叶面积随着AgNO3浓度的增加先升后降,AgNO3浓度对的叶面积的影响达显著水平。2%蔗糖附加2 mg∕L AgNO3的处理叶面积最大,4%蔗糖附加1 mg∕L AgNO3叶面积最小,但都明显比不加AgNO3时的叶面积大。图4为2%蔗糖附加0~3 mg∕L AgNO3的试管苗的照片,下部分为该试管苗的俯视照片,可以看出2%蔗糖附加2 mg∕L AgNO3的试管苗叶面积最大,2%蔗糖附加1 mg∕L AgNO3的试管苗顶部有3~4个大叶片,可选为叶肉原生质体的供体叶片。
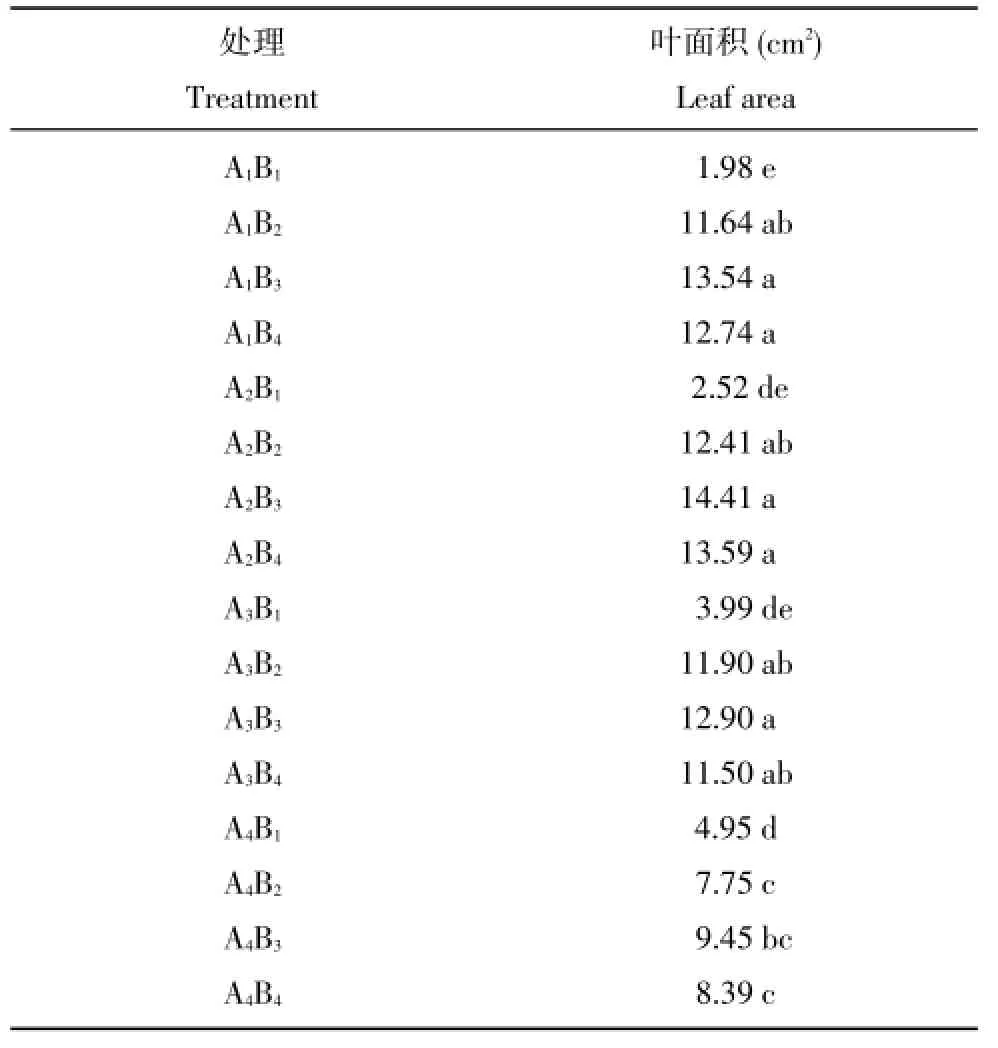
表5 蔗糖和AgNO3对叶面积的影响Table 5Effect of medium added with AgNO3and sucrose on leaf area
2.4 AgNO3对叶肉原生质体融合的影响

图4 2%蔗糖和0~3 mg/L AgNO3对试管苗生长的影响Figure 4Effect of 2%sucrose and 0~3 mg/L AgNO3on growth of plantlets in vitro
以二倍体材料DY4-5-10和S.chacoense的试管苗为试验材料进行试验,随着AgNO3浓度的升高,植株生长越健壮,叶片明显增大、叶肉肥厚、叶色浓绿、节间明显缩短,表现为旺盛生长,因此,单位株数的叶片重量明显高于对照处理,导致这两个材料每克鲜重叶片的原生质体产量显著低于对照叶片(表6),但叶肉原生质体的活力并没有显著差异。而不同处理的原生质体在进一步培养时却表现出差异,附加1 mg∕L AgNO3的处理有利于原生质体的初期培养和启动分裂,融合细胞的初次分裂时间较对照处理提前约24 h,培养10 d时统计的细胞植板率也显著高于其它处理,为36.6%。当AgNO3浓度升高到2~4 mg∕L时,融合细胞却失去分裂再生能力,很快就褐化死亡,导致第10 d时统计的细胞植板率为0。2%的蔗糖和1 mg∕L AgNO3处理获得的融合产物,在选择的263块愈伤组织中有35块分化成再生植株,分化频率为13.3%。
图5为分化出苗的愈伤和再生植株的照片。因此,添加2%的蔗糖和1 mg∕L AgNO3的培养基适于用于分离原生质体的二倍体马铃薯试管苗的培养,并有利于叶肉原生质体融合和培养。

图5 分化出苗的愈伤和再生植株Figure 5Callus and regenerated plants
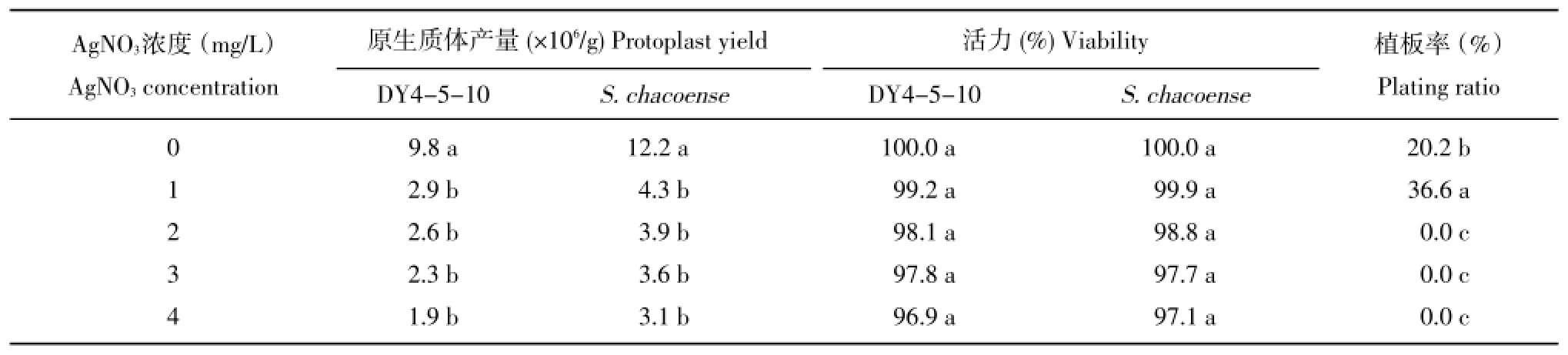
表6 AgNO3对叶肉原生质体产量、质量及融合产物的影响Table 6Effects of AgNO3concentration on yield and quality of isolated protoplast from plantletsin vitroand electrofusion products
3 讨论
本试验所用的二倍体马铃薯试管苗在MS培养基上多数长势不良,与何亚文等[6]报道的相同。用于原生质体分离的培养基常添加NAA、6-BA、B9、麦芽糖提取物和AgNO3等[4,6,11,12],参考这些报道本试验设计5种培养基,结果表明,④号培养基(MS+0.5 mg∕L NAA+1 mg∕L AgNO3)适合大多数二倍体马铃薯试管苗的培养,试管苗叶片增大,浓绿脆嫩,是叶肉原生质体分离的理想材料,这与何亚文等[6]和蔡兴奎[3]报道的相同。但有两个材料在5种培养基上长势均不好,培养基还需改进。
本试验结果表明,添加2%蔗糖和2 mg∕L AgNO3的培养基的试管苗叶面积最大,而添加2%的蔗糖和1 mg∕L AgNO3的培养基适于用于分离原生质体的二倍体马铃薯试管苗的培养,这与蔡兴奎[3]和袁华玲[19]报道的相似,但何亚文等[6]报道S.phureja在MS附加0.l mg∕L NAA和4 mg∕L AgNO3的培养基上繁殖长叶,经原生质体培养获得再生植株,这与本试验的结果不同。因此,培养基中附加AgNO3的合适浓度可能与试管苗的基因型、生长条件和培养物生理状态密切相关[11]。对于试验中的其它材料尤其是双单倍体材料的原生质体融合及培养正在进行,期望能获得新的再生基因型,应用于育种实践。
[1]Shepard J F.Mutant selection and plant regeneration from potato mesophyll protoplasts[M]∕∕Rubenstein l,Gengenbach B,Phillips R L,et al.Genetic improvement of crops.Minneapolis:Universityof Minnsota Press,1980,185-219.
[2]李浚明.植物组织培养教程[M].北京:北京农业大学出版社,1992.
[3]蔡兴奎.原生质体融合创造抗青枯病的马铃薯新种质及其遗传分析[D].武汉:华中农业大学,2003.
[4]李耿光,张兰英.马铃薯叶肉原生质体再生植株的研究[J].植物学报,1988,30(1):21-24.
[5]Austin S,Baer M A,Helgenson J P.Transfer of resistance to potato leaf roll virus from Solanum brevidens into Solanum tuberosum by somatic fusion[J].Plant Science,1985,39:75-82.
[6]何亚文,李耿光,张兰英.马铃薯野生种叶肉原生质体培养及其植株再生[J].热带亚热带植物学报,1996,4(3):72-74.
[7]Perl A,Aviv D,Galun E.Ethylene and in vitro culture of potato: Suppression of ethylene generation vastly improved protoplast yield,plating efficiency and transient expression of an alien gene[J]. Plant Cell Rep,1988,7:403-406.
[8]应振土,陈昆松.乙烯掊抗剂一硫代硫酸银的生理作用[J].植物生理学通讯,1990,1:63-64.
[9]张鹏,傅爱根,王爱国.AgNO3在植物离体培养中的作用及可能的机制[J].植物生理学通讯,1997,33(5):376-379.
[10]王文星,屈山,曹成有,等.硝酸银对离体培养的烟草叶片愈伤组织形成和芽再生及其脯氨酸和丙二醛含量的影响[J].植物生理学通讯,2006,42:668-669.
[11]Sarkar D,Sud K C,Chzkrabarti S K,et al.Growing of potato microplants in the presence of alginate-silver thiosulfate capsules reduces ethylene-induced culture abnormalities during minimal growthconservationinvitro[J].PlantCellTissOrg,2002,68:79-89.
[12]袁华玲,金黎平,黄三文,等.硫代硫酸银对二倍体马铃薯试管苗生长和生理特性的影响[J].作物学报,2008,34(5):846-850.
[13]张淑红,王蒂,王清.影响马铃薯叶肉原生质体褐化的因素及AgNO3对其褐化和分裂的作用[J].中国马铃薯,2004,18(2):77-81.
[14]Möllers C,Zhang S,Wenzel G.The influence of silver thiosulfate on potato protoplast cultures[J].Plant Breed,1992,108:12-18.
[15]周宇波,柳俊,谢从华,等.马铃薯原生质体培养体系改良[J].华中农业大学学报,2001,20:469-473.
[16]田国奎,蔡兴奎,盛万民,等.二倍体马铃薯体细胞电融合参数的优化[J].中国马铃薯,2012,26(6):321-324.
[17]蔡兴奎,柳俊,谢从华.马铃薯栽培种与野生种叶肉细胞融合及体细胞杂种鉴定[J].园艺学报,2004,31:623-626.
[18]蔡兴奎,柳俊,谢从华.马铃薯叶肉原生质体电融合参数优化及杂种植株再生[J].华中农业大学学报,2003,22:494-498.
[19]袁华玲.二倍体马铃薯原生质体培养及体细胞杂交的研究[D].北京:中国农业科学院,2008.
《中国马铃薯》杂志约稿函
《中国马铃薯》杂志是目前全国唯一的马铃薯专业科技期刊,国际刊号:ISSN 1672-3635,国内刊号:CN 23-1477∕S,邮发代号:14-167,国内外公开发行。它以繁荣我国马铃薯产业为办刊宗旨,积极报道国内外有关马铃薯的学术研究、科研动态和各种实用技术的最新消息。该刊由东北农业大学和中国作物学会主管,由东北农业大学和中国作物学会马铃薯专业委员会主办。《中国马铃薯》(原名《马铃薯杂志》)创刊于1987年。2000年经申请报国家新闻出版总署审批,更名为《中国马铃薯》,同年改为大16开本,并增加彩色广告。2001年《中国马铃薯》经报黑龙江省科委及省新闻出版局批准,将原来的季刊改为双月刊。
《中国马铃薯》立足国内,并刊登一些其他国家作者的英文稿件。它集学术性和技术性于一体,是马铃薯科研、生产、经销单位和用户之间信息交流的一个平台。《中国马铃薯》不同于其他园艺类期刊,刊登的文章全部是有关马铃薯的,主要栏目包括:遗传育种、栽培生理、病虫防治、土壤肥料、产业开发、品种介绍、综述及其他。
该刊于2008年1月1日起开始执行作者在线投稿,进一步提高了工作效率和办公自动化水平,方便作者查询。欢迎专业委员会各位委员及广大读者踊跃投稿,投稿时请登录《中国马铃薯》稿件远程处理系统。
网址:http:∕∕mlsz.cbpt.cnki.net∕WKA2∕WebPublication∕index.aspx?mid=mlsz。
《中国马铃薯》杂志编辑部
Culture of Diploid Potato Plantlets in vitro and Effect on Mesophyll Protoplast Fusion
LI Fengyun1*,CAI Xingkui2,SHENG Wanmin3,WANG Lichun1,TIAN Guokui1,
LOU Shubao1,XU Hongyan1,WANG Haiyan1,JIANG Junfeng1
(1.Keshan Branch of Heilongjiang Academy of Agricultural Sciences,Keshan,Heilongjiang 161606,China;
2.College of Horticulture and Forestry,Huazhong Agricultural University,Wuhan,Hubei 430070,China;
3.Crop Breeding Institute of Heilongjiang Academy of Agricultural Sciences,Harbin,Heilongjiang 150086,China)
Thirty-five diploid potato materials were used to study the factors influencing the culture of diploid potato plantlets in vitro in order to increase their blade size and leaf area,and benefit the fusion of mesophyll protoplast.Twenty-two diploid potato plantlets in vitro could be cultivated in the medium MS+0.5 mg/L NAA+1 mg/LAgNO3.The blade size was increased obviously in the medium containing AgNO3than without it,and the leaf area was increased,significantly.The maximum leaf area was got in the medium added with 2 mg/L AgNO3and 2%sucrose.Plants were regenerated from the electrofusionproductusingmesophyllprotoplastisolatedfromdiploidwildspeciesS.chacoenseandadiploidcloneDY4-5-10, which were cultivated in the medium added with 1 mg/LAgNO3and 2%sucrose.So the medium is suitable for the culture of diploidpotatoplantletsinvitrousedfortheisolationofprotoplasts.
diploid potato;AgNO3;mesophyll protoplast fusion
S532
A
1672-3635(2014)05-0257-07
2014-08-12
黑龙江省农业科技创新工程“二倍体马铃薯原生质体融合创制抗晚疫病的新种质”(2012ZD013)。
李凤云(1972-),女,副研究员,从事马铃薯育种和生物技术研究。
李凤云,lfypotato@163.com。

