育真熄风汤对帕金森病模型小鼠脑内铁蛋白Fn的影响*
秦博文,党晓伟,卢思英,商亚珍
(1.承德护理职业学院科研处,河北承德 067000;2.承德医学院,河北承德 067000)
1924年,Lehermitte等发现帕金森病(PD)患者脑内铁含量增加显著,存在异常堆积的现象。PD患者黑质内铁异常沉积的原因不明,但越来越多的证据显示铁在脑黑质部位的异常沉积与PD密切相关,极有可能是PD发病的一个重要因素[1]。铁在脑内主要以Fn蛋白的形式储存,正常情况下,当细胞内增多的铁离子水平高于细胞代谢所需时,就会诱导Fn合成,这样游离铁就可以结合在铁蛋白核内,以一种可利用的无毒形式存在,如果铁蛋白的合成正常进行,黑质中增加的铁就会是无毒性状态[2],Fn可以防止细胞内过剩的自由铁离子的堆积,被认为是天然的铁螯合剂,Fn蛋白越高对PD患者疗效越好。本研究通过探讨育真熄风汤(YZXFT)对脑内Fn蛋白表达作用,为进一步研究其治疗PD的机制提供依据。
1 材料与方法
1.1 材料 健康雄性C57/BL小鼠90只,SPF级,6~7周龄,体质量(18±2)g,购于北京华阜康生物科技股份有限公司,小鼠饲养于承德医学院动物实验中心,室温维持在(18±2)℃,湿度维持在50%±10%,昼夜循环光照条件下,自由进食和饮水,实验开始前适应环境1周。
1.2 仪器与试剂 Leica石蜡切片机(德国),恒温摊片烤片机(TK-218,湖北),Thermo石蜡包埋机(英国),Olympus显微镜及摄像装置(BH-2型,日本),HI98127酸度计(意大利),水域振荡器(SZX-B,哈尔滨),恒温磁力搅拌器(江苏),美多巴(每片含左旋多巴200mg+苄丝肼50mg,上海罗氏),1-甲基-4-苯基-1,20,3,6-四氢吡啶(MPTP,美国Sigma),兔抗小鼠 TH 抗体(北京博奥森生物技术有限公司),Ferritin heavy chain(H-53):sc-25617(Santa Cruz)。
1.2 方法
1.2.1 药物制备 YZXFT(含生黄芪15g,熟地30g,龟板30 g,怀牛膝15g,白芍20g,鹿角胶12g,附子3g,补骨脂12g,天南星12g,白芥子12g,天麻15g,牡蛎30g,枳壳10g,丹参30g,酒大黄6g,全蝎8g,蜈蚣2g,条僵蚕12g),生药总量275g,根据药理学方法计算小鼠给药量,按照每次小鼠灌胃10 mL/kg计算,3个中药治疗组分为低、中、高剂量组,小鼠给予相当于生药量分别为35.75、71.50、143.00g/kg的药液,阳性对照药物美多巴(每片250mg),采用CMC溶解配制成浓度为12.5mg/mL的溶液,造模药MPTP采用生理盐水配制成浓度为0.33%的溶液。
1.2.2 PD小鼠模型 建立参照 Nobutaka Arai,Kazuaki Misugi的实验方法,略加修改。小鼠造模前训练小鼠自上而下完成爬杆运动1min,以确保小鼠能顺利完成实验项目。训练时间为每日上、下午每只小鼠各完成爬杆活动3次,连续5d。造模前1d,采用爬杆实验筛选健康灵活小鼠,选用能在6~10s内完成爬杆的小鼠,消除小鼠的运动差异,造模采用生理盐水配制的0.33%MPTP(30mg·kg-1·d-1)腹腔注射,连续5d。
1.2.3 动物分组与给药 将小鼠分成6组,每组15只,实验药物采用灌胃法给药,按照10mL/kg的剂量给予小鼠灌胃,从首次注射MPTP前3d开始,灌胃小鼠(中药治疗组)分别给予高(143g/kg)、中(71.5g/kg)、低 (35.75g/kg)浓度 的YZXFT,美多巴组给予阳性药物美多巴悬液(125mg·kg-1·d-1)灌胃,以上统称(治疗组);空白对照组和模型对照组给予生理盐水灌胃,造模期间及造模后持续灌胃给药共27d。
1.2.4 行为学检测 取一长50cm,直径1cm的木制杆垂直竖立,顶端固定一直径1.5cm的黏土小球,为防止打滑,木杆表面缠一层纱布。将被测小鼠头向下放到小球上,从小鼠接触小球开始计时,到小鼠前爪着地为止,记录小鼠从小球爬下木杆所用时间。如遇小鼠中途停止或反向爬行结果不计,重新测试。如小鼠抱杆停留,不能爬行,或不能抓杆,直接掉落计120 s。每只小鼠每天在同一时间测试3次,以连续爬行用时最短的2次作为有效,取平均值作为小鼠最终爬杆时间。
1.2.5 标本采集 分别于造模第6、13、20、27天分批处死小鼠取材。用10%水合氯醛腹腔麻醉小鼠,麻醉成功后,打开胸腔,插管经左心室插入升主动脉,经插管快速注入37℃生理盐水灌流液冲洗,同时剪开右心耳放血,直到流出液不见血色,肝脏发白为止。再用推注10%福尔马林溶液灌注,直至小鼠头和四肢僵硬,灌注完毕后迅速断头,剥离颅骨及软脑膜,取出脑,置于10%福尔马林固定液中继续固定,24h后0.1mol/L的PBS(pH=7.2)液浸泡6h中止固定。经脱水,常规石蜡包埋,灌状连续切片,片厚5μm,隔100μm取1,用于免疫组织化学染色。
1.2.6 免疫组织化学(SABC法) 切片常规脱蜡至水(二甲苯Ⅰ、Ⅱ各15min;无水乙醇Ⅰ、Ⅱ各10min,95%、90%、80%、70%乙醇依次浸没10min,纯水浸洗5min×2次;PBS浸泡5 min×2次),3%H2O237℃恒温箱孵育30min灭活内源性酶;枸橼酸盐修复液微波煮沸修复,冷却至37℃;5%BSA羊血清封闭;一抗分别用1∶150兔抗小鼠TH抗体,1∶200Ferritin heavy chain(H-53),4℃过夜;生物素化山羊抗兔IgG抗体(Ⅱ抗)和SABC,37℃各孵育20min;DAB显色,苏木素复染2min,HCL-ALC分化1~2s;脱水、透明、封片,阴性对照以PBS代替一抗进行染色。结果判定:以胞质内出现棕黄色颗粒为阳性神经元。
1.3 统计学处理 采用SPSS13.0统计软件进行分析,计量资料以±s表示,组间多样本均值间比较采用单因素方差检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 行为学测试 小鼠在注射MPTP 5~10min后,出现肢体震颤、弓背、竖毛竖尾、后肢伸张及跳窜等动作,持续20~30 min后,小鼠活动明显减少,动作迟缓,对外界反应降低,逃避反应迟钝,甚至匍匐不动,此情况持续一段时间后逐渐恢复,24 h后完全消失。爬杆实验采用小鼠完成固定爬杆的时间来评估小鼠的运动协调能力,见表1。
表1 实验各组爬杆标准计分比较(n=15,±s,分)

表1 实验各组爬杆标准计分比较(n=15,±s,分)
△:P<0.05,△△:P<0.01,与空白对照组比较;*:P<0.05,**:P<0.01,与模型对照组比较。
组别 当天6.40±1.35 7.07±1.16 6.93±1.98 6.80±2.04模型对照组 6.33±1.67 19.20±5.40△△ 54.73±17.03△△ 76.28±27.65△△YZXFT低剂量组 6.47±1.55 21.20±6.33 44.00±20.81 62.14±18.37*YZXFT中剂量组 6.80±1.74 22.73±9.49 41.67±24** 59.15±19.45**YZXFT高剂量组 6.47±1.85 20.40±4.27 36.13±19.77* 53.29±12.28*美多巴组 6.73±1.39 18.80±4.39 39.13±12.87* 50.94±14.80 1d 3d 5d空白对照组**
表2 各组小鼠脑内Fn蛋白表达比较(n=3,±s)
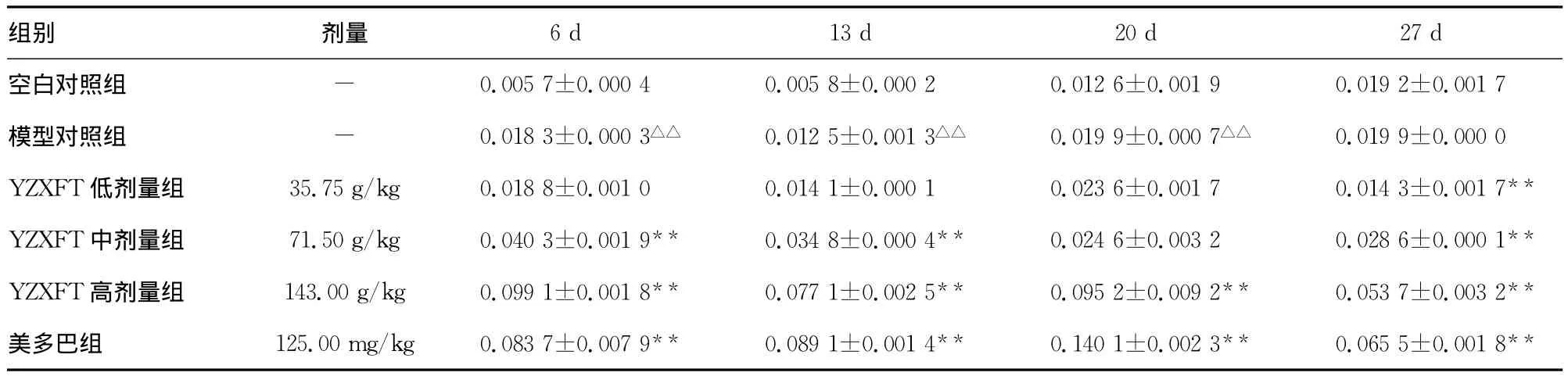
表2 各组小鼠脑内Fn蛋白表达比较(n=3,±s)
△:P<0.05,△△:P<0.01,与空白对照组比较;*:P<0.05,**:P<0.01,与模型对照组比较。-:表示此项无数据。
组别 剂量9 0.019 2±0.001 7模型对照组 - 0.018 3±0.000 3△△ 0.012 5±0.001 3△△ 0.019 9±0.000 7△△ 0.019 9±0.000 0 YZXFT低剂量组 35.75g/kg 0.018 8±0.001 0 0.014 1±0.000 1 0.023 6±0.001 7 0.014 3±0.001 7**YZXFT中剂量组 71.50g/kg 0.040 3±0.001 9** 0.034 8±0.000 4** 0.024 6±0.003 2 0.028 6±0.000 1**YZXFT高剂量组 143.00g/kg 0.099 1±0.001 8** 0.077 1±0.002 5** 0.095 2±0.009 2** 0.053 7±0.003 2**美多巴组 125.00mg/kg 0.083 7±0.007 9** 0.089 1±0.001 4** 0.140 1±0.002 3** 0.065 5±0.001 8 6d 13d 20d 27d空白对照组 - 0.005 7±0.000 4 0.005 8±0.000 2 0.012 6±0.001**

图1 实验第27天黑质内Fn免疫组织化学蛋白表达(SABC法,×400)
结果显示,首次注射MPTP前1d,各组小鼠均在6~10s内完成爬杆活动,注射MPTP后,模型对照组与空白对照组比较,完成爬杆时间出现延长,且完成爬杆时间随着用药时间的延长而显著增加,尤其从第3天开始,差异有统计学意义(P<0.05),中药组与模型对照组比较,爬杆时间有所缩短。
2.2 Fn组化染色 Fn阳性细胞染色为棕黄色,为神经胶质细胞,空白对照组小鼠脑内胞质着色均匀分布,神经细胞胞体正常,轮廓饱满,核仁清晰,模型对照组与空白对照组比较,模型对照组神经胶质细胞数量明显降低,治疗组神经胶质细胞较模型对照组增多,体积较饱满,结构较清晰,见图1。
2.3 YZXFT对小鼠脑内Fn蛋白表达的影响 Fn免疫组织化学结果显示,在给药的第6、13、20天模型组Fn含量与空白组比较增加,差异均有统计学差异(P<0.05),分别为2.21倍、1.15倍、0.36倍。给药的第6、13、20和27天,YZXFT 低剂量组与模型对照组比较,差异无统计学意义(P<0.05);YZXFT中剂量组与模型对照组比较,Fn蛋白表达分别增加了1.20倍(P<0.01)、1.78倍(P>0.05)、95.2%(P>0.05)、48.95%(P<0.01);YZXFT高剂量组与模型对照组比较,Fn蛋白表达分别增加了4.41、5.16、6.55、1.79倍,差异均有统计学意义(P<0.01);而美多巴组与模型对照组比较,Fn蛋白表达分别增加了3.57、6.12、10.19、2.41倍,差异均有统计学意义(P<0.01),见表2。
3 讨 论
YZXFT以熟地、龟板、鹿角胶为君药,辅以其他滋肝阴、补肾气、补脾益气、活血化瘀、化疾通络的中药有效成分,从多靶点、多层次、多途径整体调节机体功能,达到熄风止痉、引血下行、肾阳充盛,肝阳下潜,虚风得熄,筋脉得养,抽搐震颤自止的效果,符合PD的中医治疗理论。行为学上采用爬杆实验[3-4]作为测试小鼠协调运动能力改变的指标,结果显示在造模第3天,模型对照组与空白对照组的出现显著差异,随着MPTP注射时间的增加,每次注射后小鼠的运动障碍程度较前1d增加,症状持续时间相应延长。中药治疗组和美多巴组与模型对照组比较PD小鼠运动协调障碍均有不同程度的减轻,恢复时间有所缩短,显示YZXFT可减轻PD小鼠的行为学障碍,实验结果表明,本次研究所采用的连续5d腹腔注射MPTP(30mg·kg-1·d-1)建立的PD小鼠模型是可靠的,并且YZXFT对MPTP所致小鼠运动协调能力障碍具有一定的改善作用。
多数学者普遍认为,铁通过Fenton反应与H2O2反应产生具有高度活性的羟自由基(-OH),-OH通过作用于核酸、蛋白质和含有大量不饱和脂肪酸的细胞膜,从而引起细胞损伤[5]。结合的Fe3+需要被还原成Fe2+后才能与H2O2反应生成-OH,这是铁产生氧化应激损伤的一个关键环节。铁在脑内主要以Fn的形式储存,Fn是由蛋白质外壳和壳内无机复合体的铁核构成。蛋白质外壳是由重链(H亚基)和轻链(L亚基)组成。H亚基含有有活性的铁氧化酶,它是氧化Fe2+的关键酶[6]。SN内铁以Fe2+的形式被摄取,随之在铁蛋白外壳被铁氧化酶氧化为Fe3+并转入铁核,以多聚体形式聚集在铁核内,而L亚基不含有铁氧化酶。因此H亚基具有迅速结合和稳定铁,减少氧化应激损伤的作用,被认为是细胞抗氧化损伤的天然保护剂。同样,铁蛋白中的Fe3+也可以在多种生物还原剂如半胱氨酸、还原型核黄素和抗坏血酸的作用下还原成Fe2+而释放[7]。正常情况下,当细胞内增多的Fe2+水平高于细胞代谢所需时,就会诱导Fn合成,这样游离铁就可以结合在铁蛋白核内,以一种可利用的无毒形式存在。如果铁蛋白的合成正常进行,SN中增加的铁就会是无毒性状态[8],Fn可以防止细胞内过剩的自由铁离子的堆积,因此,被认为是天然的铁螯合剂。
本研究结果显示,模型对照组比空白对照组Fn显著增加,可能是游离铁的增加诱发铁蛋白合成增多。而治疗组小鼠Fn水平较模型组增多显著,且随着剂量的增加,Fn水平也增加,YZXFT高剂量组与美多巴组近似,提示YZXFT可能是通过促进胶质细胞内铁蛋白含量的增加,进而结合游离铁离子,降低铁的异常堆积,对抗神经细胞膜上产生的脂质过氧化反应,从而保护黑质多巴胺神经元免遭氧化应激的攻击,达到抗PD的目的。
[1] BovéJ,Perier C.Neurotoxin-based models of Parkinson′s disease[J].Neuroscience,2012,211:51-76.
[2] Zhang HX,Tao L,Jiao XY,et al.Nitrative thioredoxin inactivation as a cause of enhanced myocardial ischemia reperfusion injury in the aging heart[J].Free Radic Biol Med,2007,43(1):39-47.
[3] 许耀刚,庞晓峰.MPTP损伤的小鼠PD模型的制作与评价[J].生物化学与生物物理进展,2006,33(10):74-75.
[4] 李丽波,王玉祥.帕金森病MPTP模型小鼠两种行为学检测方法的比较研究[J].齐齐哈尔医学院学报,2009,30(15):1641-1643.
[5] Valko M,Morris H,Cronin MT.Metals,toxicity and oxi-dative stress [J].Curr Med Chem,2005,12(10):1161-1208.
[6] Rivera-Mancía S,Pérez-Neri I,Ríos C.The transition metals copper and iron in neurode-generative diseases[J].Chem Biol Interact,2010,186(2):184-199.
[7] Jimenez-Del-Rio M,Velez-Pardo C.The bad,the good,and the ugly about oxidative stress[J].Oxid Med Cell Longev,2012,156:163-193.
[8] Zhang HX,Tao L,Jiao XY,et al.Nitrative thioredoxin inactivation as a cause of enhanced myocardial ischemia reperfusion injury in the aging heart[J].Free Radic Biol Med,2007,43(1):39-47.

