uPA-siRNA重组慢病毒载体感染兔软骨细胞对uPA和MMP-3表达的影响*
史晨辉,王维山,李长俊,张振东,郭风劲,陈安民△
(1.华中科技大学同济医学院附属同济医院骨科,武汉430030;2.石河子大学医学院附属医院骨科,新疆石河子832008)
骨关节炎(osteoarthritis,OA)是一种以关节软骨退行性改变和软骨下骨代谢异常为主要病理特征,伴随有关节周围骨赘形成、关节周围软组织挛缩、关节滑膜炎性反应的关节疾患,其以关节疼痛、功能障碍为主要临床表现[1]。目前研究表明,OA病变与老龄、性别、肥胖、创伤、遗传等多因素有关,但是软骨组织的降解大于合成造成软骨渐进性退变是其最基本的病理改变[2]。在软骨降解过程中,尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator receptors,uPA)和基质金属蛋白酶3(matrix metalloproteinase,MMP-3)发挥着极其重要的作用[3-4]。有研究表明,uPA可激活软骨组织及滑膜组织分泌的无活性的前体 MMP-3(Pro-MMP-3),然后同活性 MMP-3共同作用于软骨组织中胶原蛋白的裂解,因此,抑制软骨组织及滑膜组织表达uPA可能是OA防治的一个途径[5]。目前,较为成熟的RNA干扰(RNAi)技术可抑制靶基因的表达而达基因沉默效应。但通过RNAi技术抑制uPA间接降低MMP-3表达的研究尚未见文献报道。本课题组在筛选uPA-siRNA靶向序列的基础上,通过慢病毒包装并加载GFP,观察其感染软骨细胞后对细胞表达uPA、MMP-3基因和蛋白的影响,以期为进一步研究uPA在OA病变中的防治作用提供实验依据。
1 材料与方法
1.1 材料与试剂 2月龄新西兰兔购自新疆医科大学实验动物中心,uPA-siRNA序列由本实验室保存。Lentivirus-NC病毒液和pGLV-H1-GFP+Puro载体购自上海吉玛公司。BamHI、EcoRI内切酶购自 MBI Fermentas公司,Lipofectamine 2000转染试剂、Trizol试剂、DMEM/F12培养基均购自Invitrogen公司。Taq酶、质粒抽提试剂盒购自Takara公司,uPA和MMP-3抗体均购自Abcam公司。引物合成:采用Oligo6.0软件设计uPA、MMP-3及内参基因β-actin检测引物,由上海生工生物技术有限公司合成。
1.2 方法 取原代生长良好的兔膝关节软骨细胞以每孔1.2×104个细胞传代接种于24孔培养板中进行常规培养,当软骨细胞汇合至50%以上时,按照感染复数(MOI)值为1、10和100的病毒细胞比加入慢病毒颗粒液,共同培养96h后在荧光显微镜下观察GFP的表达情况,确定最佳MOI值。并用图像分析软件Image-Pro Plus6.0分析病毒转染效率。
根据实验以最佳MOI值的uPA-siRNA转染组设立为实验组(转染uPA-siRNA慢病毒载体),同时设立不加病毒的空白对照组(未进行任何处理)、空载体组(转染慢病毒载体)和药物干预组[加载MMP特异性抑制剂(TIMP)]。实验组:uPA-siRNA序列经慢病毒包装并加载GFP,通过Lipofectamine 2000转染入兔软骨细胞;空载体组:将慢病毒载体通过Lipofectamine 2000转染入兔软骨细胞;空白对照组正常培养软骨细胞;药物对照组:给予特异性MMP抑制剂。所有细胞培养96h后应用实时定量-聚合酶链反应(RT-PCR)和 Western blot法分别检测软骨细胞uPA mRNA、MMP-3mRNA和蛋白的表达水平。PCR产物经20g/L琼脂糖凝胶电泳分离,应用Bio-Rad凝胶成像系统照相,以及Quantity One软件分析图像,mRNA的相对表达量以扩增产物条带的光密度值与β-actin条带吸光度值之比值表示。Western blot经X线片在凝胶成像系统扫描,采用Quantity one软件分析图像,以GAPDH作为内参。
1.3 统计学处理 采用SPSS13.0统计软件进行分析,计量资料以±s表示,组间比较采用单因素方差分析和t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 慢病毒转染效率的检测 利用倒置荧光显微镜观察4个序列慢病毒载体在不同MOI时对293T细胞和软骨细胞的转染效率。随着MOI的增加,慢病毒的转染效率也随之增加,当MOI为100时,转染效率可达85%以上,符合后续实验要求,见图1。
2.2 软骨细胞uPA mRNA和 MMP-3mRNA检测 应用相对RT-PCR以β-actin作为内参照,实验结果采用标准曲线分析法进行数据分析。结果显示,实验组uPA mRNA和MMP-3 mRNA表达水平显著降低,而空载体组、空白对照组和TIMP组uPA mRNA、MMP-3mRNA表达量较高(P<0.01)。空载体组与空白对照组间uPA mRNA、MMP-3mRNA表达比较,差异无统计学意义(P>0.05),见图2。

图1 慢病毒在不同MOI值下转染293T细胞、软骨细胞72h后的荧光图(免疫荧光法,×200)
2.3 软骨细胞uPA和 MMP-3蛋白检测 实验组uPA和 MMP-3蛋白表达水平显著降低,而空载体组和空白对照组uPA、MMP-3蛋白表达量较高(P<0.01),实验组与 TIMP组之间uPA蛋白表达差异有统计学意义(P<0.01),而 MMP-3蛋白表达无明显差异统计学意义(P>0.05),表明抑制uPA表达可降低MMP-3蛋白表达水平,而TIMP对uPA表达无影响,见图3、4。
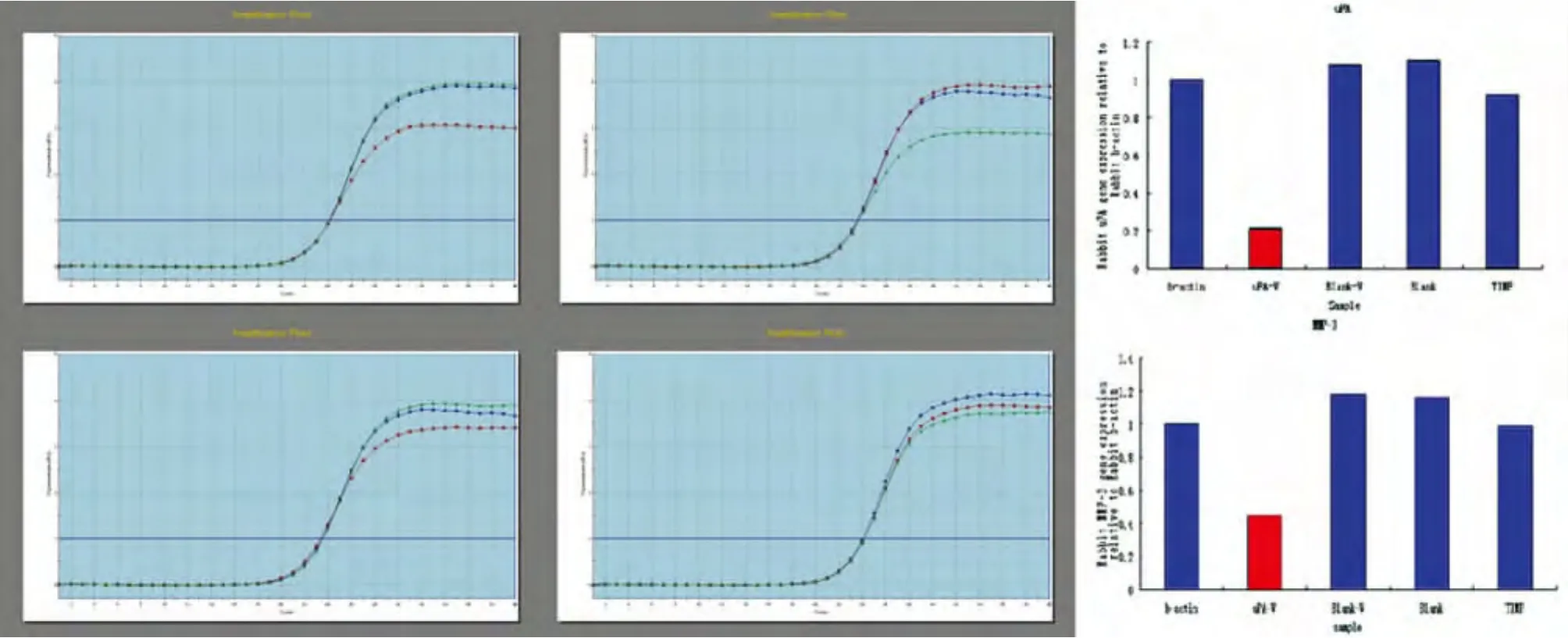
图2 uPA PCR扩增曲线及转染后软骨细胞uPA、MMP-3基因表达水平
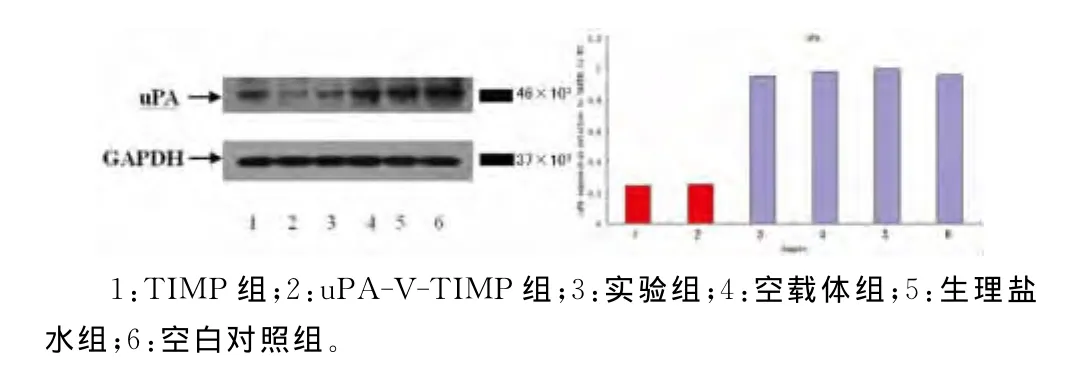
图3 uPA蛋白表达水平
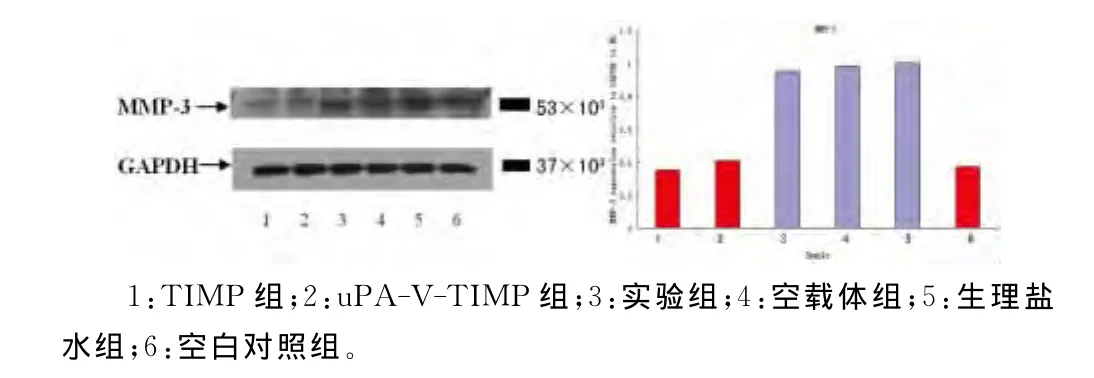
图4 MMP-3蛋白表达水平
3 讨 论
随着社会老龄化的加重及人口平均寿命的延长,OA已经成为严重影响中老年生活质量的疾病之一。研究表明,OA以关节软骨组织的退行性改变伴随有关节周围新生骨的形成为病理特点,以关节疼痛、功能障碍为临床表现,在OA病变过程中,软骨下骨也出现骨硬化、骨质疏松等代谢异常表现,其复杂的病理表现给OA的病因学研究带来了一定的困难。目前,人们普遍认为OA病理变化涉及软骨组织、软骨下骨及滑膜在内的所有关节结构部分,是组织创伤、代谢、基因、遗传和免疫等多因素作用的结果[2]。但是其最根本的病理变化是关节软骨组织的降解大于合成,软骨组织渐进性退化后出现关节疼痛、关节狭窄、关节畸形及功能障碍。在软骨组织的降解过程中,MMPs由于其能广泛的降解胶原而发挥着主要的作用。MMPs家族中对胶原裂解起重要的作用的酶是 MMP-3和MMP-13,但是在软骨组织收到内源性或外源性刺激后,软骨细胞和滑膜细胞首先分泌的是没有活性的Pro-MMPs,Pro-MMPs系统在uPA激活Pro-MMP-3为活性的 MMP-3后出现瀑布样阶联放大效应,大量MMPs被激活从而参与软骨组织的降解过程[6-7];而在关节组织中存在天然TIMP,其可抑制家族的裂解胶原功能,通常二者保持平衡状态,共同调节细胞外基质的降解与合成代谢。但是当内源性和外源性刺激物持续存在的情况下,MMPs的分泌多于TIMP从而出现细胞外基质的降解过程。已有的文献证实[1,8-10],软骨细胞和滑膜细胞分泌的uPA在OA早期病变中起着至关重要的作用,其不但可以促进滑膜组织大量分泌IL-1β和TNF-α,后者参与滑膜炎性反应加重软骨降解代谢过程;也可以直接作用于软骨细胞外基质的降解;尤为重要的是uPA可以激活 MMP-3酶原,使其活化为活性增强20倍的蛋白降解酶,促进软骨组织胶原的降解,而 MMP-3作为最好的催化剂,激活 Pro-MMP-1,2,13等共同参与软骨组织的降解过程。因此,通过抑制滑膜组织和软骨组织中uPA的表达,可改善软骨组织中的降解性代谢过程,从而达到缓解或者改善OA早期软骨组织的病理变化。
RNAi技术是近年来发展起来的高效基因沉默技术,当内外源性双链RNA进入细胞后可引起与其同源的mRNA特异性降解,进而抑制相应基因表达,是一种简单高效的代替基因敲除的新兴生物技术。目前,已经在基因功能的研究及部分基因治疗方面发挥了重要的作用[11-12],研究证实RNAi基因沉默效果显著,应用微量的siRNA即可使其编码致病基因产物的含量降低90%以上,一定条件下甚至可达到基因完全敲除的效果。但目前研究的难度是RNAi表达载体在目的细胞中的转染,现有的化学方法、电转染、腺病毒载体法等均有转染效率低,转染稳定性差等问题。而慢病毒载体能够成功克服上述问题,可高效转染宿主细胞,尤其是对原代细胞和悬浮细胞等不易感染的细胞亦有较高的转染效率,且转染稳定,目的基因长时间沉默,能持久的发挥RNA干扰效应[13-14]。笔者构建的靶向uPA-siRNA慢病毒表达载体,转染软骨细胞的效率高达85%,为进行OA病理机制与治疗等相关研究的奠定了重要基础。
Sato等[10]研究证实,通过抑制组织中uPA的水平,可间接降低MMP-3的表达,从而减缓细胞外基质的降解过程。Korshunov等[15]研究也表明,uPA可快速高效激活Pro-MMP-3为活性的 MMP-3,MMP-3又可快速激活 Pro-MMP-9,大量MMP-3,9又可刺激细胞分泌更多的uPA,从而在细胞外基质降解病理过程中形成一个恶性循环,通过早期干预,抑制uPA的表达水平,可显著减缓组织胶原的降解。笔者前期构建了靶向uPA-shRNA序列并进行慢病毒包装,本研究在进行慢病毒包装时加载了GFP,转染软骨细胞后观察不同分组之间uPA、MMP-3基因和蛋白的表达水平,结果显示uPA-siRNA慢病毒载体可高效转染软骨细胞,其可显著抑制uPA、MMP-3基因和蛋白的表达水平,而同期应用 MMP-3抑制剂TIMP后,其只抑制了 MMP-3蛋白的表达,对uPA、MMP-3基因和uPA蛋白的表达未产生任何影响,进一步表明沉默uPA在OA病变早期基因治疗中的价值,也间接证明uPA作为调控MMP-3表达的上游因子,在MMP-3相关分子信号通路中发挥着极其重要的作用。笔者后续将通过动物实验进一步验证此项研究结果,为进一步研究uPA基因在OA病变中的作用机制及其治疗作用奠定实验基础。
[1] Hochberg MC.Osteoarthritis year 2012in review:clinical[J].Osteoarthritis Cartilage,2012,20(12):1465-1469.
[2] Loeser RF.Aging processes and the development of osteoarthritis[J].Curr Opin Rheumatol,2013,25(1):108-113.
[3] Abramson SB,Attur M.Developments in the scientific understanding of osteoarthritis[J].Arthritis Res Ther,2009,11(3):227-231.
[4] Gepstein A,Arbel G,Blumenfeld I,et al.Association of metalloproteinases,tissue inhibitors of matrix metalloproteinases,and proteoglycans with development,aging,and osteoarthritis processes in mouse temporomandibular joint[J].Histochem Cell Biol,2003,120(1):23-32.
[5]Inuzuka K,Ogata Y,Nagase H,et al.Significance of coexpression of urokinase-type plasminogen activator,and matrix metalloproteinase 3(stromelysin)and 9(gelatinase B)in colorectal carcinoma[J].J Surg Res,2000,93(2):211-218.
[6] Ramos-DeSimone N,Hahn-Dantona E,Sipley J,et al.Activation of matrix metalloproteinase-9(MMP-9)via a con-verging plasmin/stromelysin-1cascade enhances tumor cell invasion[J].J Biol Chem,1999,274(19):13066-13076.
[7] Dreier R,Grassel S,Fuchs S,et al.Pro-MMP-9is a specific macrophage product and is activated by osteoarthritic chondrocytes via MMP-3or a MT1-MMP/MMP-13cascade[J].Exp Cell Res,2004,297(2):303-312.
[8] Murphy G,Atkinson S,Ward R,et al.The role of plasminogen activators in the regulation of connective tissue metalloproteinases[J].Ann N Y Acad Sci,1992,667:1-12.
[9] Massicotte F,Lajeunesse D,Benderdour M,et al.Can altered production of interleukin-1beta,interleukin-6,transforming growth factor-beta and prostaglandin E(2)by isolated human subchondral osteoblasts identify two subgroups of osteoarthritic patients[J].Osteoarthritis Cartilage,2002,10(6):491-500.
[10]Sato T,Tamai H,Kobayashi M,et al.Immunohistochemical properties in the patients with Buerger′s disease--possible role of plasminogen activator inhibitor-1for preservation of vessel wall architecture[J].Cardiovasc Pathol,2011,20(5):266-271.
[11]Jorgensen C,Apparailly F.Prospects for gene therapy in inflammatory arthritis[J].Best Pract Res Clin Rheumatol,2010,24(4):541-552.
[12]季丙元,关晶.siRNA抑制人乳腺癌KLK6基因表达的实验研究[J].重庆医学,2011,40(1):33-35.
[13]Sakuma T,Barry MA,Ikeda Y.Lentiviral vectors:basic to translational[J].Biochem J,2012,443(3):603-608.
[14]Visse R,Nagase H.Matrix metalloproteinases and tissue inhibitors of metalloproteinases:structure,function,and biochemistry[J].Circ Res,2003,92(8):827-839.
[15]Korshunov VA,Solomatina MA,Plekhanova OS,et al.Plasminogen activator expression correlates with genetic differences in vascular remodeling[J].J Vasc Res,2004,41(6):481-490.

