氯过氧化物酶发酵相关指标及其关联性分析
李梅梅,戴佳伟,李新国,陈 军,吴霞琴
(上海师范大学生命与环境科学学院,上海200234)
氯过氧化物酶发酵相关指标及其关联性分析
李梅梅,戴佳伟,李新国,陈 军,吴霞琴
(上海师范大学生命与环境科学学院,上海200234)
通过考察氯过氧化物酶(CPO)发酵相关参数的动力学特征,探究酶产量与参数之间的关联性。结果表明:CPO发酵过程中慢速C源麦芽糖比葡萄糖更有利于调控CPO的稳定合成,前者CPO最高比酶活(179.50 U/mL)比后者(135 U/mL)高出44.5 U/mL,而且产酶高峰期延迟1~2 d;发酵过程pH波动与C源消耗速率密切相关,且对CPO合成具有明显的指标性作用。通过生物量曲线及糖消耗曲线与产酶特征对比判断,菌株合成CPO为中期合成类型。副产物黑色素是菌体成熟时期的一种次生代谢物质,与酶的生物合成存在时间上的同步性。控制C源基质和pH对提高CPO稳定化生产具有一定成效。
Leptoxyphiumfumago;氯过氧化物酶;发酵;关联性分析
氯过氧化物酶(chloroperoxidase,EC 1.11.1.10,CPO)是一种十分有应用前景的“手性生物催化剂”[1-2]。作为一种过氧化物酶,由于其辅基是高铁(IX)原卟啉,因而使它不仅具备类似过氧化氢酶的结合位点,而且有与细胞色素P-450高度相似的光谱学和化学性质,可以催化卤素离子、芳香族化合物、脂肪族化合物和醇类化合物等多种物质进行过氧化反应[3-5]。目前,CPO已经被广泛应用于多种手性物质的合成生产,可减少反应过程中手性异构体的损失,去除药物手性对映体的毒性,减轻废弃物对环境的污染[6-7]。
CPO主要来源于微生物的发酵生产,海洋真菌Caldariomycesfumago是最早用于CPO发酵的菌种[8-12]。但是,CPO发酵过程中酶产量波动幅度大、浓度积累低(一般小于100 mg/L)、酶活性稳定性差、色素等副产物多,是造成CPO生产成本居高不下的主要原因,严重限制了CPO的开发与使用[13-15]。影响CPO生产稳定的因素很多,其中主要发酵参数之间的协同变化对产酶稳定性具有显著的影响,而现有文献报道对CPO发酵产量与参数的相关性研究并不多见[16-17]。笔者在孙凌燕[18]工作的基础上通过实验考察CPO发酵相关指标变化特征,分析其中的关联性,探讨CPO的稳定化生产的条件。
1 材料与方法
1.1 菌种
Leptoxyphiumfuming,购自英国CABI Europe-UK。
1.2 培养基
斜面种子培养基:马铃薯葡萄糖琼脂(PDA)培养基[19]。
发酵培养基:葡萄糖20 g/L(或麦芽糖20 g/L),(NH4)2SO41.5 g/L,NaNO32 g/L,酵母粉 7 g/L,马铃薯浸出液150 mL/L,KCl 2.2 g/L,KH2PO41.0 g/L,MgSO4·7H2O 0.1 g/L,FeSO4·7H2O 0.2 g/L,pH 6.0。0.1 MPa灭菌30 min。装液量为250 mL三角瓶中装液50 mL。
马铃薯浸出液制备:去皮马铃薯100 g,加水至500 mL,煮沸15 min,纱布过滤取清液。
1.3 主要试剂
MCD-磷酸钾缓冲溶液:1,1-二甲基-4-氯3,5-环己二酮(MCD)0.1 mmol/L,溶于含有20 mmol/L KCl的0.1 mol/L的K3PO4缓冲溶液中。
过氧化氢溶液:10 mmol/L,每周配制新鲜溶液并在4 ℃保存于棕色瓶中。
3,5-二硝基水杨酸(DNS)试剂:将6.3 g DNS和262 mL 2 mol/L NaOH溶液,加到500 mL含有185 g酒石酸钾钠的热水溶液中,再加5 g结晶酚和5 g Na2SO3,搅拌溶解,冷却后加蒸馏水定容至1 000 mL,贮于棕色瓶中备用。
1.4 主要设备
SHpH系列6通道补料摇床,上海国强生化工程装备有限公司;UV6280型扫描式紫外可见分光光度计,北京普析通用设备有限公司;TGL-16G型高速冷冻离心机,上海安亭科学仪器有限公司;PVDF型超滤膜过滤器,坎普尔设备有限公司。
1.5 实验方法
1.5.1 发酵基础条件
接种量为2 cm2菌苔/瓶,培养温度为25 ℃,摇瓶转速240 r/min。
1.5.2 糖测定方法
葡萄糖和麦芽糖均用DNS法[9]测定。
1.5.3 酸度测定
酸度测定采用中和滴定法[19]。
1.5.4 菌丝生物量测定
菌丝生物量测定采用干质量法[19]。
1.5.5 蛋白质浓度的测定
蛋白质浓度的测定采用考马斯亮蓝染色法[19]。
1.5.6 CPO的酶浓度测定
酶活力是以MCD在被转化成1,1-二甲基-4,4-二氯-3,5-环己二酮时在278 nm处吸光度的减少来确定的[8]。酶活力单位定义:在特定实验条件下,每分钟催化生成1 μmol 1,1-二甲基-4,4-二氯-3,5-环己二酮所需要的酶量为一个酶活力单位(U)。
2 结果与讨论
2.1 糖消耗速率与CPO产量的关联性
分别以麦芽糖和葡萄糖为C源,动态跟踪了C源在发酵过程中的变化与产酶特征关系,对比结果如图1所示。
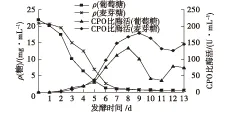
图1 麦芽糖和葡萄糖产酶特征曲线Fig.1 Curves of enzyme production in maltose and glucose
由图1可见:菌体在高浓度C源时期CPO并不合成,当C源浓度下降到10 mg/mL以下时才开始产酶;CPO发酵过程中葡萄糖利用速率比麦芽糖快,但麦芽糖可以使酶浓度增加速度更快更稳定,最高酶产量可到达179.50 U/mL,比葡萄糖的高峰值135 U/mL高出了30%左右,而且产酶高峰期延长1~2 d。虽然发酵后期酶浓度都呈下降趋势,但麦芽糖的波动稍小些。这可能是因为2种糖在细胞体内的产能反应速率不同,麦芽糖利用速率较慢,更有利于调控CPO稳定合成。虽然葡萄糖是CPO发酵普遍采用的C源,但高浓度葡萄糖易对菌体合成CPO产生分解代谢阻遏效应,阻止酶的合成。Axley等[20]认为葡萄糖会抑制CPO酶的mRNA的产生和蛋白质的翻译,从而延缓CPO合成,而麦芽糖的产能速率相对慢些,从而在一定程度上缓和了这种阻遏作用。
2.2 发酵过程pH变化对酶合成量的影响
pH变化是基质利用和菌体代谢共同作用的结果。以麦芽糖为C源考察发酵过程pH的变化与CPO浓度的关系,结果如图2所示。
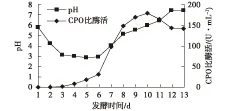
图2 pH与CPO合成的关系Fig.2 The relationship between pH and CPO synthesis
由图2可以发现:pH在开始4 d内呈持续下降趋势,从初始pH 6下降接近3后可以稳定2~3 d,此后开始上升,与此同时,酶的快速合成现象开始出现,直到pH再回升到6时,酶浓度开始出现拐点,由上升到下降。对照图1可以发现,pH上升期与C源消耗密切相关联,酶产量的下降与C源基质的耗尽以及酶活性的稳定有一定相关性。这说明当糖充足时,酸性代谢物质积累使pH不断下降,当糖消耗到不阻遏酶合成时,CPO快速合成,由于此阶段(第6天开始)发酵液中残糖量较低,使得菌体开始利用前期积累的酸性代谢物质,造成发酵液的pH反弹,pH上升到6时,残糖和酸性代谢物质都被消耗完了,酶浓度上升趋缓,产酶期接近结束,由于酶活性的不稳定,就造成了表观酶浓度下降。
2.3 菌丝生物量合成与产酶的同步性分析
生物量能够反映出菌体细胞的生长和生理状态,对判断产酶的特征具有一定的指示作用。测试发酵过程中菌丝生物量形成与产酶量的变化,结果见图3。
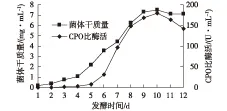
图3 发酵过程中菌丝生物量与产酶量的变化Fig.3 The changes of mycelia biomass and enzyme production in fermentation
从图3可以明显发现,菌丝体质量增加与酶浓度的变化是不完全同步的,菌丝体生长早于酶浓度增长,发酵培养第6天时,生长速率出现拐点,速率趋慢,而此时酶合成速率加快。对照图1,此时培养基中残糖质量浓度只有26.93 mg/mL,说明在维持较低基质浓度水平下就能保持很好的CPO的合成速率。从发酵第10天开始,CPO产量明显下降可能是酶不合成和酶失活双重因素造成的。
综上说明,CPO合成不仅在发酵早期受阻遏,而且在后期受抑制,体现出较为典型的中期合成型特征,这对如何提高菌株产酶提供了重要依据。
2.4 黑色素形成对CPO合成的影响
在CPO发酵过程中一般都会伴随着黑色素的形成,黑色素的形成与产酶是否存在关联性,Pickard等[13]研究了10株产CPO菌株,认为黑色素的形成会影响CPO合成能力。笔者试图验证这一产酶的特征,结果如图4所示。
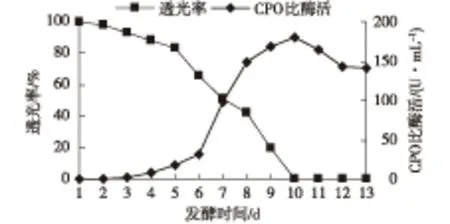
图4 黑色素的产生对酶产量的影响Fig.4 Effects of melanin on enzyme production
由图4可见:菌株在发酵培养基中生长第3天后会产生黑色素,色素产生的时间与菌体产酶几乎是同时发生,这不仅可能会影响酶的合成产量,降低酶的转化率,而且还会使酶的分离纯化变得复杂。随着色素不断增多,发酵液透光度不断下降,发酵液pH和酶产量也开始快速增大,说明黑色素的形成与CPO合成存在伴生现象,但两者形成的速率并不一致。可以推测黑色素物质可能是菌体成熟时期的一种次生代谢物质,与酶的生物合成只是时间上的同步。
2.5 补料发酵对CPO生产稳定化的影响
上述实验确定了Leptoxyphiumfuming菌株产CPO是中间合成产酶类型,针对这种代谢调控类型提出稳定CPO发酵的措施,通过间隙补料麦芽糖,流加稀H3PO4调节pH恒定在5.5~6.0,考察CPO的发酵状况,结果如图5所示。
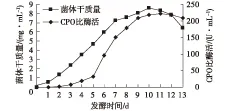
图5 补料发酵状态下的产酶发酵Fig.5 The curve of fermentation condition in fed-batch fermentation
将图5与图1~图4比较可以发现,补料发酵可以增加发酵液中的菌体生物量,最高菌体浓度可以达到8.560 mg/mL,比非补料培养时的7.517 mg/mL增加了约20%;CPO比酶活最高为222.6 U/mL,比非补料培养时的185.456 U/mL也增加了约20%,而且在发酵后期,CPO下降速度有明显的减缓。说明控制C源基质浓度和pH能提高菌体生物量,增加CPO的合成能力,对CPO的活力衰减速度有一定的缓和作用,但不能完全防止酶活力损失。
3 结 论
探究了关联发酵状态的几组重要参数变化特征,分析过程变化与发酵产酶的相关性,明确CPO发酵过程中慢速C源麦芽糖更有利于调控菌体的CPO稳定合成。过程pH波动与C源消耗密切相关,对产酶期有明显的指示性作用。将生物量及耗糖曲线与产酶特征比较,认为该菌株产CPO为中期合成类型。同时,笔者认为黑色素物质的形成可能是菌体合成的一种次生代谢物质,与酶的生物合成只是时间上的同步。基于几组参数对CPO合成特征的影响实验,改进了发酵C源基质和pH的调控方法,明显提高了CPO产量和稳定化程度。此论可以为氯过氧化物酶的高效率生产提供参考。
[1] Hager L P,Lakner F J,Basavapathruni A.Chiral synthons via chloroperoxidase catalysis[J].J Mol Catal B:Enzymatic,1998,5(1/2/3/4):95-101.
[2] Andrew S B A,Schmidt A S,Asenjo J A.Correlation for the partition behavior of proteins in aqueous two-phase systems:effect of surface hydrophobicity and charge[J].Biotechnol Bioeng,2005,90(3):380-390.
[3] Patil G, Raghavarao K S M S.Aqueous two-phase extraction for purification of C-phycocyanin[J].Biochem Eng J,2007,34(2):156-164.
[4] Osborne R L, Raner G M, Hager L P,et al.C.fumagochloroperoxidase is also a dehaloperoxidase:oxidative dehalogenation of halophenols[J].J Am Chem Soc,2006,128(4):1036-1037.
[5] Morris D R,Hager L P.Chloroperoxidase Ⅰ:isolation and properties of the crystalline glycoprotein[J].J Biol Chem,1966,241:1763-1768.
[6] Dugad L B, Wang X,Wang C C, et al.Proton nuclear overhauser effect study of the heme active site structure of chloroperoxidase[J].Biochemistry,1992,31(6):1651-1655.
[7] Colonna S,Gaggero N,Manfredi A,et al Enantioselective oxidations of sulfides catalyzed by chloroperoxidase[J].Biochemistry,1990,29(46):10465-10468.
[8] Colonna S,Gaggero N,Casella L,et al.Chloroperoxidase and hydrogen peroxide:an efficient system for enzymatic enantio- selective sulfoxidations[J].Tetrahedron Asymmetry,1992,3(1):95-106.
[9] Van Deurzen M P,Remkes I J,van Rantwijk F,et al.Chloroperoxidase catalyzed oxidation int-butyl alcoh/water mixtures[J].J Mol Catal A:Chem,1997,117:329-337.
[10] Chayen N E,Saridakis E.Comparative studies of protein crystallization by vapor-diffusion and microbatch techniques[J].Acta Crystallogr D:Biol Crystallogr,1998,45:8-15.
[11] Allenmark S G,Andersson M A.Chloroperoxidase-catalyzed asymmetric synthesis of series of aromatic cyclic sulfoxides[J].Tetrahedron Asymmetry,1996,7(4):1089-1094.
[12] Carmichael R D,Jones A,Pickard M A.Semicontinuous and continuous of chloroperoxidase byCaldariomycesfumagoimmobilized inκ-carrageenan[J].Appl Environ Microbiol,1986,51(2):276-280.
[13] Pickard M A.A defined growth medium for the production of chloroperoxidase byCaldariomycesfumago[J].Can J Microbiol,1981,27(12):1298-1305.
[14] 张丽华,智丽飞,蒋育澄,等.氯过氧化物酶稳定化技术及其应用[J].生命的化学,2007,27(4):349-351.
[15] 智丽飞,蒋育澄,胡满成,等,氯过氧化物酶在手性有机合成中的应用[J].化学进展,2006,18(9):1150-1156.
[16] Clutterbuck P W,Mukhopadhyay S L,Oxford A E,et al.Studies in the biochemistry of micro-organisms:(A) a survey of chlorine metabolism by moulds.(B) caldariomycin,C5H8O2Cl2,a metabolic product ofCaldariomycesfumagoworonichin[J].Biochem J,1940,34(5):664-677.
[17] Yazbik V,Ansorge-Schumacher M.Fast and efficient purification of chloroperoxase fromC.fumago[J].Process Biochem,2010,45(1):279-283.
[18] 孙凌燕.氯过氧化物酶的发酵条件优化[D].上海:上海师范大学,2009.
[19] Hallenberg P F,Hager L P.Purification of chloroperoxidase fromCaldariomycesfumago[J].Methods Enzymol,1978,52(7):521-529.
[20] Axley M J,Kenigsberg P,Hager L P.Fructose induces and glucose represses chloroperoxidase[J].J Biol Chem,1986,261(32):15058-15061.
(责任编辑 管 珺)
Correlation of fermentation parameters in chloroperoxidase production
LI Meimei,DAI Jiawei,LI Xinguo,CHEN Jun,WU Xiaqin
(College of Life and Environment Science,Shanghai Normal University,Shanghai 200234,China)
We correlated fermentation parameters of chloroperoxidase (CPO) fermentation to study the relationship between enzyme yield and the parameters.The experimental results show that maltose,a slow carbon source,is more conducive to control CPO synthesis than glucose in the CPO fermentation process. CPO concentrations reach 179.50 U/mL,when maltose is used,higher than that of glucose (135 U/mL). The fluctuation of pH is closely related to carbon consumption.Based on the pattern of growth,glucose consumption and enzymatic production,CPO synthesis is parallel to growth.The black pigment is a by-product in the secondary metabolism, indicating of the maturation period of the cell,and it is parallel to enzyme synthesis.Carbon source matrix and pH in fermentation have effect on CPO production.
Leptoxyphiumfumago; chloroperoxidase;fermentation;connectional analytical
10.3969/j.issn.1672-3678.2014.06.005
2013-11-15
国家自然科学基金(50678102,50978164);上海师范大学科技基金(SK201228)
李梅梅(1990—),女,江苏盐城人,硕士研究生,研究方向:微生物分子生物学; 陈 军(联系人),副教授,E-mail:cj7206@shnu.edu.cn
Q814.4
A
1672-3678(2014)06-0023-04

