菌种保藏方法对裂殖壶菌生长及发酵性能的影响
胡学超,张 丽,任路静,纪晓俊,黄 和
(南京工业大学生物与制药工程学院,南京211800)
菌种保藏方法对裂殖壶菌生长及发酵性能的影响
胡学超,张 丽,任路静,纪晓俊,黄 和
(南京工业大学生物与制药工程学院,南京211800)
考察保护剂、保藏温度及预冷冻方法对Schizochytriumsp.HX-308菌种存活率及发酵性能保持的影响。结果显示:在-80 ℃低温保藏6个月后,渗透性保护剂的细胞存活率均比非渗透性保护剂高了5%,其中用60%(质量分数)海藻糖的保护剂最终的株细胞存活率达到80.02%,明显优于其他保护剂。采用液氮-196 ℃保藏菌种(两步预冷冻法、60%海藻糖保护剂),存储6个月后存活率高达90.70%,生物量、油产量和二十二碳六烯酸(DHA)产量分别达到了61.65、26.41和11.10 g/L,为最优的保藏方法,为裂殖壶菌的实验室研究及工业化生产提供了一种长期安全的保藏法。
裂殖壶菌;DHA;菌种保藏;保护剂
二十二碳六烯酸(C22:6,DHA)是一种重要的ω-3型长链多不饱和脂肪酸,在促进脑细胞生长发育、提高视力以及预防心脑血管疾病等方面具有显著功效[1-2],被科学家誉为“脑黄金”。迄今为止,DHA生产菌主要为破囊壶菌、裂殖壶菌等海生真菌和海生异养微藻。其中,裂殖壶菌(Schizochytriumsp.)属于真菌门(Eumycoat)、卵菌纲(Oomycetes)、破囊壶菌科(Thraustochytriaceae),其具有生长速度快、易于培养、细胞内脂肪酸和DHA含量高等优势,已被证实为理想的DHA生产菌株[3]。
菌种保藏是微生物研究中的一项基础工作,对于微生物发酵的科研和生产,菌种具有优良的发酵性能是至关重要的。目前,微生物培养过程中避免不了频繁的连续传代,有些特殊的菌种更需要间断性的活化培养来维持其细胞生物活性。但这种频繁的接种,不仅会增加菌种被污染的可能性,而且大大提高菌种基因突变[4]。因此,选择一种较持久并能最大限度保持细胞特性,并降低甚至阻断这种遗传漂变的保藏方法显得尤为重要。现在微生物保藏的方法主要有传代法、干燥法、冷冻法及冷冻干燥法,其中后两者是应用最广也是最长期安全的方法。Samuele等[5]探究了白腐真菌低温甘油管保藏、低压冷冻保藏和液氮保藏法3种保藏法对菌种性能的影响,结果证明前两者的保藏方法更适合白腐真菌的保藏。马学斌等[6]探讨了不同保藏方法对海洋细菌的长期保存效果,结果发现10%脱脂乳和 35%甘油肉汤对海洋细菌的长期保存效果较好。
本文将主要从保藏温度、保护剂类型和预冷冻方法3个方面,详细探讨不同的冷冻保藏方法对Schizochytriumsp.HX-308存活率和发酵参数的影响,并从理论上解释这些因素对细胞保藏过程中的作用,为寻求一种最佳的保藏方法以减缓Schizochytriumsp.HX-308菌种的退化速度提供指导。
1 材料与方法
1.1 菌种
裂殖壶菌Schizochytriumsp.HX-308,笔者所在实验室自主筛选获得,保藏在中国典型培养物保藏中心(保藏号CCTCC M 209059)。
1.2 培养基
种子培养基(g/L):NaCl 15、MgSO4·7H2O 5、KCl 2、CaCl21、NaHCO30.5、KH2PO44、酵母膏 2、谷氨酸钠10、葡萄糖 40。
发酵培养基(g/L):Na2SO415、MgSO4·7H2O 5、KCl 2、(NH4)2SO42、KH2PO44、酵母膏 2、谷氨酸钠10、葡萄糖 100。
以上培养基都在121 ℃、30 min条件下灭菌,并以体积分数为0.2%的量向培养基中分别添加质量浓度为50、50和0.25 mg/mL的维生素B1、B6和B12母液,终质量浓度分别为 0.1、0.1 mg/mL和0.5 μg/mL。
1.3 培养方法
种子和发酵培养方法参照文献[7]。
1)不同保护剂的考察 将活化好的菌株与配制好的不同保护剂按体积比1∶ 1的比例加入到菌株保藏管中,混匀后置于-80 ℃超低温冰箱中保藏。
2)不同保藏温度的考察 将活化好的菌株与40%甘油保护剂按1∶ 1的比例加入到菌株保藏管中,混匀后置于-80 ℃超低温冰箱和-196 ℃液氮中保藏。
3)-196 ℃液氮保藏法的优化 将活化好的菌株与保护剂按1∶ 1的比例加入到菌株保藏管中混匀。一组直接置于-196 ℃液氮中保藏;另一组先于4 ℃冰箱中存放30 min,再将保藏管放入-80 ℃冰箱中存放12 h,最后将冻存管投入-196 ℃液氮中保藏。
1.4 分析方法
发酵液中葡萄糖和谷氨酸钠浓度采用SBA-40C型生物传感仪(山东省科学院生物研究所)进行分析检测。细胞干质量的测定和油脂提取方法参照文献[8];脂肪酸甲酯制备及气相色谱分析方法参照文献[9]。
细胞存活率测定参照文献[5],采用台盼蓝染色法进行。具体方法为吸取50 μL细胞悬液到EP管内,加入台盼蓝染色液50 μL,轻轻吹打混匀,3~5 min(染色时间不宜过长)后用血细胞计数板计数。
细胞存活率=(细胞总数-蓝色细胞数)/细胞总数×100%。
2 结果与讨论
2.1 -80 ℃超低温保藏下保护剂对Schizochytrium sp.HX-308菌种存活率的影响
在菌种保藏过程中,冷冻保护剂起到保护细胞免受冷冻损伤的重要作用。它可以改变细胞周围的物理、化学环境,减少不必要的力学损伤,从而最大限度地保持细胞的生理和生物活性[10]。冷冻保护剂按其对细胞作用的部位,可以分为渗透性保护剂和非渗透性保护剂。渗透性保护剂一般都是一些小分子物质,如甘油、二甲基亚砜(DMSO)、单糖、二糖和氨基酸等,它们可以渗透到细胞内部;非渗透性保护剂一般是一些大分子物质,如蛋白质、多聚糖和聚乙二醇等,它们不能渗透到细胞内部,只能作用于细胞表面[11]。
根据Schizochytriumsp.HX-308菌种的细胞特性,笔者选取了这两类保护剂中几种代表性的保护剂,探讨这些保护剂及其不同浓度对菌种的影响,结果见表1。由表1可以看出:保藏1个月后,渗透性保护剂和非渗透性保护剂的菌种平均存活率分别为92.48%和89.69%;保藏6个月后,渗透性保护剂的菌种平均存活率在75%,而非渗透性保护剂的菌种平均存活率仅为70%,而且前者的存活率下降速率比后者高了2.02%。由此可以发现,在-80 ℃超低温保藏下,渗透性保护剂的保持效果较优于非渗透性保护剂。这主要是因为,渗透性保护剂含有较多的羟基,不仅能与细胞表面的自由基结合,形成保护层,还能渗透到细胞内部结合自由水,减少了冰晶形成,从而对细胞内部起到保护作用,降低了力学损伤对细胞造成的破坏[12]。
在2种渗透性保护剂中,40%(体积分数)甘油和60%(质量分数)海藻糖的保藏效果为较佳。6个月后菌种存活率最高,分别为75.26%和80.02%;存活率下降比率也最慢,分别仅为4.12%和3.33%。在2种非渗透性保护剂中,30%(体积分数)聚乙二醇20 000的保藏效果较佳,6个月后菌种存活率和存活率下降比率分别为72.23%和4.63%。综合以上结果发现,60%海藻糖的保藏效果最佳。这主要是因为,海藻糖属于半渗透性保护剂,只能渗透到细胞壁,胞内的水形成部分冰晶,使保护剂的局部浓度增大,从而提高了保护剂玻璃化的温度,这样保藏环境就较容易达到玻璃化状态,而玻璃化状态是最稳定的状态,能很好地保护细胞,保持其生理生化活性[13]。
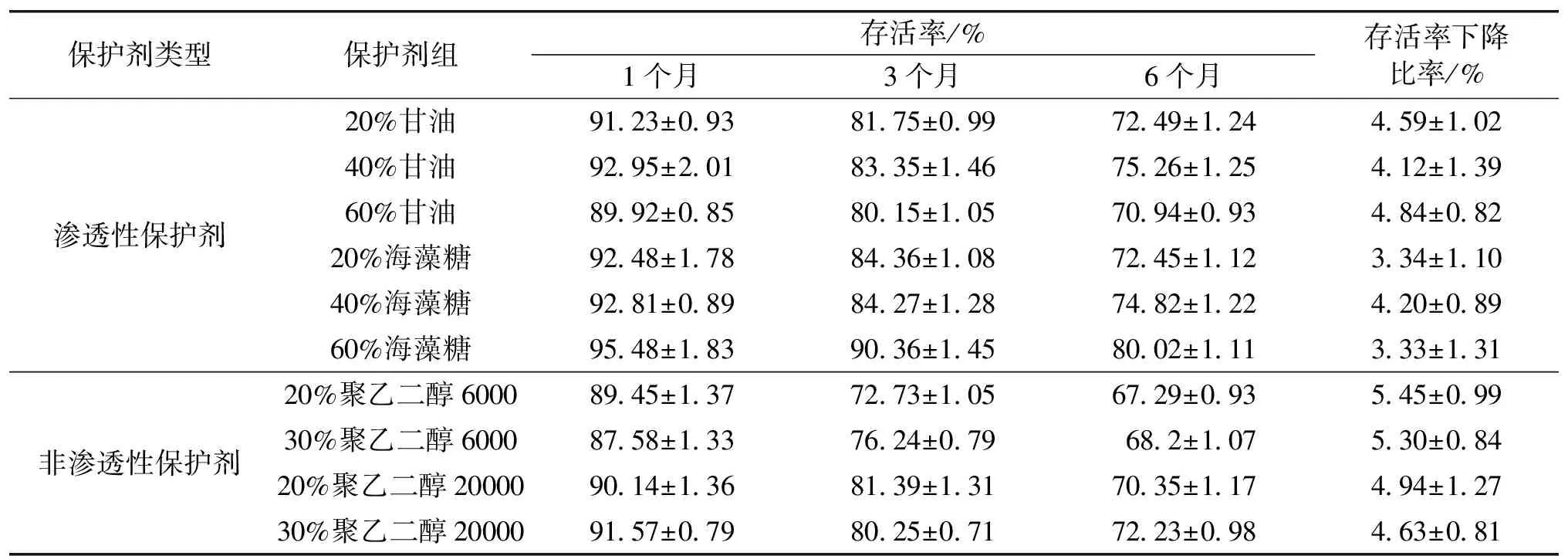
表1 保护剂对Schizochytrium sp.HX-308存活率的影响
2.2 保藏温度对Schizochytrium sp.HX-308菌种性能的影响
细胞保藏在某些低温环境下,其细胞内的生化反应可被减缓甚至停止,从而能长期保持其活性,但在复苏后仍能恢复其正常生理功能。笔者选取了低温为-20 ℃、-80 ℃和液氮-196 ℃,探讨保藏6个月后,菌种存活率及发酵性能的差异,结果见表2。由表2可以看出:保藏6个月后,-80 ℃保藏的菌种的存活率最高达到75.26%,同时相应的存活率下降比率也最低为4.12%。可是,笔者也发现一个不寻常的现象,液氮-196 ℃保藏的菌种,在这6个月的保藏中,存活率呈直线下降趋势,到6个月后,菌种基本全部死亡。
不同保藏温度对Schizochytriumsp.HX-308菌种发酵性能的影响如图1所示。由图1可知:保藏6个月后,-80 ℃保藏的菌种的发酵生物量、DHA产量稍高于-20 ℃,分别达到了50.91和10.70 g/L。同样也发现,液氮-196 ℃保藏的菌种在6个月后,菌种的基本发酵性能也基本退化,无法进行发酵生产。
王华等[14]研究发现,液氮-196 ℃保藏是目前微生物保藏中公认的最安全、最有效的长期保藏方法。但在本试验中,液氮-196 ℃保藏菌种基本都死亡了,有悖于常理。这可能是因为,在液氮-196 ℃保藏的处理方法是将菌种和保护剂直接投入液氮中保藏,这将使细胞瞬间处于一个极低的环境,并且这种冷冻速率随机性大、不稳定,这就一方面导致胞外的水分大量结冰,胞内水分外渗,细胞皱缩变形;另一方面,导致细胞内的自由水瞬间形成大量的冰晶,这些冰晶极大地破坏了细胞内的超微结构。结合这两方面的原因,导致了对细胞形成了致命性的力学损伤[15-17]。
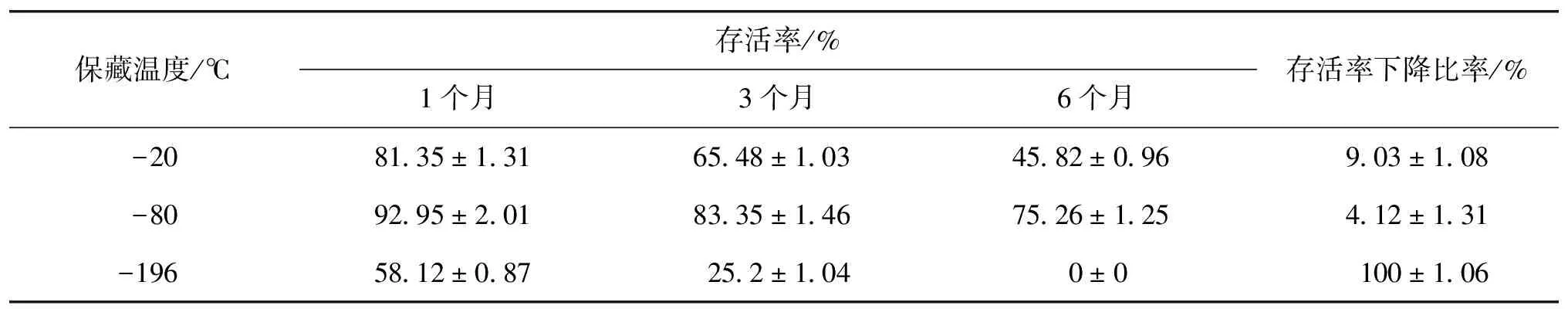
表2 保藏温度对Schizochytrium sp.HX-308菌种存活率的影响
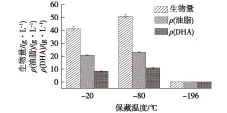
图1 保藏温度对Schizochytrium sp.HX-308菌种发酵性能的影响Fig.1 Effects of preservation temperature on fermentation performance of Schizochytrium sp.HX-308
2.3 液氮-196 ℃保藏法的优化研究
基于2.2中液氮-196 ℃保藏法菌种全部死亡的现象,因此有必要对液氮保藏进行优化。一方面,采用分步预冷冻法:先将装有按一定比例混合的菌种和保护剂的保藏管置于4 ℃预冷冻30 min,再将保藏管置于-80 ℃预冷冻12 h,最后将保藏管投入液氮-196 ℃中长期保藏。另一方面,优化保护剂:根据2.1中的结果,分别选取保藏效果较佳的一个渗透性保护剂海藻糖和非渗透性保护剂PEG20000以及两者混合的混合保护剂。
6个月后,菌种存活率及发酵性能结果如图2所示。由图2可知:采用两步预冷冻法后,菌种的存活率明显提高,6个月后存活率基本上都在75%以上,其中60%海藻糖保藏的菌种存活率最高,达到了90.70%,平均比其余3种保护剂高了13.06%,其平均存活率下降比率也最低,仅为1.67%;同时60%海藻糖的菌种的最终发酵指标生物量、油产量和DHA含量较其他保护剂也稍高,分别为61.65、26.41和11.10 g/L。因此,在液氮-196 ℃中,采用60%海藻糖作为保护剂的两步预冷冻法,保藏效果较好,为裂殖壶菌的实验室研究及工业化生产提供了一种长期安全的保藏法。
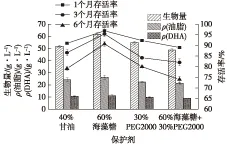
图2 保护剂对Schizochytrium sp.HX-308菌种存活率及发酵性能的影响Fig.2 Effects of protectants on survival rate and fermentation performance of Schizochytrium sp.HX-308
3 结 论
考察了不同保护剂、不同保藏温度及不同预冷冻方法对Schizochytriumsp.HX-308菌种存活率及发酵性能保持的影响。在-80 ℃低温保藏下,不同保护剂对Schizochytriumsp.HX-308菌种保藏效果存在着明显的差异。渗透性保护剂的细胞存活率比非渗透性保护剂高5%,其中60%海藻糖最终的菌种存活率达到了80.02%,明显优于其他保护剂。采用60%海藻糖为保护剂,结合两步预冷冻法,菌种在液氮-196 ℃环境下保藏6个月后存活率可达到90.70%,生物量、油产量和DHA产量无明显改变,分别达到了61.65、26.41和11.10 g/L。本文提出一种适于裂殖壶菌的-196 ℃液氮保藏法,为长期保藏Schizochytriumsp.菌种并降低其优良发酵性能的退化提供了技术指导。
[1] Lauritzen L,Hansen H S,Jorgensen M H,et al.The essentiality of long chainn-3 fatty acids in relation to development and function of the brain and retina[J].Prog Lipid Res,2001,40:1-94.
[2] Nordoy A,Marchioli R,Arnesen H,et al.n-3 Polyunsaturated fatty acids and cardiovascular diseases[J].Lipids,2001,36:127-129.
[3] Yazawa K.Production of eicosapentaenoic acid from marine bacteria[J].Lipids,1996,31(S):S297-S300.
[4] Rodrigo A M.Study of the stability in real time of cryopreserved strain banks[J].Universitas Scientiarum,2004,9(2):35-42.
[5] Samuele V,Sophie R,Francoise M.Vitality and geneticdelity of white-rot fungi mycelia following different methods of preservation[J].Mycol Res,2009,13:1027-1038.
[6] 马学斌,马骢,郭建巍,等.海洋细菌长期保存方法研究[J].海军总医院学报,2009,22(3):132-134.
[7] 任路静,魏萍,冯云,等.生物素和浅蓝菌素添加对裂殖壶菌发酵产DHA的影响[J].生物加工过程,2012,10(1):42-45.
[8] Ren L J,Huang H,Xiao A H,et al.Enhanced docosahexaenoic acid production by reinforcing acetyl-CoA and NADPH supply inSchizochytriumsp.HX-308[J].Bioproc Biosyst Eng,2009,32:837-843.
[9] Ren L J,Ji X J,Huang H,et al.Development of a stepwise aeration control strategy for efficient docosahexaenoic acid production bySchizochytriumsp.[J].Appl Microbiol Biotechnol,2010,87(5):1649-1656.
[10] 许倩,张兰威,于鹏.几种保护剂对液氮冷冻处理的保加利亚乳杆菌细胞的冻伤保护[J].食品科学,2006(9):37-40.
[11] Yukie M S.Survival curves for microbial species stored by freeze-drying[J].Cryobiology,2006,52:27-32.
[12] Takao T,Kazuyo Y.Effect of trehalose on the spawn storage in some edible mushroom fungi(2):effect on preservation in the freezer[J].Mycoscience,2003,44:71-74.
[13] Safronova V I,Novikova N I.Comparison of two methods for root nodule bacteria preservation:lyophilization and liquid nitrogen-freezing[J].J Microbiol Methods,1996,24:231-237.
[14] 王华,杜立业,李华.微生物液氮超低温保存研究进展[J].食品与生物技术学报,2011,30(1):1673-1689.
[15] Nsabimana E,Kisidayova S,Macheboeuf D,et al.Two-step freezing procedure for cryopreservation of rumen ciliates,an effective tool for creation of a frozen rumen protozoa bank[J].Appl Environ Microb,2003,69(7):3826-3832.
[16] Brian P P,Kenneth R D.Cryopreservation ofChlamydomonasreinhardtii: a cause of low viability at high cell density[J].Cryobiology,2009,58:103-109.
[17] 刘宏娟,刘德华,钟建江.不同渗透压调节剂对Candidakrusei生理代谢的影响[J].微生物学通报,2005,32(6):32-36.
(责任编辑 荀志金)
Effects of different strain preservation methods on cell growth andfermentation performance of Schizochytrium sp.
HU Xuechao,ZHANG Li,REN Lujing,JI Xiaojun,HUANG He
(College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
The effects of cryoprotectants,preservation temperature and different pre-freezing methods on the survival and the fermentation ofSchizochytriumsp.HX-308 were investigated.Results of different cryoprotectants showed that cell survival rate when using permeable protective agent was 5% higher than that of unpermeable protective agent after preserved 6 months at -80 ℃. Highest cell survival rate of 80.02% was obtained when using 60% trehalose. In addition,further increase of cell survival rate up to 90.70% was obtained when using a two-step pre-freezing method and 60% trehalose as the cryopretectant after 6 months at -196 ℃.Cell dry weight,lipid yield and docosahexaenoic acid(DHA) content reached 61.65 g/L,26.41 g/L and 11.10 g/L,respectively.This preservation method was proved to be the best method and could be used as a long period and safe method for the laboratory research and industrial production ofSchizochytriumsp.
Schizochytriumsp.;docosahexaenoic acid;strain culture;cryoprotectants
10.3969/j.issn.1672-3678.2014.06.003
2013-07-19
国家高技术研究发展计划(863计划)(2012AA021704);国家科技支撑计划(2011BAD23B03);江苏省自然科学基金(BK2012424)
胡学超(1983—),男,湖北荆州人,硕士研究生,研究方向:化学工程;任路静(联系人),讲师,E-mail:renlujing@njtech.edu.cn
Q815
A
1672-3678(2014)06-0013-05

