水牛奶酪蛋白胶束结构的荧光光谱研究
杨同香,陈俊亮,吴孔阳,李全阳,李智丽,康怀彬
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.广西大学轻工与食品工程学院,广西 南宁 530004;3.洛阳师范学院生命科学学院,河南 洛阳 471022)
水牛奶酪蛋白胶束结构的荧光光谱研究
杨同香1,2,陈俊亮1,吴孔阳3,李全阳2,李智丽1,康怀彬1
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.广西大学轻工与食品工程学院,广西 南宁 530004;3.洛阳师范学院生命科学学院,河南 洛阳 471022)
利用内源荧光团色氨酸(Trp)和外源荧光探针8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)的荧光特性对水牛奶酪蛋白胶束结构进行研究。结果表明:当蛋白质质量浓度较低时,酪蛋白胶束结构变化不明显,而较高的蛋白质质量浓度会破坏其胶束结构,使其疏水基团暴露;此外,在离子强度较大、pH值较低条件下,对酪蛋白胶束结构影响较大,使酪蛋白疏水基团暴露,酪蛋白微球先膨胀后聚集并形成酪蛋白胶束。
酪蛋白;胶束结构;荧光光谱
酸乳凝胶主要组分是蛋白质,牛奶中蛋白质以酪蛋白和乳清蛋白为主,其中酪蛋白占牛奶总蛋白含量的80%,乳清蛋白占20%。酪蛋白在酸乳凝胶制作过程中逐渐酸化,变性并发生聚集,最终形成立体网状的胶束结构。目前,有关荷斯坦牛奶酪蛋白的分离[1-3]和结构解析[4-6]等研究已经相当成熟,但是,胶束粒度分布与离子强度大小间的关系尚不清楚[7],且对水牛奶酪蛋白的研究还较少。
蛋白质各级结构解析的主要方法有圆二色谱法、荧光光谱、X射线衍射法、动态光散射技术等。荧光光谱主要通过疏水性表征蛋白质的胶束结构[8]。蛋白质形成三维结构的主要原因是氨基酸残基的非极性侧链之间疏水相互作用的结果,疏水相互作用对于维持蛋白质胶束结构具有重要作用[9]。基于前期对水牛奶及水牛奶酸乳凝胶的研究[10],本实验主要通过荧光光谱分析影响蛋白结构变化的主要因素(pH值、离子强度和蛋白质量浓度)对酪蛋白胶束结构的影响。
1 材料与方法
1.1 材料与试剂
水牛奶购于广西南宁市联利奶水牛农民专业合作社,其他试剂等均为分析纯级及以上。
1.2 仪器与设备
超速冷冻离心机 美国Backman公司;Hettich离心机 德国Hettich公司;UV-1601紫外分光光度计、RF-5301PC荧光光度计 日本岛津公司;PB10 pH计德国Sartorius公司。
1.3 方法
1.3.1 酪蛋白的分离纯化
分离方法按照文献[1-3]。
1.3.2 荧光光谱法表征水牛奶酪蛋白(casein,CN)胶束结构
将酪蛋白冻干样品用适量0.01 mol/L的磷酸盐缓冲液溶解,样品预处理同圆二色谱处理方法。配制溶液后,恒温静置 1.0 h,在激发波长为295 nm,测定酪蛋白在波长300~420 nm范围内的荧光发射光谱[11]。
1.3.2.1 pH值对酪蛋白Trp荧光特性的影响
用0.01 mol/L磷酸缓冲溶液将样品的pH值分别调至5.0、5.5、6.0、6.5、7.0、7.5,在室温(25±1)℃下,测定其内源荧光强度,研究pH值对酪蛋白Trp荧光性的影响。
1.3.2.2 离子强度对酪蛋白Trp荧光特性的影响
用NaCl溶液将样品的离子强度调节至0.01、0.05、0.08、0.1、0.2、0.3 mol/L,在室温(25±1)℃、pH 7.0条件下测定其内源荧光强度,研究离子强度对酪蛋白Trp荧光性的影响。
1.3.3 ANS荧光光谱法表征水牛奶CN胶束结构
荧光探针选用8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS),取一定量的样品用各自的缓冲溶液稀释蛋白质量浓度在0.04~0.20 mg/mL之间。 再加入20 μL的8 mmol/L的ANS荧光探针,混匀,避光15 min,然后于荧光分光光度计下比色,将激发波长设为390 nm,发射波长设为470 nm,测定样品的荧光强度[12]。
1.3.3.1 质量浓度对酪蛋白ANS荧光性的影响
配制CN样品质量浓度依次为12.5、25、50、100、200、400 μg/mL,离子强度为0.01 mol/L,pH 7.0,然后测定其荧光强度。
1.3.3.2 pH值对酪蛋白ANS荧光特性的影响
用0.01 mol/L磷酸缓冲溶液将样品的pH值分别调至5.0、5.5、6.0、6.5、7.0、7.5,在室温(25±1) ℃下测定其外源荧光强度,研究pH值对酪蛋白外源荧光性的影响。
1.3.3.3 离子强度对酪蛋白ANS荧光特性的影响
用NaCl溶液将样品的离子强度调节至0.01、0.05、0.08、0.1、0.2、0.3 mol/L,在室温(25±1)℃下测定其外源荧光强度,研究离子强度对酪蛋白外源荧光性的影响。
2 结果与分析
2.1 Trp荧光光谱法表征水牛奶CN胶束结构
色氨酸(Trp)是一种很强的内源荧光团,对蛋白所处的极性环境具有高度敏感性。Trp位于折叠蛋白的内部疏水基团核心位置,最大发射波长约在335 nm。当Trp所处微环境从疏水性环境变为极性环境时,往往会使其本身的荧光发射波长发生红移,同时伴随着发射强度的降低。αs-CN有两个Trp残基,β-CN和κ-CN只有一个Trp残基。对Trp进行荧光检测可以有效地反映蛋白结构的变化[13]。
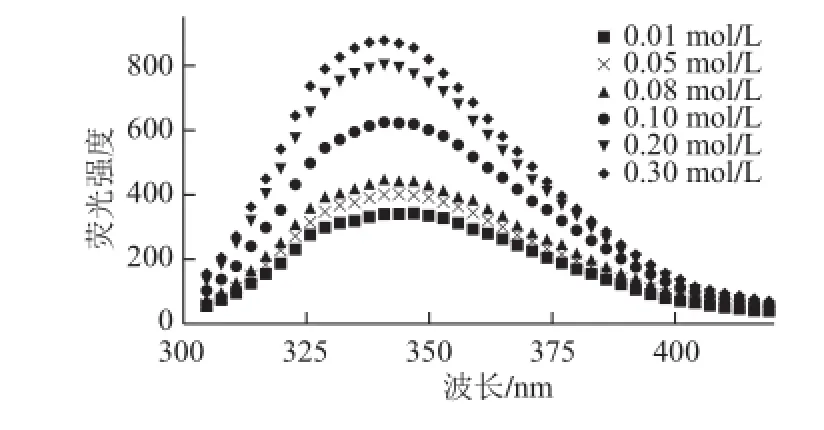
图1 水牛奶酪蛋白的内源荧光性受环境中离子强度的影响Fig.1 Intrinsic tryptophan fluorescence intensity of buffalo casein as a function of ionic strength
检测水牛奶CN内源荧光特性受环境中离子强度的影响。如图1所示,当离子强度由0.01 mol/L增至0.05 mol/L时,CN内源荧光强度(If)轻微增大,但荧光最大发射波长(λmax)并未变化,这表明分子内部发生膨胀,给予酪氨酸(Tyr)和Trp等基团自由转动度,这个过程由疏水性基团的水合作用完成,此时Trp依然保持在内部疏水环境中。当CN微环境中离子强度从0.1 mol/L增至0.3 mol/L时,CN内源If发生显著增大,同时伴随着λmax的蓝移(从346 nm蓝移至340 nm)。这表明Trp内部的刚性环境减弱,芳香族氨基酸残基暴露,Trp残基埋藏在疏水环境中,分子内Trp猝灭作用减弱,导致CN分子结构被破坏。随环境中离子强度增大,CN发生折叠聚集,分子结构改变。Stănciuc[14]和Chakraborty[15]等对荷斯坦牛奶apo-α-乳白蛋白的研究指出λmax发生移动,则表示Trp内部疏水环境发生改变。
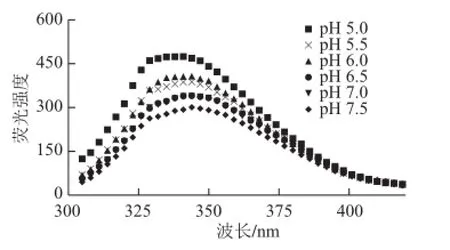
图2 水牛奶酪蛋白的内源荧光性受环境中pH值的影响Fig.2 Intrinsic tryptophan fluorescence intensity of buffalo casein as a function of pH
由图2可知,CN周围环境由中性变弱碱性时,由于负电荷的加入,使分子内部静电斥力增大,If降低。天然状态下的Trp很可能被周围的氨基酸分子淬灭了荧光特性[14,16]。而随着pH值的降低,使得CN所处微环境的H+浓度增大,中和CN表面的负电荷,使其分子间的静电斥力减弱,CN微球发生膨胀,形成熔球态。CN周围环境在pH 6.0时,其If相对与天然状态约增加了20%,伴随分子内色氨酸淬灭和λmax的蓝移。这表明色氨酸内部的刚性环境减弱,芳香族氨基酸残基暴露,Trp残基埋藏在疏水环境中。随着CN微环境中pH值进一步降低,其相互作用也进一步加强,被其他氨基酸遮蔽的Trp残基暴露,从而使内源If发生显著增大,λmax发生蓝移。pH 5.0条件下,Trp残基分子内淬灭,使If相对与天然状态约增加了39%,λmax从346 nm 蓝移至 339 nm,表明色氨酸残基进一步暴露在疏水性环境中。pH值的降低使CN分子结构发生改变。刘燕[17]对荷斯坦牛奶酪蛋白的Trp荧光性进行了研究,指出在pH 5.5~10范围内,随着pH值的升高,蛋白分子上的部分氨基酸去质子化现象导致CN胶束形成过程中,氢键和盐键作用遭到破坏,同时分子间较强的静电斥力使胶束结构变得疏松。
2.2 ANS荧光光谱法表征水牛奶CN胶束结构
ANS是一种疏水荧光染料,作为外源的荧光团追踪监测蛋白密集程度。相对于ANS在水溶液中的荧光参数,在存在蛋白的溶液中,ANS优先占据溶液中易于接触到的蛋白疏水基团或簇,If产生显著增大,并伴随着其最大发射波长(通常为530 nm蓝移至470 nm)明显的蓝移。ANS荧光参数可以有效的检测蛋白结构的变化,尤其是疏水区域暴露于溶剂中的中间态的变化[15,18]。为进一步探究CN微环境变化对其结构的影响,利用ANS荧光光谱分析水牛奶CN在不同蛋白质量浓度、不同pH值和离子强度环境条件下荧光特性的变化。

图3 水牛奶酪蛋白的外源荧光性受蛋白质量浓度的影响Fig.3 Relative fluorescence intensity of buffalo casein as a function of protein concentration
如图3所示,在水牛奶C N质量浓度较低时(12.5~25 μg/mL),ANS的最大发射波长并未发生蓝移,表明CN单体分子的疏水区域无法与ANS 分子结合,只有当CN分子的疏水区自组装形成胶束时,才能提供 ANS 结合所需的疏水结合位点。随着CN质量浓度的增加(50~400 μg/mL),ANS荧光明显发生蓝移,从504 nm蓝移至472 nm,并伴随着If的显著增强。CN外源荧光强度随蛋白质量浓度的增大呈线性增大趋势,拟合直线方程为:y = 0.979 5x + 46.082(R² = 0.998 3)。这主要是由于CN质量浓度的增大,使得CN分子的疏水区域自组装成胶束,更多的疏水基团暴露,从而使得ANS与疏水基团的结合位点增多,进而表现为ANS发生蓝移,同时伴随着If的增强。
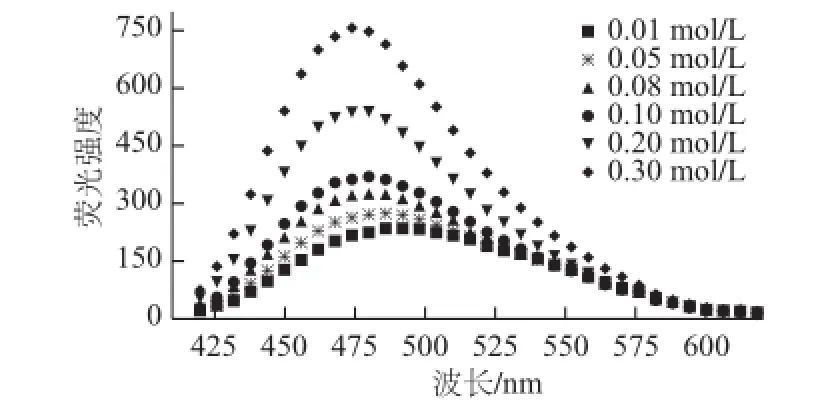
图4 水牛奶酪蛋白的外源荧光性受环境离子强度的影响Fig.4 Relative fluorescence intensity of buffalo casein as a function of ionic strength

图5 水牛奶酪蛋白的外源荧光性受环境pH值的影响Fig.5 Relative fluorescence intensity of buffalo casein as a function of pH
ANS的荧光特性与其所处微环境的极性有密切关系。ANS本身并无强荧光性,只有ANS与蛋白疏水基团相结合时,荧光性才会增强。由图4、5可知,随着CN环境中离子强度增大、pH值降低,ANS荧光强度呈显著增强趋势。酪蛋白ANS荧光图谱随着CN微环境中离子强度的增大发生明显蓝移,并伴随着If的显著增大。CN微环境中的离子强度0.30 mol/L时的荧光强度较离子强度0.10 mol/L时约升高了47%。这表明随着离子强度的增大,伴随着水合作用,CN暴露出更多的疏水基团,使ANS获得更多的结合位点,从而使其If增强。随着溶液pH降低,ANS荧光图谱If显著增大,同时λmax发生稍许蓝移。在pH 7.0~7.5时,ANS的If与λmax并未发生明显变化,说明CN天然状态下,由于静电斥力的作用,疏水基团被遮蔽,形成较好的动态平衡。随着pH值降低,CN微环境中的质子增多,逐渐中和CN表面的负电荷,使静电斥力减弱,而疏水基团暴露。随着pH值进一步降低,静电斥力继续减弱,当pH值达到5.0时,暴露出更多的疏水基团,从而使其疏水性增强。
3 讨 论
Liu Yan等[19]指出酪蛋白胶束主要通过静电作用、疏水相互作用和氢键作用而形成,Chakraborty等[15]认为低pH值条件下,酪蛋白胶束由静电相互作用形成,而且还指出酪蛋白分子先重排再展开,不同于其他球蛋白的构象变化。有研究表明酪蛋白胶束在大约pH 5.90时,已出现模糊的凝胶轮廓。在pH 5.40~5.35 时,乳蛋白开始聚合,且随着pH值的降低,凝胶应力也逐步增强[20]。还有研究指出,在酸性条件下CN胶束主要是依靠疏水作用和氢键作用形成[17]。另外研究发现离子对酪蛋白胶束形成产生一定影响,在荷斯坦牛奶中添加NaCl可以提高酪蛋白胶束的水合作用[21-23]。而Huppertz等[24]认为NaCl改变了酪蛋白胶束的理化性质是由于NaCl中和了酪蛋白胶束表面电荷,从而改变了酪蛋白胶束的稳定性。本实验发现,随着水牛奶CN质量浓度的增大,CN环境中离子强度的增大、pH值的降低,在静电作用、疏水相互作用和氢键作用下,水牛奶CN分子结构遭到破坏,CN发生折叠、重排,疏水基团暴露,ANS荧光强度呈显著增强趋势。这些结果表明改变酪蛋白所处环境的离子强度、pH值均可影响酪蛋白胶束的结构。水牛奶酸化形成凝胶过程中,其胶束结构均发生变化,进而影响酸乳凝胶的质构特性,且乳蛋白含量对其凝胶形成也有一定的影响。
[1] CAYOT P, COURTHAUDON J L, LORIENT D. Purif cation of αs-, β- and κ-caseins by batchwise ion-exchange separation[J]. Journal of Dairy Research, 1992, 59(4): 551-556.
[2] PLANK J, ANDRES P R, KRAUSE I, et al. Gram scale separation of casein proteins from whole casein on a source 30Q anion-exchange resin column utilizing fast protein liquid chromatography (FPLC)[J]. Protein Expression and Purif cation, 2008, 60(2): 176-181.
[3] 赵正涛, 李全阳, 赵红玲, 等. 牛乳中酪蛋白的分离及其特性的研究[J].食品与发酵工业, 2009, 35(1): 169-172.
[4] KUMOSINSKI T F, BROWN E M, FARRELL H M J. Threedimensional molecular modeling of bovine caseins: αs1-casein[J]. Journal of Dairy Science, 1991, 74(9): 2889-2895.
[5] KUMOSINSKI T F, BROWN E M, FARRELL H M J. Threedimensional molecular modeling of bovine caseins: an energyminimized β-casein structure[J]. Journal of Dairy Science, 1993, 76(4): 931-945.
[6] KUMOSINSKI T F, BROWN E M, FARRELL H M J. Threedimensional molecular modeling of bovine caseins: κ-casein[J]. Journal of Dairy Science, 1991, 74(9): 2879-2887.
[7] OBISPO S L. Effect of sodium chloride addition during diaf ltration on the solubility of milk protein concentrate[D]. California: California Polytechnic State University, 2010.
[8] 吴新. 脉冲电场对牛乳蛋白功能性质和结构的影响[D]. 无锡: 江南大学, 2009.
[9] 王璋, 许时婴, 汤坚. 食品化学[M]. 北京: 中国轻工业出版社, 2007.
[10] YANG Tongxiang, LI Hong, WANG Fang, et al. Effect of cattle breeds on milk composition and technological characteristics in China[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(6): 896-904.
[11] QI P X, ONWULATA C I. Physical properties, molecular structures, and protein quality of texturized whey protein isolate: effect of extrusion moisture content[J]. Journal of Dairy Science, 2011, 94(5): 2231-2244.
[12] KATO A, NAKAI S. Hydrophobicity determinated by a f uorescence frobe method and its correlation with surface properties of proteins[J]. Biochim et Biophysica Acta, 1980, 624 (1): 13-20.
[13] FARRELL H M J, JIMENEZ-FLORES R, BLECK G T, et al. Nomenclature of the proteins of cows’ milk-sixth revision[J]. Journal of Dairy Science, 2004, 87(6): 1641-1674.
[14] STĂNCIUC N, RÂPEANU G, BAHRIM G, et al. pH and heatinduced structural changes of bovine apo-α-lactalbumin[J]. Food Chemistry, 2012, 131(3): 956-963.
[15] CHAKRABORTY A, BASAK S. pH-induced structural transitions of caseins[J]. Journal of Photochemistry and Photobiology B: Biology, 2007, 87(3): 191-199.
[16] KELKAR D A, CHAUDHURI A, HALDAR S, et al. Exploring tryptophan dynamics in acid-induced molten globule state of bovine alpha-lactalbumin: a wavelength-selective fluorescence approach[J]. European Biophysics Journal, 2010, 39(10): 1453-1463.
[17] 刘燕. 酪蛋白胶束结构与功能特性的研究[D]. 扬州: 扬州大学, 2007.
[18] SEMISOTNOV G V, RODIONOVA N A, RAZCULYAEV O I, et al. Study of the “Molten Globule” intermediate state in protein folding by a hydrophobic f uorescent probe[J]. Biopolyiners, 1991, 31(1): 119-128.
[19] LIU Yan, GUO Rong. pH-dependent structures and properties of casein micelles[J]. Biophysical Chemistry, 2008, 136(2/3): 67-73.
[20] CHARDOT V, BANON S, MISIUWIANIEC M, et al. Growth kinetics and fractal dimensions of casein particles during acidification[J]. Journal of Dairy Science, 2003,85(1): 8-14.
[21] MAO X Y, TONG P S, GUALCO S, et al. Effect of NaCl addition during diafiltration on the solubility, hydrophobicity, and disulfide bonds of 80% milk protein concentrate powder[J]. Journal of Dairy Science, 2012, 95(7): 3481-3488.
[22] GRUFFERTY M B, FOX P F. Effect of added NaCl on some physicochemical properties of milk[J]. Irish Journal of Food Science and Technology, 1985, 9(1): 1-9.
[23] RAY C L, MAUBOIS J L, GAUCHERON F, et al. Heat stability of re constituted casein micelle dispersions: changes induced by salt addition[J]. Lait, 1998, 78(4): 375-390.
[24] HUPPERTZ T, FOX P F. Effect of NaCl on some physico-chemical pr operties of concentrated bovine milk[J]. International Dairy Journal, 2006, 16(10): 1142-1148.
Structure of Casein Micelles from Buffalo Milk Determined by Fluorescence Spectroscopy
YANG Tong-xiang1,2, CHEN Jun-liang1, WU Kong-yang3, LI Quan-yang2, LI Zhi-li1, KANG Huai-bin1
(1. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China; 2. Institute of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China; 3. College of Life Science, Luoyang Normal University, Luoyang 471022, China)
The structure of casein micelles from buffalo milk was analyzed by fluorescence spectroscopy with the extrinsic fluorescent probe 8-anilino-1-naphthalenesulfonic acid (ANS) and the intrinsic fluorophore tryptophan (Trp). The results showed that the effect of buffalo milk protein at low concentration on the structure of casein micelles was obvious. As the structure of casein micelles was broken, the hydrophobic groups were exposed to the solvent with high protein concentration. In addition, the structure of casein micelles was influenced evidently at higher ionic strength and lower pH level, which could cause exposure of hydrophobic groups of casein to the solvent so that the casein micelles could be formed by the expansion and aggregation of casein microspheres.
casein; micelles structure; fluorescence spectroscopy
TS252
A
1002-6630(2014)23-0084-04
10.7506/spkx1002-6630-201423017
2013-12-18
河南科技大学博士科研启动基金项目(09001785);国家自然科学基金面上项目(31071576)
杨同香(1984—),女,讲师,博士,研究方向为乳品科学与工程。E-mail:txyamy@163.com

