茶叶酸性多糖的分离、纯化及其理化性质研究
丁婧思,聂少平,冯燕玲,王君巧,阙志强
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 3300 47)
茶叶酸性多糖的分离、纯化及其理化性质研究
丁婧思,聂少平*,冯燕玲,王君巧,阙志强
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 3300 47)
采用水提醇沉法从采自江西婺源的粗老绿茶中提取茶叶多糖,通过Sevag法脱蛋白得到精制茶叶多糖,应用高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)分析茶叶多糖纯度并测定其分子质量,进一步测定茶叶多糖的糖含量、蛋白质含量、单糖组成、糖醛酸组成等理化指标,同时对其进行紫外和红外光谱扫描,考察其光谱 性质。结果表明:该茶叶多糖组分为均一性高的酸性多糖组分,分子质量 约为289 734 D,糖含量为55.1%,蛋白质含量为1.8%。该茶叶多糖酸性组分主要由鼠李糖、核糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,其物质的量比为1.26∶3.18∶4.08∶1.00∶1.52∶3.92,该茶叶多糖酸性组分中含有大量半乳糖醛酸,含量为33.5%。
茶叶;酸性多糖;理化性质;单糖组成;分子质量
茶叶(Camellia sinensis (L.) O. Kuntze)为山茶科山茶属植物茶的芽叶[1],作为茶叶的故乡,中国是世界产茶大国。茶叶是世界三大植物性饮料之一[2],广受人们的关注和青睐。茶最初作药用,后来发展为饮料。长期研究表明,茶叶含有多种活性化学成分,具有抗氧化、降血脂、降血压、降血糖、抗肿瘤等药理作用[3-7]。
茶多糖是从茶叶中提取出的茶叶多糖复合物的简称,其化学本质是一类与蛋白质结合在一起的多糖或糖蛋白。茶多糖具有多种生物活性,结构复杂,其突出功效是降血糖[8-10],并且在增强机体免疫功能、抗氧化、防血凝及防血栓等方面也有明显功效[5,11-15]。本实验以江西婺源粗老绿茶为原料,利用水提醇沉法提取茶叶粗多糖,并通过Sevag法脱蛋白以纯化多糖,应用高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)分析茶叶多糖纯度并测定其分子质量,进一步测定茶叶多糖的糖含量、蛋白质含量、单糖组成、糖醛酸组成等理化指标,同时对其进行紫外和红外光谱扫描考察其光谱性质,为茶多糖的结构及活性研究提供基础。
1 材料与方法
1.1 材料与试剂
粗老绿茶,购自江西婺源。
透析袋(8 000~14 000 D)、考马斯亮蓝G-250(进口分装) 美国Sigma公司;Dextran T-10、Dextran T-40、Dextran T-70、Dextran T-500、蓝色葡聚糖 美国Lazard Freres公司;D-葡萄糖、D-甘露糖、D-半乳糖、D-阿拉伯糖、D-木糖、D-核糖、L-岩藻糖、L-鼠李糖、D-半乳糖醛酸、D-葡萄糖醛酸 上海国药试剂公司;牛血清白蛋白 美国Amersco公司;无水乙醇、浓硫酸、苯酚、咔唑、磷酸、吡啶、三氟乙酸、盐酸羟胺、醋酸酐、溴化钾 中国西陇化工股份有限公司。
1.2 仪器与设备
FA1104电子天平 梅特勒-托利多仪器(上海)有限公司;HH-4数显恒温水浴锅 国华电器有限公司;EYELAN-1001旋转蒸发仪 厦门精艺兴业科技有限公司;SHZ-IIIB循环水真空泵 上海亚荣生化有限公司;TGL-5-A离心沉淀机 上海飞鸽系列离心机厂;ALPHA1-2冷冻干燥机 德国Martin Christ公司;Millio-Q超纯水仪 美国Millipore公司;MD-200氮气吹扫仪 杭州奥盛仪器有限公司;TU-1900双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;Agilent6890气相色谱仪、Agilent 1260 高效液相色谱仪美国Agilent Technologies公司;Nicolet FT-IR 5700傅里叶红外光谱仪 美国Thermo Electron公司。
1.3 方法
1.3.1 茶叶多糖的提取及纯化
称取100 g干燥的茶叶粉碎,用体积分数80%的乙醇溶液浸泡24 h,去除小分子杂质和脂溶性物质。用双层滤布过滤,滤渣置于通风橱中挥干乙醇后,按料水比1∶10在95 ℃热水中浸提4 h,间歇搅拌,双层滤布过滤,滤渣重复提取一次,合并两次滤液,旋转蒸发真空浓缩(55 ℃、50 r/min、真空度-0.01 MPa),使浓缩液约为原体积的1/8,向浓缩液中加入无水乙醇使乙醇体积分数达到80%,于4 ℃冰箱中醇沉24 h,离心分离(4 800 r/min、15 min),弃去上清液,将所得沉淀依次用丙酮、无水乙醚各洗涤两次,将沉淀冷冻干燥得茶叶粗多糖。
将干燥的粗多糖按料水比1∶10用蒸馏水溶解,采用Sevag法脱蛋白[16-17],加入约为样液体积1/3量的氯仿-正丁醇混合液(4∶1,V/V)剧烈振摇10 min,离心分离(4 800 r/min、15 min),弃去水层与有机溶液交界处的蛋白质层。对上清液反复脱蛋白3 次,然后将所得溶液依次用自来水透析48 h,蒸馏水透析24 h,透析完成后,将透析袋内溶液进行真空浓缩(55 ℃、50 r/min、真空度-0.01 MPa),冷冻干燥得精制茶叶多糖。
1.3.2 茶叶多糖纯度及分子质量测定
分别配制质量浓度均为1 mg/mL的葡萄糖、Dextran T-10、Dextran T-40、Dextran T-70、Dextran T-500、蓝色葡聚糖标准溶液各2 mL,并过0.22 μm滤膜制得一系列标准品。称取一定量的茶叶多糖配成质量浓度为1 mg/mL的溶液,过0.22 μm滤膜后同上述标准品一起按如下色谱条件过柱。
色谱条件:色谱柱:UltrahydrogelTMLinear Column(7.8 mm×300 mm,10 μm);流动相:0.02% NaN3溶液;流速:0.6 mL/min;检测器:示差检测器和紫外检测器;柱温:35 ℃;进样量:10 μL。
以分配系数(Kav)为纵坐标,以葡聚糖标准品分子质量对数值(lgMw)为纵坐标建立回归方程,得到标准曲线方程为:Kav=1.647 2-0.292 6 lgMw,R2=0.993。
1.3.3 糖及蛋白质含量测定
采用苯酚-硫酸法[18],以葡萄糖为标准,在490 nm波长处测定糖含量;采用考马斯亮蓝法[19],以牛血清白蛋白为标准,在595 nm波长处测定蛋白质含量。
1.3.4 单糖组成分析
[20-21]的方法,首先将制得的茶叶多糖经过2 mol/L三氟乙酸(trif uoroacetic acid,TFA)进行水解,然后将水解得到的单糖混合物衍生为糖腈乙酸酯,用气相色谱(gas chromatography,GC)测定单糖组成。在相同的条件下,分别称取8 种单糖标准品(D-葡萄糖、D-甘露糖、D-半乳糖、L-岩藻糖、D-阿拉伯糖、D-木糖、D-核糖、L-鼠李糖)各2 mg,配制成糖腈乙酸酯衍生物混合标准品进行气相色谱分析。
1.3.5 糖醛酸组成分析
按参考文献[22]中的方法,称取5 mg样品,用2 mol/L硫酸对其进行水解,将制备好的水解样品进行离子色谱仪分析,同时分别配制1、2、4、6、8 μg/mL的糖醛酸混合标准品进行离子色谱仪分析。
离子色谱条件:色谱柱:CarboPac PA 20(3 mm× 150 mm,6.5 μm)分析柱和CarboPac PA 20(3 mm× 30 mm,6.5 μm)保护柱;流速:0.5 mL/min;检测器:金电极;柱温:30 ℃;检测器温度:35 ℃;淋洗液梯度洗脱条件见表1。

表1 离子色谱淋洗条件Table1 Ion chromatography elution parameters
1.3.6 紫外光谱扫描分析
将茶叶多糖配成质量浓度为0.1 mg/mL左右的溶液,采用紫外-可见分光光度计在190~400 nm波长范围内进行光谱扫描分析。
1.3.7 红外光谱扫描分析
取干燥的茶叶多糖1 mg,与KBr研磨后制成透明压片,采用Nicolet 5700傅里叶变换红外光谱仪在400~4 000 cm-1区内进行红外光谱扫描分析[23]。
2 结果与分析
2.1 多糖提取纯化得率
经计算,本实验精制茶叶多糖的得率为1.52%。
2.2 茶叶多糖纯度及分子质量
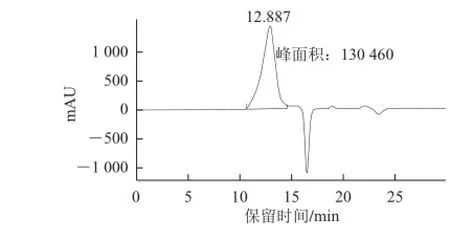
图1 茶叶多糖示差检测高效凝胶色谱Fig.1 HPGPC of TP S with a RI detector

图2 茶叶多糖紫外检测高效凝胶色谱Fig.2 HPGPC of TPS with a UV detector
由图1、2可知,茶叶多糖示差检测和紫外检测色谱峰均为均匀对称单一峰,即该茶 叶多糖为均一糖蛋白。由标准曲线方程计算得到茶叶多糖的分子质量约为289 734 D,与Guo Li等[24]研究报道的2.287×105~2.762×105D接近,但与Nie Shaoping等[20]研究报道的126 513 D有一定差别,结果的差异可能是茶叶的品种、产地、多糖纯化方式不同等原因所致。
2.3 糖及蛋白质含量
测得茶叶多糖的糖含量为55.1%,蛋白质含量为1.8%。样品的糖含量不高,可能是由于样品中还含有部分糖醛酸。
2.4 单糖组成分析
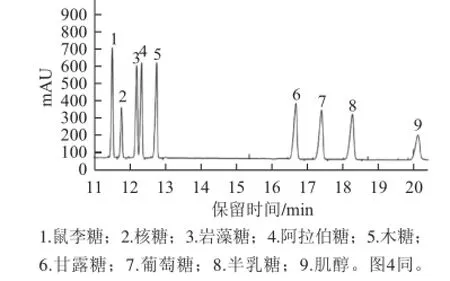
图3 标准单糖糖腈乙酸酯衍生物的GGCC图Fig.3 GC chromatogram of monosaccharide standards
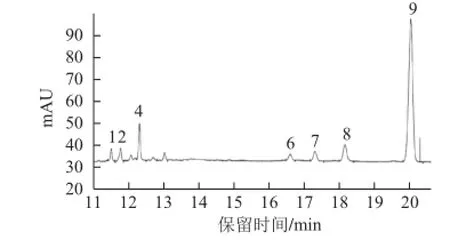
图4 茶叶多糖水解后单糖糖腈乙酸酯衍生物的GGCC图Fig.4 GC chromatogram of TPS
由图3可知,8种单糖标品衍生物得到了较好的分离。由图4可知,茶叶多糖主要由鼠李糖、核糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖6 种单糖组成,其物质的量比为1.26∶3.18∶4.08∶1.00∶1.52∶3.92。阿拉伯糖是主要单糖,其次是半乳糖和核糖。其单糖的种类和数目与文献[25-27]报道的有一定差异,这可能是由于茶叶的种类和分析方法不同所致。
2.5 糖醛酸组成分析
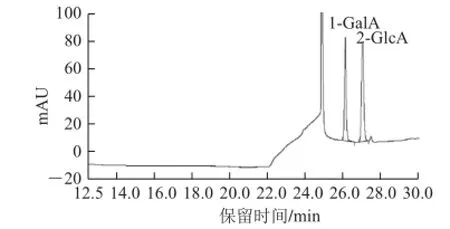
图5 糖醛酸标准品离子色谱图Fig.5 Ion chromatogram of uronic acid standards
由图5可知,按照出峰时间从前往后对应的糖醛酸依次为半乳糖醛酸(GalA)、葡萄糖醛酸(GlcA)。根据保留时间可知茶叶多糖中主要含有GalA(图6),跟据峰面积计算可知样品中半乳糖醛酸含量为33.5%。依据2.3节糖、蛋白质含量测定结果,样品中糖、糖醛酸、蛋白质三者相加含量超过90%,表明所制得精制茶叶多糖纯度高,杂质少。
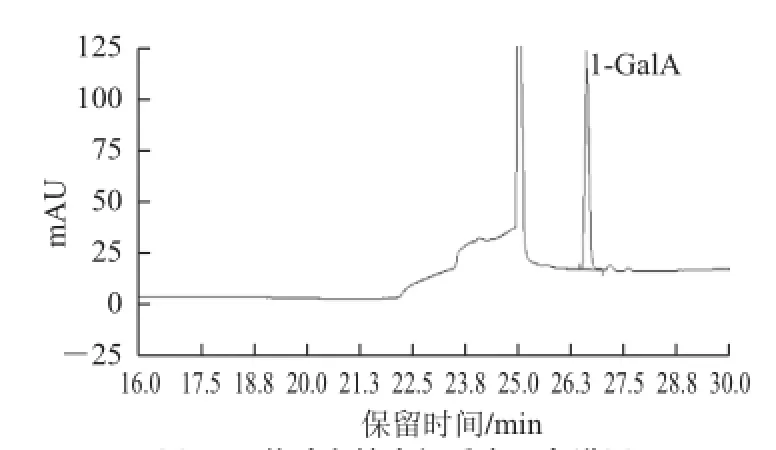
图6 茶叶多糖水解后离子色谱图Fig.6 Ion chromatogram of TPS
2.6 紫外光谱分析结果
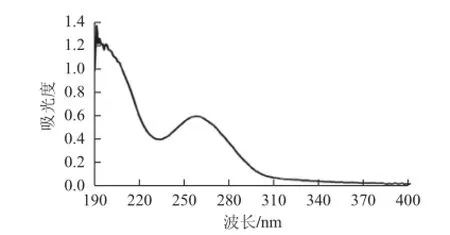
图7 茶叶多糖溶液的紫外扫描图谱Fig.7 UV scanning spectrum of TPS
由图7可知,茶叶多糖在260~280 nm波长范围内有一定吸收,推测样品中仍含有部分蛋白质。
2.7 红外光谱分析结果

图8 茶叶多糖的红外光谱Fig.8 IR spectrum of TPS
红外光谱是一种有效研究分子官能团特征的手段,该方法所需样品数量少,操作简便。从图8可以得出茶叶多糖的以下结构特征:在3 600~3 300 cm-1之间出现的宽而强的吸收峰应该是糖类的O—H伸缩振动,在3 000~2 800 cm-1之间出现的吸收峰应该是甲基或亚甲基C—H的伸缩振动,在1 400~1 200 cm-1之间的一组峰应该是糖类的C—H变角振动,由以上3 点可以初步判定该组分为糖类物质。1 744.8 cm-1处的吸收峰表明茶叶多糖中含有—COO基团,1 638.6 cm-1处应该是酰胺羧基 的特征吸收峰,1 421.7 cm-1处应该是N—H的变角振动,962.8 cm-1处应该是脱氧糖的次甲基的摇摆振动,882.6 cm-1处应该是吡喃型半乳糖 或甘露糖的特征吸收峰。
上述分析表明所制备茶叶多糖是一种酸性多糖,与蛋 白质缀合,含有吡喃环。
3 结 论
本研究采用水提醇沉法从茶叶中提取粗多糖,通过Sevag法对粗 多糖脱蛋白得到精制多糖,得率为1.52%。通过HPGPC的分析,表明所制备茶叶多糖为均一多糖。测得组分中糖含量为55.1%,蛋白质含量为1.8%。以已知分子质量的Dextran T-10、DextranT-40、Dextran T-70、Dextra n T-500、蓝色葡聚糖为标准品作标准曲线,测得茶叶多糖的分子质量约为289 734 D。GC分析确定茶叶多糖主要由鼠李糖、核糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,其物质的 量比为1.26∶3.18∶4.08∶1.00∶1.52∶3.92。离子色谱分析得出茶叶多糖中含 有半乳糖醛酸,含量为33.5%。
参考文献:
[1] 李敏. 茶叶的化学成分研究[D]. 沈阳: 沈阳药科大学, 2008: 4.
[2] 申明月, 聂少平, 谢明勇. 茶叶多糖的纯化及其光谱特性研究[J]. 食品科学, 2007, 28(11): 39-43.
[3] 林智. 茶叶的保健作用及其机理[J]. 中国食物与营养, 2003(4): 49-52.
[4] 姜玉芳, 吴远双, 宋玉竹, 等. 茶叶减肥降脂机制研究进展[J]. 食品工业科技, 2013, 34(14): 353-357.
[5] 刘军海, 李志洲. 茶叶中有效成分应用及其提取工艺研究进展[J].食品研究与开发, 2007, 28(3): 173-177.
[6] SHARMA V, RAO L J M. A thought on the biological activities of black tea[J]. Critical Reviews in Food Science and Nutrition, 2009, 49(5): 379-404.
[7] 张建海, 冯彬彬. 茶叶主要药效成分的药理作用及应用[J]. 宁夏农林科技, 2012, 53(1): 84-85.
[8] 谢明勇, 聂少平. 茶叶多糖的研究进展[J]. 食品与生物技术学报, 2006, 25(2): 108-114.
[9] 崔宏春, 余继忠, 黄海涛, 等. 茶多糖的提取及分离纯化研 究进展[J].茶叶, 2011, 37(2): 67-71.
[10] 邓泽元, 褚芳. 茶叶对老龄大鼠血糖、血脂及抗氧化功能的影响[J].茶叶科学, 1998, 18(1): 74-77.
[11] WANG Yuanfeng, WEI Xinlin, JIN Zhengyu. Structure analysis of a neutral polysaccharide isolated from green tea[J]. Food Research International, 20 09, 42(5): 739-745.
[12] NIE Shaoping, X IE Mingyong. A review on the isolation and structure of tea polysaccharides and their bioactivities[J]. Food Hydrocolloids, 2011, 25(2): 144-149.
[13] CHEN Haixia, ZHANG Min, XIE Bijun. Components and antioxidant activity of polysaccharide conjugate f rom green tea[J]. Food Chemistry, 2005, 90(1): 1 7-21.
[14] CAI Weirong, XIE Liangliang, CHEN Yong, et al. Purification, characterization and anticoagulant activity of the polysaccharides from green tea[J]. Carbohydrate Polymers, 2013, 92(2): 1086-1090.
[15] YANG Liqun, ZHANG Liming. Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J]. Carbohydrate Polymers, 2009, 76(3): 349-361.
[16] 周鹏, 谢明勇, 傅博强, 等. 茶叶粗多糖的提取及纯化研究[J]. 食品科学, 2001, 22(11): 46-47.
[17] 朱玉强. 茶多糖提纯、精制及其生理活性研究进展[J]. 福建茶叶, 2006(3): 12-14.
[ 18] 吴晓鹏, 王一飞, 刘秋英, 等. 苦丁茶多糖的提取分离纯化及部分理化性质研究[J]. 食品与发酵工业, 2007, 33(6): 141-144.
[19] 陈小强, 成浩, 叶阳, 等. 茶多糖纯化组分的理化分析[J]. 中草药, 2009, 39(6): 828-830.
[20] NIE Shaoping, XIE Mingyong, FU Zhihong, et al. Study on the purification and chemical compositions of tea glycoprotein[J]. Carbohydrate Polymers, 2008, 71(4): 626-633.
[21] LV You, YANG Xingbing, ZHAO Yan, et al. Separation and quantification of component monosaccharides of the tea polysaccharides from Gynostemma pentaphyllum by HPLC with indirect UV detection[J]. Food Chemistry, 2009, 112(3): 742-746.
[22] 霍江雷. 茶叶多糖的分离纯化工艺及结构研究[D]. 上海: 上海师范大学, 2012: 24.
[23] 林华娟, 田晓春, 秦小明, 等. 金花茶多糖单一成分的化学结构特征解析[J]. 食品科学, 2013, 34(3): 141-146.
[24] GUO Li, DU Xiangfeng, LAN Jing, et al. Study on molecular structural characteristics of tea polysaccharide[J]. International Journal of Biological Macromolecules, 2010, 4 7(2): 244-249.
[25] GUO Wei, ZHOU Binxing, LUO Ling, et al. Analysis of monosaccharide composition of Pu-erh tea polysaccaride by precolumn derivatization HPL C[J]. Agricultural Science & Technology, 2013, 14(4): 556-558.
[26] 江和源, 陈小强, 寇小红, 等. 茶多糖的分级纯化及组成分析[J]. 茶叶科学, 2007, 27(3): 248-252.
[27] 杨江帆, 郑德勇, 叶乃兴, 等. 乌龙茶多糖的单糖组成及结构的研究[J].茶叶科学技术, 2007(4): 1-3.
Isolation, Purification and Physico-chemical Properties of Acidic Polysaccharides from Green Tea
DING Jing-si, NIE Shao-ping*, FENG Yan-ling, WANG Jun-qiao, QUE Zhi-qiang
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Tea polysaccharides (TPS) were extracted and purified from green tea from Wuyuan of Jiangxi province. The purity and molecular weight (Mw) were determined by high performance gel permeation chromatography (HPGPC). The contents of sugar and protein, monosaccharide compositions, and uronic acid composition were determined as well. UV and IR spectroscopy were used for determining their spectroscopic properties. The results showed that the composition was highly homogeneous acidic polysaccharides. The Mwwas 289 734 D, the content of polysaccharide was 55.1%, and the content of protein was 1.8%. This polysaccharide was mainly composed of rhamnose, ribose, arabinose, mannose, glucose and galactose with a molar ratio of 1.26:3.18:4.08:1.00:1.52:3.92. The major uronic acid was galacturonic acid with a relative content of 33.5%.
tea; acidic polysaccharide; physico-chemical properties; monosaccharide composition; molecular weight
O652.4
A
1002-6630(2014)23-0057-04
10.7506/spkx1002-6630-201423012
2014-06-27
“十二五”国家科技支撑计划项目(2012BAD33B06);国家自然科学基金重点项目(31130041);食品科学与技术国家重点实验室目标导向项目(SKLF-ZZA-201301)
丁婧思(1992—),女,硕士研究生,研究方向为食品化学与分析。E-mail:ding.22@163.com
*通信作者:聂少平(1978—),男,教授,博士,研究方向为食品化学、食品营养与安全。E-mail:spnie@ncu.edu.cn

