多巴胺激动D1受体在戊四氮诱导大鼠癫痫发作中促惊厥作用的研究
王伟文,廖晓阳,王 建,杨正辉,刘 榆
癫痫是一种因大脑局部神经元过度兴奋而导致的异常放电及临床发作为特征的病理状况。纹状体、海马是与癫痫发作密切相关的主要结构,而多巴胺在其中扮演着重要角色[1-2]。抗精神病药物(D2受体阻断剂)所导致个体发生癫痫的易患性增高应该与多巴胺的作用有关[3]。致痫药物戊四氮(PTZ)常被用于诱导成年大鼠全身性癫痫持续状态(SE)模型的制作。然而,迄今为止关于多巴胺及其相应受体在PTZ诱导的癫痫模型中是起抑制作用还是激动作用尚不清楚。即刻早期基因产物Fos在神经元的表达能充分反映活性神经元的分布,因此多年以来就被研究者广泛用作标记活性神经元的标记物[4]。另有研究结果提示,Fos在化学药物诱导的癫痫模型中表达数量与癫痫发作严重程度呈正相关[5]。本研究是在重复给予低剂量PTZ诱导的大鼠SE模型中,通过给予多巴胺选择性地激动D1受体或用SCH23900选择性地阻断D1受体后对诱导大鼠相同癫痫发作分级所需PTZ剂量的比较及与前脑Fos表达的半定量检测的联系来进一步明确多巴胺及其受体在癫痫发作中所扮演的角色。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 二级健康雄性SD大鼠40只,体质量210~240 g,购于四川大学华西医院实验动物中心。
1.1.2 实验药品 PTZ和SCH23900(D1受体阻断剂)购于英国Sigma公司,左旋多巴(L-Dopamine)和舒必利(sulpiride,D2受体阻滞剂)购于上海医药集团股份有限公司。
1.1.3 实验仪器 显微镜由日本奥林巴斯公司生产。
1.2 方法
1.2.1 实验动物分组 按照随机数字表法将大鼠分为3个实验组和1个对照组,每组10只。(1) PTZ组大鼠仅接受重复低剂量的PTZ诱导SE发作,发作2 h后处死;(2) LSP组大鼠首先接受舒必利(20 mg/kg)腹腔注射,15 min后再被给予左旋多巴(50 mg/kg)腹腔注射,15 min后接受重复低剂量的PTZ诱导SE发作,发作2 h后处死;(3) LSSP组大鼠首先接受舒必利(20 mg/kg)+SCH23990(0.75 mg/kg)腹腔注射,15 min后再接受左旋多巴(50 mg/kg)腹腔注射,15 min接受重复低剂量的PTZ诱导SE发作,发作2 h后处死;(4)对照组大鼠接受与PTZ组相同次数相同体积的0.9%氯化钠溶液注射,并在注射完毕2 h后处死。
1.2.2 癫痫模型的制备及发作分级尺度的建立
1.2.2.1 癫痫模型制备 各实验组大鼠均接受重复低剂量的PTZ腹腔注射诱导SE发作。注射方案:首剂按20 mg/kg PTZ腹腔注射,然后每间隔10 min按10 mg/kgPTZ腹腔注射直至SE发生。SE发作特征:大鼠出现连续的强直跌倒发作,时间10~15 s;而后几分钟反复出现头、颈、躯干及四肢的阵挛性发作[7]。大鼠在SE发作后被放回温暖(20 ℃)、安静环境中饲养,在发作2 h后处死[6]。
本文创新点——纹状体、海马是与癫痫发作密切相关的大脑结构,而多巴胺在其中扮演着重要角色。以往的实验性癫痫模型中,多巴胺对癫痫发作的发生、发展是起促进作用还是抑制作用尚存在争议。而关于多巴胺及其相应受体在戊四氮诱导的癫痫模型中所起的作用尚不清楚。本研究是在重复给予低剂量戊四氮诱导的大鼠全身性癫痫持续状态(SE)模型中,通过给予多巴胺选择性地激动D1受体或用SCH23900选择性地阻断D1受体后对诱导大鼠癫痫发作各分级所需戊四氮剂量的比较及其与前脑Fos表达的半定量检测的联系分析,从行为学观察和形态学检测来进一步明确多巴胺及其受体在癫痫发作中所扮演的角色。结果提示:多巴胺激动D1受体对戊四氮诱导的SE发作有促惊厥作用,并贯穿于癫痫的发生、发展的全过程。
1.2.2.2 发作分级尺度的建立 大鼠SE发作严重程度根据Raccine制定标准来分级[7],即:0级,无反应;1级,耳、面部颤搐;2级,全身性波浪状痉挛;3级,肌阵挛性抽搐或后肢抽搐及竖尾;4级,向一侧倾倒;5级,躯体翻转伴全身性阵挛-强直性发作。每次PTZ腹腔注射后,记录注射间隔期10 min内的最高发作分级。
1.2.3 切片制备 大鼠经1%戊巴比妥钠(40 mg/kg)腹腔注射深度麻醉后,予以左心室至升主动脉插管,含40 g/L多聚甲醛的0.1 mol/L磷酸缓冲液(PB,pH 7.4)灌流固定,脑组织在冷冻切片机上行全脑连续冠状切片,收集25 μm厚的组织切片用于免疫组织化学染色。
1.2.4 免疫组织化学染色 各实验组大鼠全脑系列切片行免疫组织化学染色(ABC法),首先一抗(兔抗Fos,Vector,1∶8 000) 4 ℃孵育48 h;其次二抗(驴抗兔生物素标记的IgG,Check,1∶500)室温孵育8 h;最后ABC复合物(Vector,1∶500)室温下孵育2 h,DAB-葡萄糖氧化酶-硫酸镍胺加强法呈色反应20~30 min,组织切片上可见蓝色的阳性产物,切片经晾干、脱水、透明后封片。在Olympus BX-60显微镜下分析观察结果,并采集图像。对照组中用正常兔血清替代一抗,余染色步骤同前。
1.2.5 数据分析 各组诱导不同程度癫痫发作所用PTZ累积剂量,计算平均数。免疫组织化学染色观察各组位于大鼠皮质、海马和纹状体区域的阳性Fos神经元,每只大鼠每个区域挑选8~10张切片(双侧)用以计数。
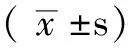
2 结果
2.1 PTZ组、LSP组、LSSP组诱导不同程度癫痫发作所用PTZ累积剂量比较 PTZ组、LSP组、LSSP组诱导不同程度癫痫发作所用PTZ累积剂量比较,差异均有统计学意义(P<0.05);其中LSP组较PTZ组和LSSP组用量降低,差异均有统计学意义(P<0.05);PTZ组与LSSP组比较,差异均无统计学意义(P>0.05)。3组组内比较,诱导不同级别的癫痫发作所用PTZ累积剂量间差异均有统计学意义(P<0.05);不同癫痫发作分级间两两比较,差异均有统计学意义(P<0.05,见表1)。对照组大鼠均无癫痫发作。
2.2 Fos在大鼠皮质、海马及纹状体区域的表达 SE发作2 h后,中-高密集度的Fos在大鼠前脑区域广泛表达,蓝黑色的阳性Fos圆形产物均独特地定位于细胞核上(见图1a′,b′,c′)。在皮质,Fos主要表达分布于Ⅱ、Ⅲ、Ⅴ层(见图1a);而在海马的CA2、CA3及齿状回区是Fos表达的密集区(见图1b);在纹状体Fos呈中等密集度地分布于尾壳核的背内侧部(见图1c)。
2.3 PTZ组、LSP组、LSSP组Fos在皮质、海马及纹状体表达数量比较 SE发作2 h后,PTZ组、LSP组、LSSP组Fos在皮质、海马及纹状体表达数量比较,差异均无统计学意义(P>0.05,见表2)。
3 讨论
本研究结果显示,在重复给予低剂量PTZ所诱导的大鼠SE模型中,诱导不同癫痫发作分级与所用PTZ累积剂量间存在着剂量依赖关系。诱导癫痫发作分级越高,所需PTZ的剂量越大。多巴胺对D1受体的促进作用可以减少诱导同等癫痫发作分级所用PTZ的剂量,多巴胺在PTZ诱导的癫痫模型中具有促进惊厥发作的作用。
以往的实验性癫痫模型中,多巴胺对癫痫发作的发生、发展是其促进作用还是抑制作用尚存在争议[8]。如Barone等[9]提出,在颞叶癫痫动物模型中多巴胺对癫痫发作的行为学改变并不明显,但脑电监测结果显示有促惊厥作用。本研究结果显示多巴胺选择性地激动D1受体对PTZ诱导的大鼠癫痫发作有促进作用。不论是起始阶段小剂量PTZ所诱导的轻微发作(1级),还是后续PTZ累积所致的全面强直发作(5级),多巴胺的介入均可使诱导发作的PTZ剂量减低,而D1受体阻滞剂SCH23900可以阻断这种效应。这一结果从行为学角度提示了多巴胺通过作用D1受体在癫痫的发生、发展过程中的促惊厥作用。
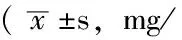
表1 PTZ组、LSP组、LSSP组诱导不同程度癫痫发作所用PTZ累积剂量比较只)
注:与LSP组比较,*P<0.05;与1级比较,△P<0.05;与2级比较,▲P<0.05;与3级比较,☆P<0.05;与4级比较,★P<0.05
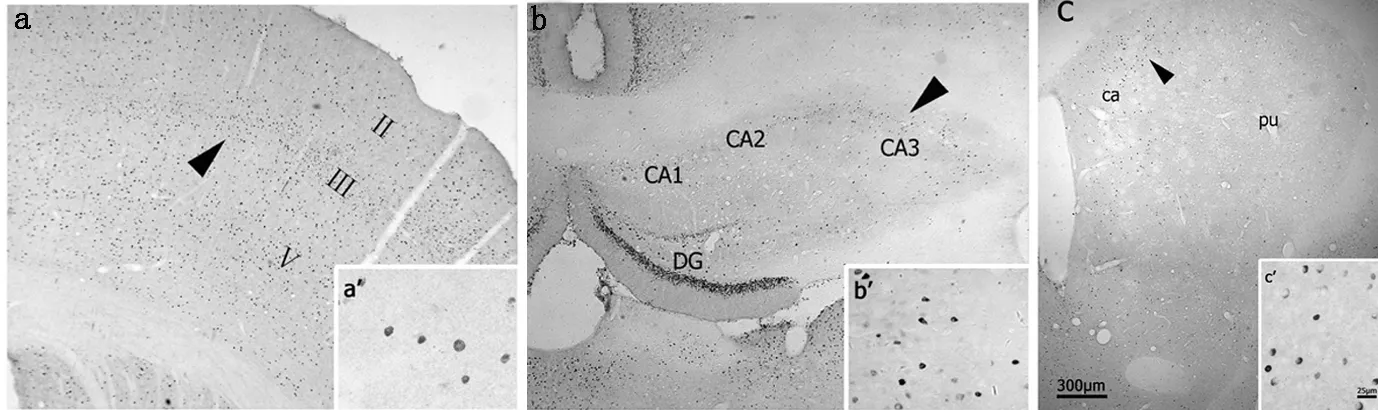
注:a皮质(免疫组织化学染色,×40)、a′皮质(免疫组织化学染色,×400),b海马(免疫组织化学染色,×40)、b′海马(免疫组织化学染色,×400),c纹状体(免疫组织化学染色,×40)、c′纹状体(免疫组织化学染色,×400)
图1 SE发作2 h后Fos在前脑皮质、海马和纹状体的表达分布
Figure1 The distribution of Fos expression in cerebral cortex,hippocampus and corpus striatum at 2 hours after the onset of SE
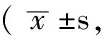
Table2 Comparison of quantity of Fos in cerebral cortex,hippocampus and corpus striatum in PTZ group,LSP group and LSSP group
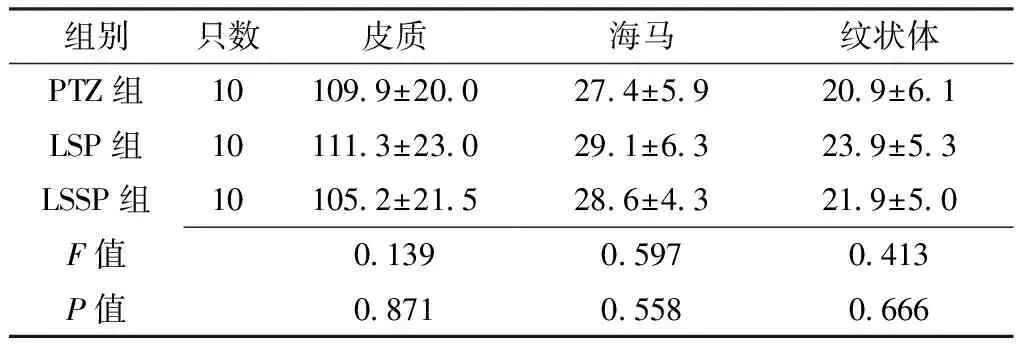
组别只数皮质海马纹状体PTZ组101099±200274±59209±61LSP组101113±230291±63239±53LSSP组101052±215286±43219±50F值013905970413P值087105580666
即刻早期基因产物Fos在神经元的表达能充分反映活性神经元的分布,并且Fos表达的数量在化学药物诱导的癫痫模型中与癫痫发作的严重程度呈正比[10]。长期以来,众多神经科学者认为纹状体、海马是与癫痫活性密切相关的重要结构,但各自在癫痫发作中所扮演的角色尚不清楚。本研究在PTZ诱导的癫痫模型中,通过对Fos在大鼠皮质、海马及纹状体表达分布情况分析显示,在皮质,海马的CA2、CA3,纹状体尾壳核的背内侧部均有高密集度的表达,这一结果进一步证实了皮质、海马和纹状体是癫痫起源、扩展的重要结构组成。因此,多巴胺对D1受体的激动作用同样对PTZ诱导的Fos表达有促进作用,本结果从形态学角度为多巴胺作用D1受体而参与对癫痫发作的调节提供了又一支持点。
总之,多巴胺激动D1受体在PTZ诱导的大鼠SE模型中,通过对癫痫发作分级及大鼠前脑区域Fos的表达分析结果显示,无论从行为学还是形态学角度都提示多巴胺激动D1受体对PTZ诱导的SE有促惊厥作用,并贯穿于癫痫发生、发展的全过程。
1 Rektor I,Kuba R,Brázdil M,et al.Do the basal ganglia inhibit seizure activity in temporal lobe epilepsy? [J].Epilepsy Behav,2012,25(1):56-59.
2 Rocha L,Alonso-Vanegas M,Villeda-Hernández J,et al.Dopamine abnormalities in the neocortex of patients with temporal lobe epilepsy[J].Neurobiol Dis,2012,45(1):499-507.
3 Starr MS.The role of dopamine in epilepsy[J].Synapse,1996,22(2):159-194.
4 Szyndler J,Maciejak P,Turzyńska D,et al.Mapping of c-Fos expression in the rat brain during the evolution of pentylenetetrazol-kindled seizures[J].Epilepsy Behav,2009,16(2):216-224.
5 Nehlig A,Pereira de Vasconcelos AP.The model of pentylentetrazol-induced status epilepticus in the immature rat:short- and long-term effects[J].Epilepsy Research,2006,26(1):93-103.
6 Gubits RM,Hazelton JL,Simantov R.Variations in c-fos gene expression during rat brain development[J].Brain Res,1998,427(2):197-202.
7 Erdtmann-Vourliotis M,Riechert U,Mayer P,et al.Pentylenetetrazole(PTZ)-induced c-fos expression in the hippocampus of kindled rats is suppressed by concomitant treatment with naloxone[J].Brain Res,1998,792(2):299-308.
8 Bourne JA,Fosbraey P,Halliday J.SCH 23390 affords protection against soman-evoked seizures in the freely moving guinea-pig:a concomitant neurochemical,electrophysiological and behavioural study[J].Neuropharmacology,2001,40(2):279-288.
9 Barone P,Palma V,De Bartolomeis A,et al.Dopaminergic regulation of epileptic activity[J].Neurochemistry International,1992,20(Suppl):245S-249S.
10 Andre V,Pineau N,Motte JE,et al.Mapping of neuronal networks underlying generalized seizures induced by increasing doses of pentylenetetrazol in the immature and adult rat:A c-Fos immunohistochemical study[J].Eur J Neurosci,1998,10(6):2094-2106.

