瘢痕疙瘩成纤维细胞低密度培养的克隆能力分析
曲淼武晓莉柴岗
瘢痕疙瘩成纤维细胞低密度培养的克隆能力分析
曲淼武晓莉柴岗
目的比较瘢痕疙瘩成纤维细胞(KFs)和正常真皮成纤维细胞(NFs)间克隆形成能力的差异,探讨瘢痕疙瘩中病理性干细胞是否存在,及其对瘢痕疙瘩发生发展的影响。方法利用酶消化法获得瘢痕疙瘩和正常皮肤组织的原代细胞,以4 000个/皿的密度接种,进行低密度培养,2周后观察细胞克隆的形成及形态变化。结果低密度培养条件下的瘢痕疙瘩成纤维细胞和正常皮肤成纤维细胞都可形成克隆,但KFs可形成明显的克隆集落,NFs形成的克隆不明显且松散。KFs克隆形成率高于NFs,为(0.80±0.21)%,而NFs为(0.18±0.06)%,两者间差异显著(P<0.05)。结论低密度培养条件下,瘢痕疙瘩成纤维细胞的克隆形成能力高于正常皮肤成纤维细胞,可能与瘢痕疙瘩组织中存在病理性瘢痕疙瘩干细胞有关。
瘢痕疙瘩低密度培养克隆形成率瘢痕疙瘩干细胞
瘢痕疙瘩作为一种人类特发的病理性瘢痕,呈浸润性生长,治疗后复发率高,通常被认为是皮肤的良性肿瘤[1-2]。肿瘤干细胞是指肿瘤中存在的少量具有自我更新能力、分化潜能,并能产生异质性肿瘤细胞的细胞[3]。肿瘤干细胞理论认为,肿瘤可能是由肿瘤干细胞产生,而肿瘤干细胞则可能由正常组织干细胞突变形成。从肿瘤和干细胞的角度来研究瘢痕疙瘩,探讨瘢痕疙瘩的病理机制是新的研究思路。由于干细胞最基本的特征是自我更新能力和多向分化能力,本研究将瘢痕疙瘩成纤维细胞(KFs)和正常皮肤成纤维细胞(NFs)进行低密度培养,并比较这两种细胞在克隆形成能力方面的差异,为进一步明确瘢痕疙瘩中是否存在干细胞提供研究基础。
1 材料和方法
1.1 实验主要试剂和仪器
0.2 %Ⅰ型胶原酶(Worthington,USA);0.2%中性蛋白酶(Roche,Germany);磷酸盐缓冲液、0.25%胰蛋白酶(上海思吉生物制品有限公司);胎牛血清(FBS)(上海华美生物工程公司);10%福尔马林、台盼兰(上海试剂厂);Rhodamine B(Sigma,USA);DMEM培养液(Gibco,USA)。
纯水系统(Millipore,USA);恒温CO2培养箱(Forma Scientific,USA);普通台式离心机、高速恒温冷冻离心机(Heraeus,USA);精密天平秤(Shangping,中国);恒温摇床(太仓市华美生化仪器厂);倒置相差显微镜(Olympus,Japan);超净工作台(苏州安泰空气技术有限公司);10 cm培养皿、50 mL离心管、15 mL离心管、200目尼龙滤网(FALCON,USA)。
1.2 方法
瘢痕疙瘩和正常皮肤标本均来源于手术切除的瘢痕和皮肤组织,并记录标本具体资料,如性别、年龄、部位等。在获取标本前,获患者及家属知情同意。本实验采用的正常皮肤标本不包括人包皮来源。
1.2.1 瘢痕疙瘩成纤维细胞获取
瘢痕疙瘩标本以氯霉素冲洗液冲洗3遍,PBS充分振荡洗涤3遍,去除血渍及其他组织碎片;无菌下去除表皮及皮下脂肪组织,将获得的瘢痕疙瘩真皮部分剪至1 mm×1 mm大小,PBS振荡洗涤1遍后用0.2%的Ⅰ型胶原酶,37℃恒温振荡消化,6~8 h后收获真皮层细胞。消化产物以200目尼龙筛过滤,细胞悬液1 500 r/min离心5 min,弃上清。加入PBS振荡混匀,1 500 r/min离心5 min,弃上清;取少量细胞,加入台盼兰溶液进行拒染试验,用血球记数板对活细胞量进行计数。
1.2.2 正常皮肤成纤维细胞获取
标本以氯霉素冲洗液冲洗3遍,PBS充分振荡洗涤3遍,去除血渍及其它组织碎片;无菌下去除皮下组织,并剪至2 mm×2 mm大小,PBS振荡洗涤1遍;加入0.2%的中性蛋白酶4℃消化过夜,无血清DMEM培养液清洗、终止消化,并轻轻揭去表皮层。余下的真皮组织用无菌剪刀剪成l mm×l mm大小组织块,以0.2%的Ⅰ型胶原酶,37℃恒温振荡消化,2~5 h后收获真皮层细胞。消化产物以200目尼龙筛过滤,细胞悬液1 500 r/min离心5 min,弃上清。加入PBS振荡混匀,1 500 r/min离心5 min,弃上清;取少量细胞,加入台盼兰溶液进行拒染试验,用血球记数板对活细胞量进行计数。
1.2.3 KFs和NFs的低密度培养
将两种原代细胞以低糖DMEM培养液重悬,每例标本以4 000个/皿的密度接种至4个10 cm培养皿中,置培养箱中培养。每3天换液一次,并观察细胞生长情况,注意细胞克隆的形成情况。本实验中,共收集5例瘢痕疙瘩和5例正常皮肤标本进行低密度培养。
1.2.4 克隆形成能力检测
一般克隆形成能力检测的时间为3周左右,而我们在2周时即终止培养,目的是在早期比较KFs和NFs低密度培养时克隆形成能力的差异。以PBS冲洗3次,10%福尔马林固定细胞10 min,再以PBS冲洗3次,每皿中加入1 mL Rhodamine B,30 min后以流水小心冲洗,放置晾干,拍照。
1.2.5 克隆形成能力统计
倒置显微镜下观察细胞克隆数,计算克隆形成率(克隆形成率=克隆形成数/接种细胞数×100%),每例标本的克隆形成数为4个培养皿中形成的克隆总数。采用SPSS 19.0软件进行,结果用x±s表示,组间比较采用t检验,P<0.05为有统计学差异。
2 结果
低密度培养条件下,KFs和NFs的克隆形成能力有明显差异。培养2周时,KFs的克隆形成率为(0.80±0.21)%,且克隆较为明显而紧密;而NFs的克隆形成率为(0.18±0.06)%,形成的克隆稀少而松散。两者间差异明显(P<0.05)(表1)(图1,2)。
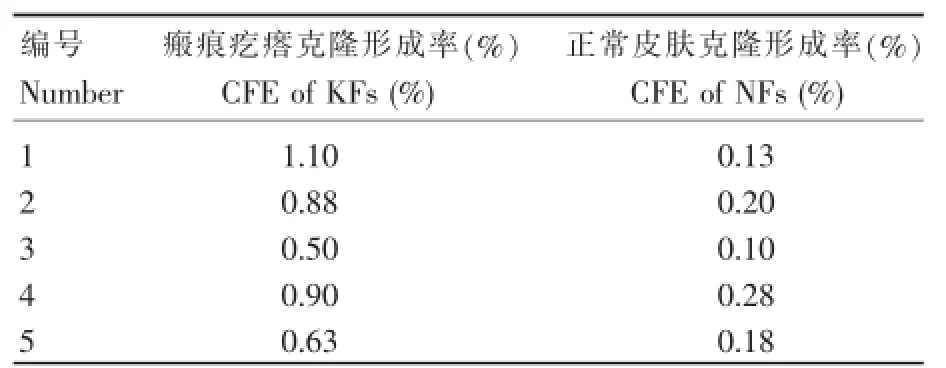
表1 细胞标本克隆形成率统计Table 1Data of cloning formation efficiency of each specimen
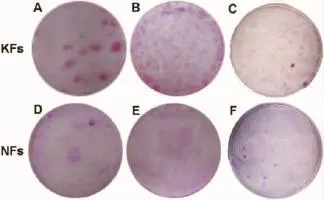
图12周时,低密度培养条件下KFs和NFs的Rhodamine B染色对比Fig.1Typical morphological contrast of KFs and NFs under low-density culture conditions by Rhodamine B staining after cultured for 2 weeks
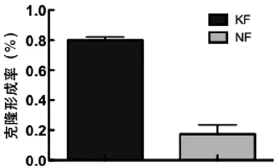
图2 KFs和NFs在低密度培养条件下克隆形成率对比Fig.2The contrast of cloning formation efficiency between KFs and NFs under low-density culture conditions
3 讨论
低密度培养方法是一种检测原代细胞中是否有干细胞存在的经典方法,该方法的原理是基于干细胞本身具有的自我更新能力[4],已广泛应用于肿瘤干细胞的研究[5-7]。为探索低密度培养的最佳密度,我们在预实验中尝试了3种不同的接种密度,发现KFs和NFs均可形成细胞克隆。以3 000个/皿密度接种的细胞在直径10 cm的培养皿中可形成1~2个克隆,其形成的克隆数目少且排列松散,相对失败率较高。5 000个/皿密度接种培养的细胞形成的克隆数目多,但克隆集落彼此邻近难以分辨,筛选率低。而以4 000个/皿密度接种培养的KFs可获得明显的克隆集落形成。因此,我们选取4 000个/皿的接种密度进行实验。
瘢痕疙瘩的发病机理尚未完全阐明,治疗后极易复发,导致临床缺乏切实有效的治疗手段[8]。不同于增生性瘢痕和其他瘢痕,瘢痕疙瘩具有持续浸润性生长、侵犯正常皮肤、易于耐药和复发的特性,即具有类似于肿瘤的特点,即瘢痕疙瘩肿瘤源性学说。研究表明,与正常皮肤成纤维细胞相比,瘢痕疙瘩成纤维细胞具有类似于肿瘤细胞的生物学特点,一些肿瘤相关基因在瘢痕疙瘩成纤维细胞中有特异性表达[9-11]。此外,瘢痕疙瘩具有一定的遗传倾向及家族聚集性,存在癌基因过度表达、抑癌基因突变失活、多种生长因子表达及信号通路的异常等[12-14]。
鉴于瘢痕疙瘩与肿瘤相似的特点,瘢痕疙瘩可以采用抗肿瘤药物,如5-氟尿嘧啶(5-FU)、秋水仙碱、丝裂霉素等进行治疗[15-16],治疗后大部分瘢痕疙瘩出现萎缩,但仍有一定比例的复发,并出现瘢痕疙瘩局部组织对治疗药物不敏感的现象,提示瘢痕疙瘩可能存在与肿瘤类似的“细胞耐药”机制。
关于肿瘤细胞的耐药机制,最新的学说认为是由于肿瘤干细胞(tumor stem cell,TSC)表达耐药基因所致[17-18]。TSC是指肿瘤中存在的少量具有自我更新能力、多向分化潜能,并能产生异质性肿瘤细胞的细胞。TSC理论认为,肿瘤可能是由TSC产生,TSC则可能由正常组织干细胞突变形成[19]。TSC具有强大的自我更新能力、高致瘤性、多向分化潜能,并表达多种干细胞标志物(如膜表面蛋白CD34、CD117和CD133,细胞骨架蛋白如Nestin以及一些与自我更新相关的转录因子如Oct-4和Nanog等)。TSC还表现出对多种抗肿瘤药物的耐药性,被认为是导致肿瘤化疗失败的重要原因。
目前在几乎所有正常组织中均可发现干细胞的存在[20-21]。Moon等[22]采用贴壁培养法从瘢痕疙瘩组织中分离出了间充质样干细胞,Zhang等[23]也采用单细胞克隆法从瘢痕疙瘩组织中分离出了肿瘤样干细胞。本研究通过比较瘢痕疙瘩成纤维细胞和正常真皮成纤维细胞间克隆形成率的差异,发现瘢痕疙瘩成纤维细胞形成克隆的能力显著高于正常真皮成纤维细胞,提示瘢痕疙瘩中可能存在某些具有干细胞样特性的病理性瘢痕疙瘩细胞,表现出较高的自我更新能力和高增殖状态。
结合本实验结果,我们有理由认为,正常皮肤组织干细胞在瘢痕疙瘩的特殊病理环境因素或某种致病因子作用下,有可能转变为特殊的病理性“瘢痕疙瘩干细胞”,这些细胞具有强大的自我更新能力及耐药性,可以通过不对称分裂既维持自身的存在,又不断产生新的瘢痕疙瘩细胞,从而使瘢痕疙瘩出现浸润性生长和易于耐药的临床表现。
若能分离出瘢痕疙瘩干细胞,并研究其细胞增殖潜能、凋亡、耐药性、耐药基因表达及多向分化潜能等,将有助于了解瘢痕疙瘩干细胞的生物学特性,阐明瘢痕疙瘩浸润性生长、高复发率及耐药性等病理特征的机制,为研究瘢痕疙瘩更为有效的治疗方案奠定科学基础。
[1]Niessen FB,Spauwen PH,Schalkwijk J,et al.On the nature of hypertrophic scars and keloids:a review[J].Plast Reconstr Surg, 1999,104(5):1435-1458.
[2]Kelly AP.Medical and surgical therapies for keloids[J].Dermatol Ther,2004,17(2):212-218.
[3]Guo W,Lasky JL 3rd,Wu H.Cancer stem cells[J].Pediatr Res, 2006,59(4 Pt 2):59R-64R.
[4]Hope K,Bhatia M.Clonal interrogation of stem cells[J].Nat Methods,2011,8(4 Suppl):S36-S40.
[5]Kishi T,Takao T,Fujita K,et al.Clonal proliferation of multipotentstem/progenitor cells in the neonatal and adult salivary glands[J]. Biochem Biophys Res Commun,2006,340(2):544-552.
[6]Miller RH,Szigeti V.Clonal analysis of astrocyte diversity in neonatal rat spinal cord cultures[J].Development,1991,113(1): 353-362.
[7]Cao X,Gu Y,Jiang L,et al.A new approach to screening cancer stem cells from the U251 human glioma cell line based on cell growth state[J].Oncol Rep,2013,29(3):1013-1018.
[8]Mustoe TA,Cooter RD,Gold MH,et al.International clinical recommendations on scar management[J].Plast Reconstr Surg, 2002,110(2):560-571.
[9]Vincent AS,Phan TT,Mukhopadhyay A,et al.Human skin keloid fibroblasts display bioenergetics of cancer cells[J].J Invest Dermatol,2008,128(3):702-709.
[10]Satish L,Lyons-Weiler J,Hebda PA,et al.Gene expression patterns in isolated keloid fibroblasts[J].Wound Repair Regen, 2006,14(4):463-470.
[11]蔡景龙.瘢痕疙瘩发生的肿瘤源性学说[J].中华医学杂志,2009, 89(16):1084-1087.
[12]Brown JJ,Ollier W,Arscott G,et al.Genetic susceptibility to keloid scarring:SMAD gene SNP frequencies in Afro-Caribbeans [J].Exp Dermatol,2008,17(7):610-613.
[13]De Felice B,Ciarmiello LF,Mondola P,et al.Differential p63 and p53 expression in human keloid fibroblasts and hypertrophic scar fibroblasts[J].DNA Cell Biol,2007,26(8):541-547.
[14]胡振富,罗力生,罗盛康.病理性瘢痕中c-myc、c-fos和ras原癌deep bite prior to surgical mandibular advancement[J].Eur J Orthod,2010,32(3):342-345.
[17]陈小平,林洁,杨甄宇,等.下面部轮廓过宽改型的新概念[J].中华整形外科杂志,2007,23(6):540-541.
[18]祖青,米从波,聂晶,等.中国美貌女性颏部软组织形态的分布[J].中国组织工程研究与临床康复,2011,15(22):4065-4068.
[19]朱明,柴岗,张艳,等.下颌骨截骨术后咬肌变化的研究[J].中华整形外科杂志,2010,26(5):340-344.
[20]Yang J,Wang L,Xu H,et al.Mandibular oblique ostectomy:an alternative procedure to reduce the width of the lower face[J].J Craniofac Surg,2009,20(Suppl 2):1822-1826.
[21]Dutedoo HS.Transtative and transformative growth of the rat mandible[J].Acta 0dontol Scand,1978,36(1):25-32.
[22]Weijs WA,Hillen B.Corrections between the cross-sectional area of the jaw muscles and craniofaeial size and shape[J].Am J Phys Anthropol,1986,70(4):423-431.
[23]Van Spronson PH,Weijs WA,Pranhl-Andersen B.Comparison of jaw muscle bite-force cross-sections obtained by means of magnetic resonance imaging and high-resolution CT scanning[J]. J Dent Res,1989,68(12):1765-1770.
[24]Pu Z,Zhang Y,Yang J,et al.Mandibular angle ostectomy for Chinese wowen:approaches and extent determined by cephalometric analysis[J].J Craniofac Surg,2009,20(1):105-110.
[25]Hwang K,Han JY,Kil MS,et al.Treatment of condyle fracture caused by mandibular angle ostectomy[J].J Craniofac Surg, 2002,13(5):709-712.基因表达的实验研究[J].中华整形外科杂志,2002,18(3):165-167.
[15]Al-Attar A,Mess S,Thomassen JM,et al.Keloid pathogenesis and treatment[J].Plast Reconstr Surg,2006,117(1):286-300.
[16]陈发国,姜萍,张建军,等.丝裂霉素C治疗产瘢痕疙瘩21例[J].皮肤病与性病,2006,28(4):40.
[17]Sabisz M,Skladanowski A.Cancer stem cells and escape from drug-induced premature senescence in human lung tumor cells: implications for drug resistance and in vitro drug screening models[J].Cell Cycle,2009,8(19):3208-3217.
[18]Gangemi R,Paleari L,Orengo AM,et al.Cancer stem cells:a new paradigm for understanding tumor growth and progression and drug resistance[J].Curr Med Chem,2009,16(14):1688-1703.
[19]Polyak K,Hahn WC.Roots and stems:stem cells in cancer[J]. Nat Med,2006,12(3):296-300.
[20]Brunt KR,Weisel RD,Li RK.Stem cells and regenerative medicinefuture perspectives[J].Can J Physiol Pharmacol,2012,90(3):327-335. [21]Chen FG,Zhang WJ,Bi D,et al.Clonal analysis of nestin(-) vimentin(+)multipotent fibroblasts isolated from human dermis [J].J Cell Sci,2007,120(Pt 16):2875-2883.
[22]Moon JH,Kwak SS,Park G,et al.Isolation and characterization of multipotent human keloid-derived mesenchymal-like stem cells[J].Stem Cells Dev,2008,17(4):713-724.
[23]Zhang Q,Yamaza T,Kelly AP,et al.Tumor-like stem cells derived from human keloid are governed by the inflammatory niche driven by IL-17/IL-6 axis[J].PLoS One,2009,4(11):e7798.(收稿日期:2013年12月28日;修回日期:2014年2月5日)
Clonal Analysis on Low Density Culture of Keloid Fibroblasts
QU Miao,WU Xiaoli,CHAI Gang.Department of
Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine, Shanghai Key Laboratory of Tissue Engineering,Shanghai 200011,China.Corresponding author:WU Xiaoli(E-mail: wuxiaoli528@gmail.com);CHAI Gang(E-mail:13918218178@163.com).
ObjectiveTo compare the clone forming capacity between keloid fibroblasts(KFs)and normal dermal fibroblasts(NFs),and to explore whether there are pathological stem cells in keloid and the role of keloid stem cells on the mechanism of keloid formation.MethodsPrimary cells were obtained from keloid tissue and normal dermis respectively through enzyme digestion method,and then were cultured under low-density conditions of 4 000/dish.Two weeks later,the clone formation and morphology were determined.ResultsUnder low-density culture conditions,clones were formed in both KFs and NFs.KFs formed distinct and dense clones while NFs formed loose and fewer ones.KFs exhibited higher clone forming efficiency(CFE)of(0.80±0.21)%than NFs with CFE of(0.18±0.06)%(P<0.05).ConclusionWith low-density culture,keloid fibroblasts possess higher level of cloning capacity than normal dermal fibroblasts,which suggests pathological stem cells may exist in keloid tissues.
Keloid;Low-density culture;Cloning formation efficiency;Keloid stem cells
R619+.6
A
1673-0364(2014)02-0082-04
10.3969/j.issn.1673-0364.2014.02.005
2013年12月28日;
2014年2月19日)
国家自然科学基金项目(30872694,81101432)。
200011上海市上海交通大学医学院附属第九人民医院整复外科,上海市组织工程研究重点实验室。
武晓莉(E-mail:wuxiaoli528@gmail.com);柴岗(E-mail:13918218178@163.com)。

