应用高效液相色谱法测定缬沙坦氨氯地平片有关物质
彭熙琳,吴品江,周唯兰,周芯宇,李元波
(1.四川大学华西药学院,成都 610044;2.扬子江药业集团四川海蓉药业有限公司,四川都江堰611830)
缬沙坦氨氯地平片为瑞士诺华公司(Novartis)产品,商品名:倍博特,规格为缬沙坦80 mg和氨氯地平5 mg,2007年在美国获批准上市,2009年在中国获批准进口上市,为抗高血压药。血管紧张素ⅡAT1受体拮抗剂(缬沙坦)和钙离子拮抗剂(苯磺酸氨氯地平)是较好的联合抗高血压药物的治疗方案[1-4]。缬沙坦氨氯地平片临床疗效优于单方,而且安全性和耐受性较单方好[5],拟开发的产品剂型、规格与原研市售品一致,有着较广阔的市场前景。
目前该药质量标准为缬沙坦氨氯地平片进口药品注册标准JX20080182(以下简称标准[7]),在对该药品进行检验时,发现该标准中有关物质检测规定有值得探讨之处,采用标准中色谱条件检测样品,发现其缬沙坦出峰时间在18 min左右,而该色谱条件采集时间为25 min,因此可能导致25 min后的杂质峰无法检出,或造成漏判。因此本文对缬沙坦氨氯地平片的有关物质进一步的研究,在试验基础上对检查方法和标准规定提出建议。
1 材料与方法
1.1 仪器与试剂 DE54627713型高效液相色谱仪(美国安捷伦);BP61型Sartorius电子分析天平(上海精科仪器厂);氨氯地平杂质D(批号:F0I143,USP);缬沙坦杂质B(批号:H0K089,USP);缬沙坦杂质C(批号:H1J021,USP),苯磺酸氨氯地平(批号:100374-200903,中国药品生物制品检定所);缬沙坦(批号:100651-200902,中国药品生物制品检定所);甲醇和乙腈为色谱纯;水为重蒸馏水,其余试剂为分析纯。
1.2 方法
1.2.1 色谱条件 用十八烷基硅烷键合硅胶为填充剂;取三乙胺10 mL加水至1 000 mL,用磷酸调节pH值至2.8作为流动相A,甲醇作为流动相B,乙腈作为流动相C,按表1进行梯度洗脱,检测波长为238 nm;柱温40 ℃。
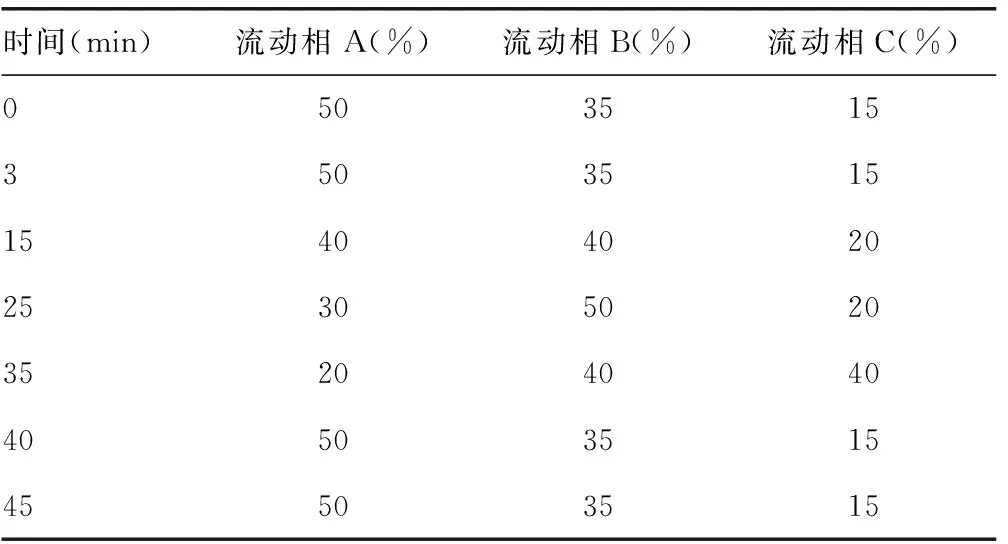
表1 梯度洗脱程序
1.2.2 溶液的配制 取本品细粉适量(相当于缬沙坦80 mg和氨氯地平5 mg),精密称定,置50 mL量瓶中,加流动相溶解并稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;精密量取供试品溶液1 mL,置100 mL量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液,另取苯磺酸氨氯地平对照品、氨氯地平杂质D对照品、缬沙坦杂质B、缬沙坦杂质C以及缬沙坦对照品各适量,精密称定,加流动相溶解并制成每1 mL约含苯磺酸氨氯地平70 μg、氨氯地平杂质D 20 μg、缬沙坦杂质B 10 μg、缬沙坦C 10 μg和缬沙坦800 μg的混合溶液作为系统适应性溶液。
1.2.3 波长的选择 对供试品溶液采用DAD在200~400 nm全波长扫描,发现本品在238 nm波长处其杂质个数及杂质检出量最大,同时各已知杂质在238 nm波长处有较大吸收,故选择238 nm作为本品有关物质的检测波长。
1.2.4 系统适用性试验 精密量取空白溶剂、供试品溶液及对照溶液各10 μL,注入液相色谱仪。
1.2.5 专属性试验 (1)对照试验:取本品细粉适量,精密称定,加流动相适量超声溶解,放冷,加流动相相稀释制成每1 mL含有1.6 mg缬沙坦和0.1 mg氨氯地平的溶液,摇匀,作为未破坏样品溶液;另取苯磺酸氨氯地平原料适量、缬沙坦原料适量,同法试验。(2)光照试验:取本品细粉适量,置太阳光下照射10 h,取样品适量,加流动相溶解稀释定容,摇匀,取续滤液测定;另取苯磺酸氨氯地平原料适量,缬沙坦原料适量,空白辅料适量,同法试验。(3)高温试验:取本品细粉适量,加流动相适量,于100 ℃水浴中放置4 h后,放冷,加流动相稀释至刻度,摇匀,取续滤液即得高温破坏样品溶液;另取苯磺酸氨氯地平原料适量,缬沙坦原料适量,空白辅料适量,同法试验。(4)氧化试验:取本品细粉适量,加入双氧水(10%)10 mL,在60 ℃加热30 min左右,冷却后用流动相稀释至刻度,摇匀,取续滤液即得氧化破坏样品溶液;另取苯磺酸氨氯地平原料适量,缬沙坦原料适量,空白辅料适量,同法试验。(5)碱破坏试验:取本品细粉适量,精密称定,加1 mol/L氢氧化钠溶液5 mL,于60 ℃加热25 min后,并用1 mol/L盐酸溶液5 mL中和后,并用流动相稀释至刻度,摇匀,取续滤液即得碱破坏样品溶液;另取苯磺酸氨氯地平原料适量,缬沙坦原料适量,空白辅料适量,同法试验。(6)酸破坏样品:取本品细粉适量,精密称定,加1 mol/L盐酸溶液5 mL,于60 ℃加热20 min后,并用1 mol/L氢氧化钠溶液5 mL中和,用流动相稀释至刻度,摇匀,取续滤液即得酸破坏样品溶液;另取苯磺酸氨氯地平原料适量,缬沙坦原料适量,空白辅料适量,同法试验。
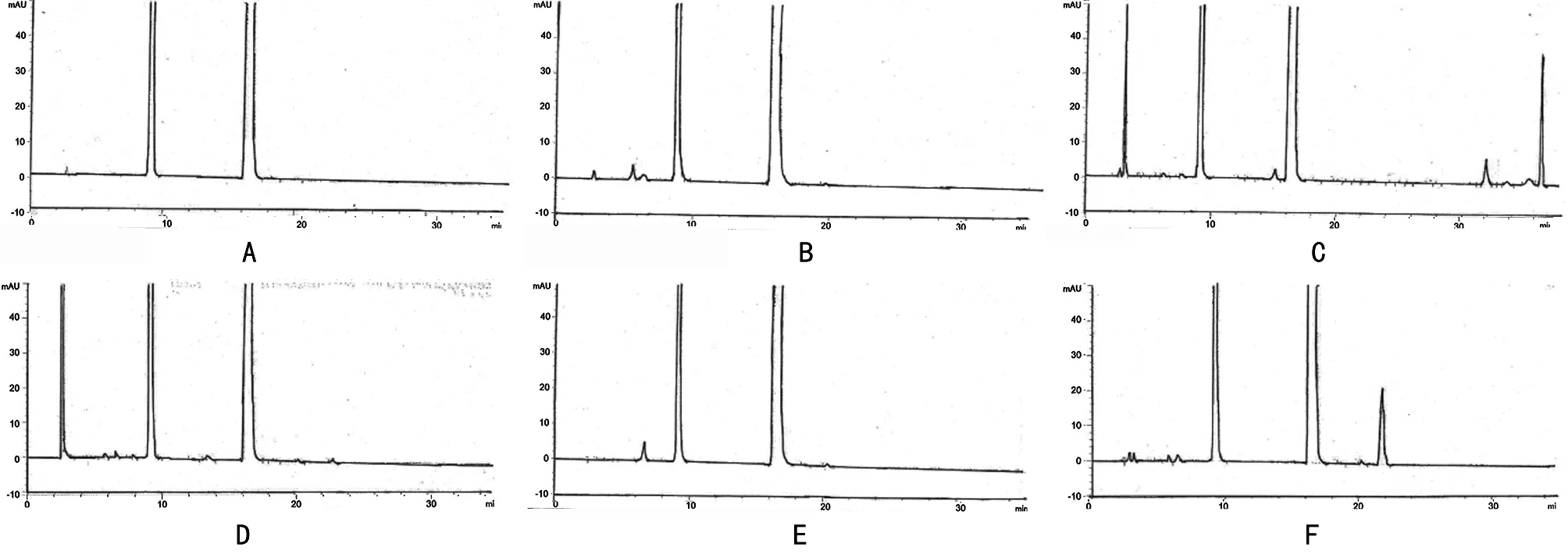
A:未破坏;B:光照试验图;C:高温试验;D:氧化试验;E:碱破坏试验;F:酸破坏样品。
图1 降解试验HPLC图
1.2.6 检测限和定量限测定 取缬沙坦对照品、苯磺酸氨氯地平对照品、氨氯地平杂质D对照品、缬沙坦杂质B对照品,缬沙坦杂质C对照品适量,精密称定,加流动相溶解并稀释制成较低浓度的溶液,精密量取10 μL,分别注入液相色谱仪。
1.2.7 杂质的线性关系考察及校正因子计算 取氨氯地平杂质D、缬沙坦杂质B、缬沙坦杂质C的对照品适量,加流动相配制成一系列浓度的溶液,在有关物质测定条件下进样测定,记录峰面积,以浓度为横坐标,峰面积A为纵坐标,进行线性回归。氨氯地平杂质D校正因子计算方法:采用标准曲线法测定氨氯地平杂质D对氨氯地平的相对响应因子,即将两回归曲线方程斜率之比即为校正因子。同法计算缬沙坦杂质B和缬沙坦杂质C校正因子。
1.2.8 溶液稳定性和精密度试验 取供试品溶液、自身对照溶液、氨氯地平杂质D对照品溶液、缬沙坦杂质B对照品溶液和缬沙坦杂质C对照品溶液,测定有关物质溶液稳定性和进样精密度。
1.2.9 样品测定 取三批样品,精密称定,研细,分别称取相当于缬沙坦80 mg和氨氯地平5 m的粉末,置50 mL量瓶中,加流动相溶解并稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;精密量取供试品溶液1 mL,置100 mL量瓶中,加流动相稀释至刻度,摇匀,作为自身对照溶液;取系统适应性溶液作为已知杂质对照品溶液,取上述溶液进高效液相色谱仪分析,记录色谱图,采用加校正因子主成分自身对照法计算已知单个杂质,最大单个杂质以及总杂质。
2 结 果
2.1 系统适用性试验 空白溶剂无干扰,系统适用性溶液各相邻杂质峰与供试品主峰分离,符合规定。
2.2 专属性试验 结果表明,本品两个主成分原料及制剂在各破坏条件下的降解产物峰均能与氨氯地平及缬沙坦的主峰实现良好的分离,且各已知杂质与未知杂质之间分离度均符合要求。
2.3 检测限和定量限测定 分别记录各仪器色谱图,使其S/N约为3时的进样量作为检测限,使其S/N约为10时的进样量作为定量限,结果见表2。
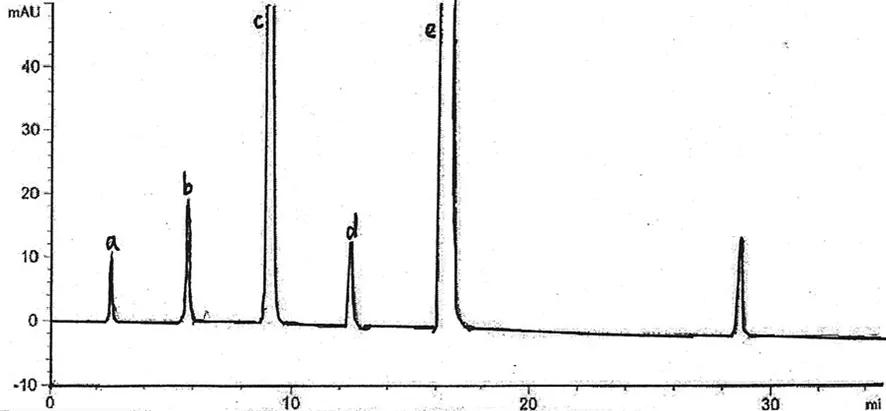
A:氨氯地平杂质D;b:氨氯地平;c:缬沙坦杂质B;d:缬沙坦;e:缬沙坦杂质C。
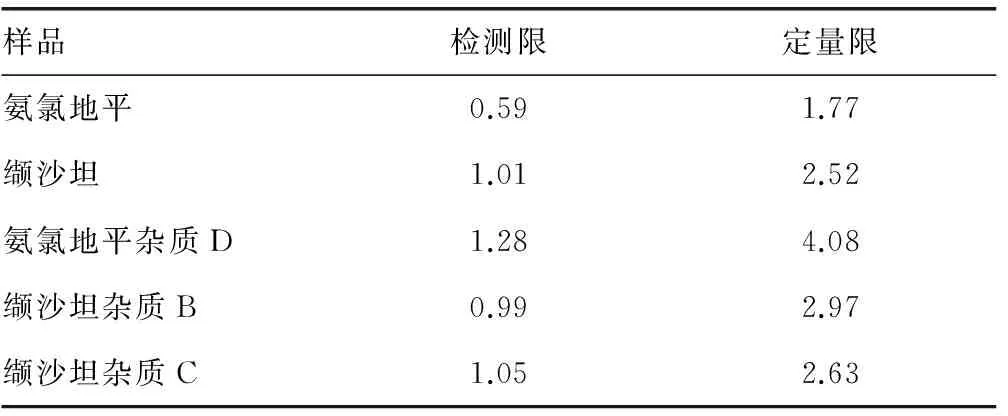
图2 系统适应性溶液色谱图表2 检测限和定量限测定结果(ng)
2.4 杂质的线性关系考察及校正因子计算 缬沙坦回归方程Y=27.671X+1.880 6,在0.10~27.56 μg/mL范围内呈良好的线性关系,r=0.999 9;氨氯地平回归方程:Y=23.608X+1.977 2,在0.08~20.91 μg/mL范围内呈良好的线性关系,r=0.999 9;氨氯地平杂质D回归方程:Y=11.697X+0.784 5,在0.13~32.77 μg/mL范围内呈良好的线性关系,r=0.999 9;缬沙坦杂质B回归方程:Y=28.28X+0.854 4,在0.09~23.07 μg/mL范围内呈良好的线性关系,r=0.999 9;缬沙坦杂质C回归方程:Y=20.804X+0.545 1在0.11~26.86 μg/mL范围内呈良好的线性关系,r=0.999 9。
氨氯地平杂质D校正因子为2.0;缬沙坦杂质B和缬沙坦杂质C校正因子为1.0。
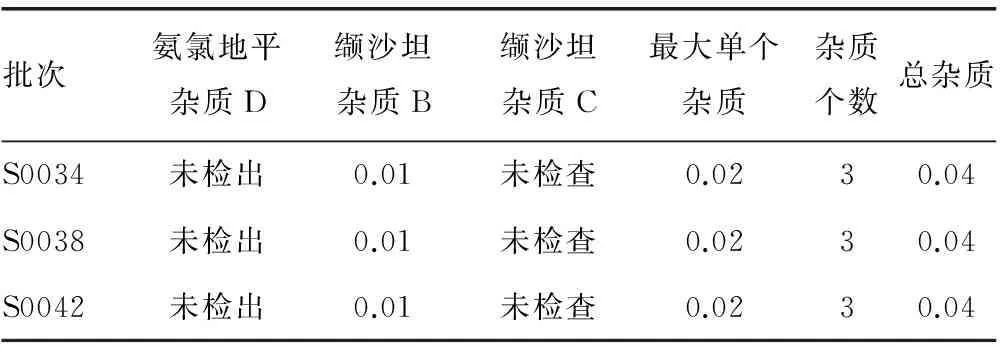
表3 有关物质检查结果
2.5 溶液稳定性和精密度试验 结果显示溶液在8 h内稳定,RSD为1.38%(n=6);供试品溶液、自身对照溶液、氨氯地平杂质D对照品溶液、缬沙坦杂质B对照品溶液和缬沙坦杂质C对照品溶液进样精密度良好,RSD分别为1.46%,0.69%,0.58%,0.78%,0.89%(n=6)。
2.6 样品测定 对三批样品进出测定,结果如表3所示。
3 讨 论
缬沙坦氨氯地平片主要含有苯磺酸氨氯地平和缬沙坦两种有效成分,有关物质含量高低与药品质量和安全性相关,因此控制制剂有关物质含量十分必要,该制剂主要有关物质缬沙坦杂质B、缬沙坦杂质C和氨氯地平杂质D等的引入主要是原料和制剂工艺,建立一套缬沙坦氨氯地平片有关物质检测方法控制缬沙坦氨氯地平片质量,至关重要。在标准中,主要对已知杂质缬沙坦杂质B和氨氯地平杂质D进行了检测,方法采用外标法,计算各杂质含量,采用的操作方法较为复杂,准确性较低;而在文献[6]中,主要对缬沙坦杂质B进行了检测和控制,未对缬沙坦杂质C进行研究,有一定缺陷性。本文采用加校正因子主成分自身对照法来建立一套缬沙坦氨氯地平片有关物质检测方法,能够准确而有效的测定缬沙坦氨氯地平片中的有关物质,能够控制该产品质量,与加校正因子外标法计算杂质含量的方法相比较,该法测定操作等相对简单便捷,专属性强,准确性高。
[1]刘晓云,宋建国.抗高血压单片复方制剂缬沙坦/氨氯地平临床药理学研究进展[J].中国执业药师,2011,8(12):31-36.
[2]戴彤,张抒扬.缬沙坦/氨氯地平单片复方制剂在高血压治疗中的应用[J].中华高血压杂志,2011,19(9):813-815.
[3]Yuri Karpov,NeeleshDongre et al.Amlodipine/Valsartan Single-Pill Combination:a Prospective,Observational Evaluation of the Real-Life Safety and Effectiveness in the Routine Treatment of Hypertension[J],Adv Ther,2012,29(2):134-147.
[4]Destro M.Efficacy and safety of amlodipine/valsartan compared with amlodipine monotherapy in patients with stage 2 hypertension:a randomized,double-blind,multicenter study:the EX-EFFeCTS Study[J].J Am Soc Hypertens,2008,18(2):294-302.
[5]胡大一.缬沙坦氨氯地平单片复方制剂对单药治疗血压控制不良的中国高血压患者疗效及安全性研究Ⅱ:原理和设计[J].中华高血压杂志,2010,18(12):1116-1119.
[6]魏春燕,沈利,王延松,等.HPLC法测定复方氨氯地平缬沙坦片有关物质[J].中国药师,2011,14(8):1142-1144.

