PD-ECGF基因上调在PCI术后血管内膜损伤修复中的作用研究*
朱晋坤,毛 华,尹扬光,董 文,邓梦扬,鲁玉明,熊宗华,杜 峰,文 美,刘廷筑
(1.贵州省贵阳市第一人民医院心内科 550002;2.重庆市第六人民医院重症医学科 400060)
经皮冠状动脉介入治疗(PCI)是心肌梗死或不稳定型心绞痛血管重建的首选方法,能够有效地恢复冠状动脉血流,降低患者的病死率。然而,由于其术后易发生冠状动脉再狭窄,从而严重影响了该疗法的远期效果。研究表明,早期裸支架植入PCI术后血管再狭窄发生率可达40%;虽然随着药物洗脱支架的运用,这一并发症发生率有所降低,但仍达到11%[1]。
防治PCI术后靶血管再狭窄及重建靶血管生物学功能的关键在于加速靶血管段的内皮覆盖、抑制局部平滑肌细胞过度增殖及促进受损血管的修复。最近的研究表明,使用促进血管生长的基因可加快和增加局部缺血患者侧支动脉的发展和促进血管再生[2-3]。血小板衍化内皮细胞生长因子(PD-ECGF)又被称为胸苷磷酸化酶(TP),其具有趋化内皮细胞和促进血管生成的作用。在活体动物血管疾病研究中发现,PD-ECGF基因转染具有促进血管生成的作用[4]。本研究将PD-ECGF基因转染入兔颈动脉球囊损伤模型,探讨PD-ECGF基因是否拥有促进损伤血管再内皮化、抑制内膜增生及改善PCI术后靶血管再狭窄的作用,也为将来降低PCI术后靶血管不良重构和再狭窄提供一种新的治疗思路。
1 材料与方法
1.1 实验动物 36只雄性新西兰白兔,6月龄,体质量2.5~3.0 kg,由第三军医大学实验动物中心提供。
1.2 方法
1.2.1 家兔颈总动脉球囊损伤模型的建立及干预 动物适应性喂养2周后,分为对照组(n=18)和实验组(n=18),并行左颈总动脉球囊损伤术,具体步骤和方法参阅文献[4-5]报道。实验组新西兰白兔于损伤颈总动脉内注入PD-ECGF基因(病毒含量1×1010cfu/100 μL,共0.1 mL,由上海吉凯基因生物技术公司合成),保留10 min;对照组则注入同等体积的交付剂无菌生理盐水保留10 min。为了更好地促进PD-ECGF基因的转染,实验组损伤动脉外膜给予含PD-ECGF基因(病毒含量1×1010cfu/100 μL,共0.1 mL)的40% gel F-127促进转染;对照组则给予不含病毒的0.1 mL 40% gel F-127处理。随后,生理盐水清洗手术切口,逐层缝合皮下组织与皮肤。术后给予青霉素10×104U/kg肌肉注射预防感染。
1.2.2 病理组织学检查 Evans蓝染色:3周后,取实验组和对照组家兔各6只,经耳缘静脉注入0.5%Evans蓝,取颈动脉损伤节段,沿血管长轴剪开,平铺观察着色情况(着色部分为损伤后仍未修复的内皮),并计算内皮细胞覆盖率[内皮细胞覆盖率=内皮细胞覆盖面积(IA)/总面积(TA)]。HE染色:3周后,两组各取家兔6只,收集颈动脉损伤节段约1.5~2.0 cm,甲醛溶液固定,梯度脱水,石蜡包埋并切片(5 μm)。HE染色后测量平均内膜厚度、平均中膜厚度及内膜面积与中膜面积比值(I/M)。内膜面积=内弹力膜包绕面积-管腔面积,中膜面积=外弹力膜包绕面积-内弹力膜包绕面积。
1.2.3 PD-ECGF免疫组化染色 各组石蜡切片(5 μm,n=6)行PD-ECGF免疫组化染色,具体方法见参考文献[6],一抗为鼠单克隆PD-ECGF(Santa公司,1∶500),二抗为山羊抗小鼠(北京中杉公司,1∶3 000),以PBS缓冲液代替一抗作为阴性对照。免疫组化结果判定:PD-ECGF表达阳性和阴性,根据细胞染色强度和染色细胞所占面积二者积分之和来判断。染色强度积分为:不染色=0,轻度染色=1,中度染色=2,强染色=3;染色面积积分为:无细胞染色=0,<25%细胞染色=1,25%~50%细胞染色=2,>50%细胞染色=3。若两种积分之和大于2,则为PD-ECGF表达阳性,≤2则为表达阴性[7]。
1.2.4 免疫印迹法检测PD-ECGF蛋白表达 3周后,处死2组各6只家兔,收集颈动脉损伤节段约2~3 cm,提取组织总蛋白并测定蛋白浓度,各组取40 μg全蛋白在SDS-PAGE凝胶中进行电泳,随后,蛋白转移至硝酸纤维素膜上,加一抗[小鼠单克隆PD-ECGF(1∶1 000)和小鼠单克隆β-actin(1∶2 000)],4 ℃孵育过夜,洗膜,加辣根过氧化物酶标记的羊抗鼠二抗(1∶4 000),室温孵育2 h,洗膜后使用化学发光法在Bio-Rad 分子成像仪上成像。

2 结 果
2.1 Evans蓝染色 动物喂养3周后实验组和对照组管壁均有白色不着色部分,呈斑片状,内皮覆盖率分别为(72.8±4.0)%和(33.6±7.4)%;实验组内皮覆盖率显著高于对照组(P<0.05),见图1、2。
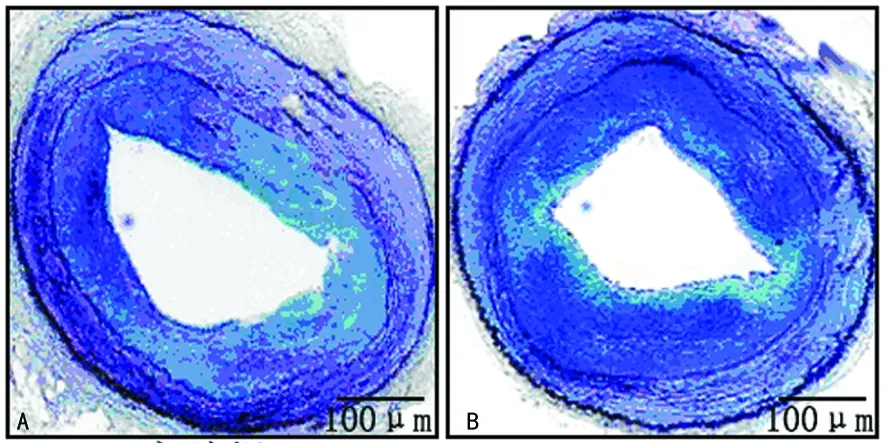
A:实验组;B:对照组。
图1 典型颈动脉Evans蓝染色
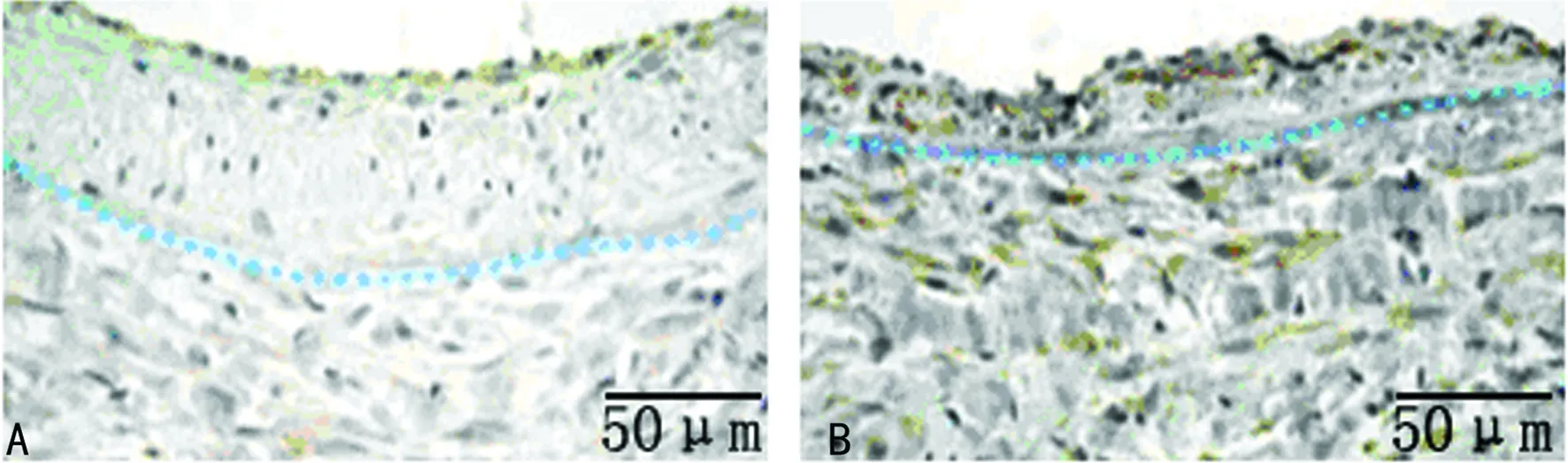
2.2 HE染色 HE染色显示,3周后对照组血管内膜明显增厚,平滑肌细胞排列紊乱,而实验组血管内膜增生显著减轻,中膜平滑肌及胶原组织增生均无对照组明显(图3)。两组平均内膜厚度、平均中膜厚度及I/M见表1。
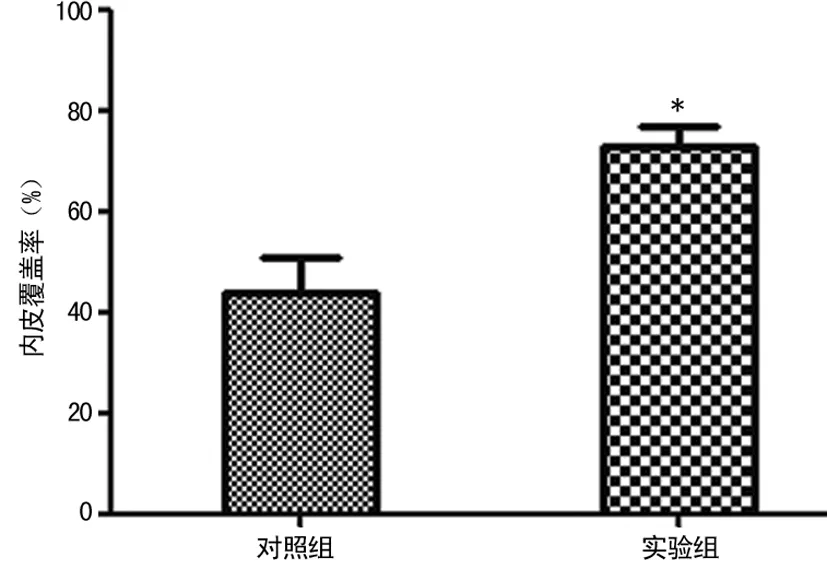
*:P<0.05,与对照组比较。
图2 对照组和实验组内皮覆盖率情况

A:对照组;B:实验组。

图3 颈动脉HE染色(×100)表1 两组平均内膜厚度、平均中膜厚度及
*:P<0.05,与对照组比较。
A:对照组;B:实验组。
图4 PD-ECGF 在颈动脉组织中的表达(×200)

*:P<0.05,与对照组比较。
图5 PD-ECGF在颈动脉中染色面积和染色强度积分和改变情况
2.3 免疫组织化学染色分析 PD-ECGF 在颈动脉组织中主要表达于血管内皮细胞、间质细胞,染色主要在细胞质和细胞核内(图4、5)。实验组中PD-ECGF 阳性表达率显著高于对照组(P<0.05)。
2.4 免疫印迹法检测PD-ECGF表达 免疫印迹法检测证实实验组PD-ECGF蛋白在受损颈动脉细胞中的表达明显高于对照组(P<0.01),见图6。
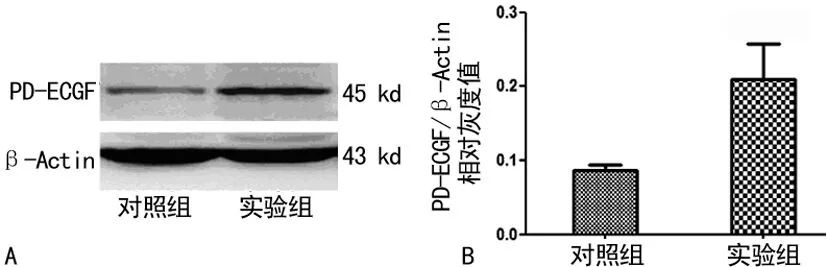
A:3周后PD-ECGF蛋白表达,B:PD-ECGF/β-Actin相对灰度值。
图6 免疫印迹法检测PD-ECGF表达
3 讨 论
PCI术后血管内皮细胞层不可避免地受到损伤,内皮层完整性的破坏是血栓形成的起始环节,这也将启动血管壁粥样斑块的进程,并导致内膜反应性增生[8]。内皮损伤的自我修复是个漫长的过程,在内皮层修复前,血液中存在的血管活性物质与内皮下血管壁接触,一方面引起血栓形成,另一方面,血管平滑肌细胞在这些活性物质的刺激下也发生反应性的增生,结局是血管再狭窄的发生。
PD-ECGF最早于1987被提取出,大量的实验证明了PD-ECGF与肿瘤血管生成之间的关系[9-10]。PD-ECGF是一个相对分子质量55×103的多肽,在体内是常以110×103的二聚体存在,是内皮细胞的有丝分裂原,而PD-ECGF作为一种血管生长因子,在体内与体外都被证实有血管新生作用[9-11]。PD-ECGF也是嘧啶核苷合成和分解代谢中一个重要的酶,能同时催化胸腺嘧啶核苷去磷酸化为胸腺嘧啶和2-脱氧-核糖-1-磷酸并且催化以上2种物质代谢为β-氨基异丁酸和2-脱氧-D-核糖,这些物质都具有明显刺激血管生成和促进血管延长作用[12-13]。目前对于PD-ECGF促进血管生成作用的机制公认为:(1)PD-ECGF促进血管生成作用是通过其酶活性而达到的;(2)酶活性作用降低了细胞内外胸腺嘧啶核苷及其他抑血管生成物的浓度;(3)PD-ECGF的代谢产物中含有促进血管生成的物质[14]。体外实验研究表明,受损的内皮细胞可通过摄取血小板内的PD-ECGF调节自身内环境的平衡,从而使损伤得以修复。另外,在体外实验中PD-ECGF能抑制平滑肌细胞的增殖[15-16]。这些研究充分提示了PD-ECGF在预防损伤血管再狭窄中可能发挥较大的作用。
本实验发现,与对照组相比,家兔颈动脉球囊损伤后转染PD-ECGF基因,能明显提高损伤动脉的内皮覆盖率。此外,HE染色发现血管内膜增生显著减轻,中膜平滑肌及胶原组织增生均不明显,管腔狭窄率与对照组相比也显著减低。以上表明,PD-ECGF基因能有效促进损伤后血管内皮细胞的修复,同时也能有效抑制平滑肌细胞的过度活化增殖,从而使血管发生再狭窄的比例也显著下降。本研究通过免疫组化染色和免疫印迹法分析发现,3周后实验组PD-ECGF表达水平明显高于对照组,可见,PD-ECGF基因通过简单的转染方式在实验组家兔颈动脉中也得到了有效的表达。事实上,PD-ECGF除了能促进血管生成外,还能抑制血管平滑肌细胞增殖和促进其凋亡。作者推测,PD-ECGF可能通过多种途径来促进内皮细胞和血管的生成,以及抑制血管平滑肌细胞增殖,其具体的分子机制作者将在下一步的研究中深入阐述。
综上所述,PD-ECGF基因的转染在损伤血管中表现出了趋化内皮细胞、促进血管生成和抑制平滑肌细胞增殖的作用,这提示PD-ECGF基因转染治疗对颈动脉球囊损伤后预防血管再狭窄有较好的疗效。PD-ECGF基因转染可为PCI术后防治血管再狭窄提供新的思路、观念。
[1]Teeuwen K,Adriaenssens T,Henriques JP,et al.A randomized multicenter comparison of hybrid sirolimus-eluting stents with bioresorbable polymer versus everolimus-eluting stents with durable polymer in total coronary occlusion:rationale and design of the Primary Stenting of Occluded Native Coronary Arteries Ⅳ study[J].Trials,2012(13):240.
[2]Eibel B,Rodrigues CG,Giusti II,et al.Gene therapy for ischemic heart disease:review of clinical trials[J].Rev Bras Cir Cardiovasc,2011,26(4):635-646.
[3]Yla-Herttuala S.Cardiovascular gene therapy with vascular endothelial growth factors[J].Gene,2013,525(2):217-219.
[4]Yamada N,Li W,Ihaya A,et al.Platelet-derived endothelial cell growth factor gene therapy for limb ischemia[J].J Vasc Surg,2006,44(6):1322-1328.
[5]Ward MR,Agrotis A,Kanellakis P,et al.Inhibition of protein tyrosine kinases attenuates increases in expression of transforming growth factor-beta isoforms and their receptors following arterial injury[J].Arterioscler Thromb Vasc Biol,1997,17(11):2461-2470.
[6]Ramakrishnan R,Chaudhry IH,Ramdial P,et al.Primary cutaneous adenoid cystic carcinoma:a clinicopathologic and immunohistochemical study of 27 Cases[J].Am J Surg Pathol,2013,37(10):1603-1611.
[7]Mattern J,Koommagi R,Volm M.Biological Characterization of subgroups of squamous cell lung carcinomas[J].Clin Cancer Res,1999,5:1459-1463.
[8]Kipshidze N,Dangas G,Tsapenko M,et al.Role of the endothelium in modulating neointimal formation:vasculo protective approaches to attenuate restenosis after percutaneous coronary interventions[J].J Am Coll Cardiol,2004,44(4):733-739.
[9]Miszczak-Zaborska E,Smolarek M,Bartkowiak J.Influence of the thymidine phosphorylase (platelet-derived endothelial cell growth factor) on tumor angiogenesis[J].Catalytic activity of enzyme inhibitors[J].Postepy Biochem,2010,56(1):61-66.
[10]Zhang SH,Zhang H,He HW,et al.Lidamycin up-regulates the expression of thymidine phosphorylase and enhances the effects of capecitabine on the growth and pulmonary metastases of murine breast carcinoma[J].Cancer Chemother Pharmacol,2013,72(4):777-788.
[11]Bronckaers A,Gago F,Balzarini J,et al.The dual role of thymidine phosphorylase in cancer development and chemotherapy[J].Med Res Rev,2009,29(6):903-953.
[12]BeraH,TanBJ,SunL,etal.Astructure-activityrelationshipstudyof1,2,4-triazolo[1,5-a]
[1,3,5]triazin-5,7-dione and its 5-thioxo analogues on anti-thymidine phosphorylase and associated anti-angiogenic activities[J].Eur J Med Chem,2013(67):325-334.
[13]Haraguchi M,Miyadera K,Uemura K,et al.Angiogenic activity of enzymes[J].Nature,1994,368(6468):198.
[14]李冰.血小板衍生内皮细胞生长因子的研究进展[J].国际妇产科学杂志,2008,35(2):86-88.
[15]Li W,Tanaka K,Morioka K,et al.Long-term effect of gene therapy for chronic ischemic myocardium using platelet-derived endothelial cell growth factor in dogs[J].J Gene Med,2008,10(4):412-420.
[16]Li W,Tanaka K,Ihaya A,et al.Gene therapy for chronic myocardial ischemia using platelet-derived endothelial cell growth factor in dogs[J].Am J Physiol Heart Circ Physiol,2005,288(1):408-415.

