电针对非酒精性脂肪肝大鼠肝细胞角蛋白18表达的影响*
曾志华,曾明慧,黄学宽,周 萍△,陈 康
(1.重庆医科大学中医药学院,重庆 400050;2.重庆医科大学校长办公室,重庆 400050;3.中国人民解放军第三二四医院,重庆 400020)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是指排除过量饮酒及其他明确的肝损害因素所致的以肝细胞内脂质沉积和变性为主要特征的临床病理综合征[1]。随着肥胖症和糖尿病患者的日益增多,NAFLD患病率迅速上升[2]。其发病机制尚不完全清楚,研究发现细胞角蛋白18(cytokeratin 18,CK18)在NAFLD中的高表达导致脂质过氧化反应增强是脂肪肝发生、发展的重要因素[3]。近年来临床采用针刺治疗NAFLD疗效确切[4-5]。本研究通过电针干预NAFLD大鼠,观察大鼠肝脏CK18表达及肝内超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量的变化,从而探讨电针治疗脂肪肝的作用机制,现报道如下。
1 材料与方法
1.1 材料 雄性Wistar大鼠购自重庆医科大学动物实验中心[动物使用许可证号:SCXK(渝)2007- 0001];胆固醇购自上海生工化学试剂厂;猪油为市售;东宝肝泰片剂购自中国通化东宝药业股份有限公司,配制成1%的混悬液;MDA、SOD、CK18抗体购自南京建成生物有限公司;即用型SABC免疫组化染色试剂盒购自武汉博士德生物工程公司;一次性无菌针灸针购自江苏医疗用品有限公司。匀浆机、低温离心机、加液器、紫外分光光度计、光学显微镜、图像采集系统、图像分析系统等设备由重庆医科大学中医药实验室和基础医学院提供。
1.2 方法
1.2.1 分组与造模 雄性SPF级Wistar大鼠43只,体质量(200±20)g,适应性饲养7 d,标记后分为正常组(n=11)和造模组(n=32)。造模组采用陈世清高脂饮食法建立NAFLD大鼠模型[6],喂养饲料由20 g/L 胆固醇、100 g/L 猪油和880 g/L 普通饲料混合组成(由重庆医科大学动物实验中心按配方配制)。 8周后随机处死正常组大鼠1只和造模组大鼠2只,取肝脏做病理组织学检查以验明造模情况。将余下的造模组大鼠30只予以标记后再分为3组:NAFLD模型组(n=10)、电针组(n=10)、药物组(n=10)。模型组不做任何治疗;电针组给予电针治疗;药物组给予东宝肝泰灌胃。根据活血化淤、化痰利湿的治则,取三阴交、丰隆、脾俞、阳陵泉穴。所取穴位参照《实验针灸学》[7]定位。针刺方法:置大鼠于固定器中(重庆医科大学中医药实验室自制)中,取双侧穴位,用规格为0.3 mm×50 mm的毫针,分别剌入4 ~6 mm深度。然后接通电子针灸治疗仪(苏州医疗用品有限公司制造),采用强度2 V,频率10 Hz的疏密波[8],疏波和密波自动交替,以大鼠下肢抖动为宜,保持清醒状态,每天1次,每次20 min,连续4周。药物组大鼠按照0.28 g/kg(1%的混悬液20 mL/kg)灌胃[9],每天1次,连续4周。治疗期间,模型组大鼠分别置入固定器中20 min,连续4周。正常组始终喂以基础饲料,模型组、药物组和电针组继续饲以高脂饲料。
1.2.2 检测指标及检测方法 (1)肝脏生化指标检测:取大鼠肝右叶,在4 ℃下加生理盐水制成10%的肝匀浆液,3 000 r/min离心10 min后取上清液,SOD活性测定采用黄嘌呤氧化酶比色法;MDA含量测定采用硫代巴比妥酸比色法,严格按试剂盒说明书进行检测。(2)免疫组化检查:肝脏以10%甲醛固定,常规石蜡切片(切片厚度约4 μm),每块组织切片3张。采用CK18单克隆抗体进行免疫组化染色(ABC法),DAB显色,显微镜下观察。CK18免疫组化显示棕黄色颗粒为阳性,每张切片最少取20个高倍视野观察棕黄色颗粒染色程度,用IPP6.1免疫组化分析软件对图片阳性区域进行累积光密度值(IOD)的量化测定。

2 结 果
2. 模型的验证 实验过程中,造模组大鼠体质量明显增加、形体肥胖。肉眼可见造模组大鼠肝脏体积增大,颜色变黄;光镜下HE染色显示正常组大鼠肝小叶结构清晰,肝细胞呈放射状整齐排列,造模组肝细胞出现中度至重度的脂肪变性,肝索紊乱,大量的肝细胞肿胀呈圆形,细胞间界限不清,偶尔可见碎屑样坏死,细胞核被脂肪空泡挤到肝细胞的边缘,病理学检查可证实造模组大鼠脂肪肝已形成(图1)。
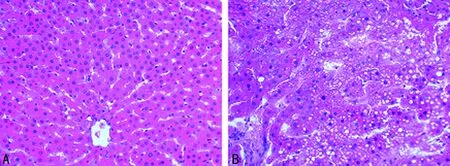
A:正常组;B:造模组。
图1 正常组与造模组大鼠肝组织病理切片(HE×400)
2.2 肝组织病理形态变化 至12周末,肉眼观察正常组大鼠肝色鲜红;模型组肝脏体积增大,颜色偏黄,电针组和药物组大鼠肝色接近正常组。光镜下:正常组肝小叶结构清晰,肝细胞形态正常,呈放射状整齐排列;模型组肝细胞出现中度至重度的脂肪变性,肝索紊乱,大量的肝细胞肿胀呈圆形,细胞间界限不清,胞质内充满以大泡型为主的脂肪空泡或脂滴,偶尔可见碎屑样坏死;电针组肝脏病理形态接近正常组,肝细胞结构趋于正常,胞质疏松,肝窦增宽,极少数肝细胞内可见小脂滴,无炎性细胞浸润;药物组有少数肝细胞内可见小泡型脂滴,未见坏死及纤维组织增生,有少量炎性细胞浸润。与模型组比较,电针组和药物组大鼠肝组织脂肪变性程度和炎性损伤均有不同程度的改善,电针组改善较为明显(图2)。

A:正常组;B:模型组;C:电针组;D:药物组。
图2 各组大鼠肝组织病理学改变(HE×400)
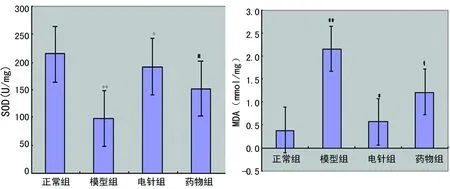
**:P<0.01,与正常组比较;*:P<0.01,#:P<0.05,与模型组比较。
2.3 各组大鼠肝SOD和MDA含量变化 模型组与正常组比较,SOD显著下降(P<0.01),MDA显著升高(P<0.01) ;与模型组比较,电针组和药物组SOD 显著升高(P<0.01;P<0.05),MDA显著降低(P<0.01;P<0.05),见图3。
2.4 各组大鼠肝组织CK18表达 CK18免疫组化显示棕黄色颗粒为阳性。正常组几乎未显示阳性表达细胞;模型组显示CK18阳性表达细胞数量比正常组明显增多;与模型组比较,电针组和药物组CK18阳性表达细胞数量均减少,电针组阳性表达细胞数量的减少更显著(图4)。
采用IPP6.1软件对图片阳性区域进行IOD测定,见图5。与正常组比较,模型组IOD值显著升高(P<0.01),为强阳性表达;与模型组比较,电针组和药物组CK18免疫组化IOD值显著降低(P<0.01;P<0.05)。
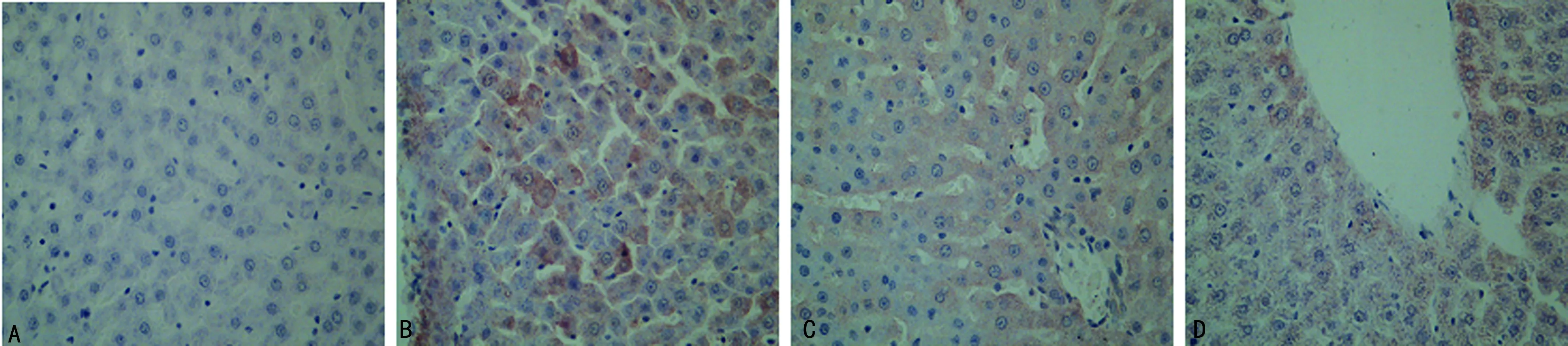
A:正常组;B:模型组;C:电针组;D:药物组。
图4 各组大鼠肝CK18免疫组化染色(×400)

**:P<0.01,与正常组比较;*:P<0.01,#:P<0.05,与模型组比较。
图5 各组大鼠肝CK18免疫组化IOD值变化
3 讨 论
NAFLD发病机制极其复杂,“二次打击”学说是目前比较公认的NAFLD的发病和进展机制,即胰岛素抵抗(IR)和脂质过氧化(LP)。首次打击主要指胰岛素抵抗影响脂质代谢导致的肝细胞内脂质沉积和脂肪变性,形成单纯性脂肪肝(NAFL);二次打击主要以脂质过氧化、促炎性细胞因子释放等因素导致脂肪变性的肝细胞发生炎症、坏死,引起非酒精脂肪性肝炎(NASH)。近年研究发现CK18与二次打击所造成的肝损伤关系密切[10-11]。
CK18是表达于成熟上皮细胞的中间丝蛋白,是肝细胞凋亡和坏死过程中相对特异的一种蛋白。 CK18作为一种细胞坏死的生物标志物,被认为是新发现与NAFLD相关的指标,目前对CK18参与NAFLD机制的研究尚处于起步阶段,许多研究结论尚存在分歧。CK18在肝细胞病理生理过程中起着重要作用,环境损伤如嗜肝病毒、药物和乙醇等因素引起的持续损害使CK18基因发生了改变,导致CK18表达的异常从而使肝病进展甚至进入终末期[12]。研究发现CK18在肝脏“二次打击”过程中发挥重要作用,参与NAFLD的发生和进展,以IR等因素导致的LP反应增强一方面造成肝细胞炎性坏死,促进CK18片段从坏死的肝细胞中释放到血中[13],另一方面对肝造成持续损害,促使CK18 基因发生改变,导致肝CK18 表达异常,从而使NAFLD肝病持续发展至终末期[14]。SOD可有效清除体内超氧阴离子,其活性的变化间接反映机体内自由基的生成和代谢。MDA是脂质过氧化终产物,含量可间接反映脂质过氧化的程度。
本实验结果表明,与模型组比较,病理学结果显示电针组和药物组大鼠肝脂肪变性程度和炎性损伤均有不同程度的改善;MDA含量均有不同程度的降低,SOD活性升高;免疫组化显示肝CK18表达受到一定程度的抑制。以上研究结果证实电针治疗在一定程度上改善了NAFLD大鼠的肝脏脂肪变性和炎性损伤。推测其机制可能是电针通过抑制NAFLD大鼠肝CK18表达的上调,减轻脂质过氧化反应,增强了机体的抗氧化能力,以此保护肝细胞免受损伤。
NAFLD在中医学中无独立的病名,可归属于“胁痛”、“肝着”、“积聚”等范畴。中医认为其主要病机为肝脾气化失司、痰浊内蕴、湿邪内生,致使后期肾精亏虚,肝、脾、肾功能失调,终致滞气、淤血、痰湿相互搏结,痹阻于肝脏脉络而成。临床采用针刺疗法治疗本病,以达疏肝健脾、理气燥湿、活血化淤之功,降脂作用肯定。实验证明三阴交和丰隆穴可加快脂肪代谢和促进血液循环;脾俞和阳陵泉穴善长调节消化系统功能[15]。本次实验针刺大鼠脾俞、丰隆、三阴交、阳陵泉穴,加用电针治疗,使NAFLD大鼠获得了明显的疗效。此研究结果对应用电针治疗NAFLD有一定的参考价值。
[1]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南[J].中华肝脏病杂志,2010,18(3):163-166.
[2]Williams R.Global challenges in liver disease[J].Hepatology,2006,44(3):521-526.
[3]Yilmaz Y,Dolar E,Ulukaya E,et al.Soluble forms of extra-cellular cytokeratin 18 may differentiate simple steatosis from nonalcoholicsteatohepatitis[J].World J Gastroenterol,2007,13(2):837-844.
[4]胡卫东,杨浩明,郑高坪,等.针灸治疗非酒精性脂肪性肝炎的临床观察[J].南京中医药大学学报,2006,23(1):39-41.
[5]王骏,张春燕,程玲,等.健脾法电针配合耳穴治疗肥胖性脂肪肝30例临床观察[J].上海中医药杂志,2006,40(7):41-42.
[6]陈世清,刘杞,孙航.脂肪肝胰岛素抵抗大鼠模型的建立[J].中华肝脏病杂志,2005,13(2):105-108.
[7]李忠仁.实验针灸学[M].北京:中国中
医药出版社,2003:314.
[8]胡卫东.针灸治疗非酒精性脂肪肝的临床观察[J].中国针灸,2005,12(1):13-15.
[9]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2005:114-116.
[10]Diab D,Yerian L,Schauer P,et al.Cytokeratin 18,a marker of cell death,is increased in children with suspected nonalcoholic fatty liver disease[J].J Pediatr Gastroenterol Nutr,2008,47(4):481-485.
[11]Gonzalez - Quintela A,Mallo N,Mella C,et al.Serum levels of cytokeratin - 18(tissuepolypep tide - specific antigen) in liver diseases[J].Liver International,2006,26(10):1217-1224.
[12]Gilbert S,Lorange A,Daigle N,et al.Simple epithelium keratins 8 and 18 provide resistance to Fas - mediated apop tosis.The protection occurs through a receptor-targeting modulation[J].J Cell Biol,2001,154(4):763-773.
[13]Malik R,Chang M,Bhaskar K,et al.The clinical utility of biomarkers and the nonalcoholic steatohepatitis CRN liver biopsy scoring system in patientswith nonalcoholic fatty liver disease[J].J Gastroen-terol Hepatol,2009,24(4):564-568.
[14]Diab D,Yerian L,Schauer P,et al.Cytokeratin 18,a marker of cell death,is increased in children with suspected nonalcoholic fatty liver disease[J].J Pediatr Gastroenterol Nutr,2008,47(4):481-485.
[15]胡卫东.针灸治疗非酒精性脂肪性肝炎的临床观察[J].中国针灸,2005,21(9):5-8.

