树突状细胞与细胞因子诱导的杀伤细胞抗前列腺癌细胞的免疫效应
匡幼林,邓远忠,梁思敏,苟 欣
(重庆医科大学附属第一医院泌尿外科,重庆 400016)
前列腺癌是老年男性常见的恶性肿瘤之一,近年来,我国前列腺癌发病率呈上升趋势,前列腺根治性切除术和放疗是治疗早期前列腺癌的有效手段。但对于局部进展期或有远处转移的前列腺癌患者,目前却没有令人满意的治疗方法[1]。众多研究表明肿瘤患者的免疫功能低下,肿瘤细胞可通过多种机制逃避机体的免疫系统识别[2]。树突状细胞(dendritic cell,DC)是目前发现的功能最强的抗原提呈细胞,可以诱导抗肿瘤的细胞毒T淋巴细胞免疫反应。细胞因子诱导的杀伤细胞(cytokine induced cells,CIK)是一种经多重细胞因子诱导的,增殖能力强、高效杀灭肿瘤细胞的免疫活性细胞。研究表明,DC和CIK联合使用,能提高肿瘤患者的T淋巴细胞免疫能力,达到抗肿瘤免疫的作用。同时,DC-CIK对很多肿瘤细胞的杀伤活性较相同条件下单纯CIK细胞明显增强[3]。本研究通过探讨DC-CIK体外作用于前列腺癌细胞的免疫效应,为前列腺癌免疫治疗提供实验基础。
1 材料与方法
1.1 材料 重组人白细胞介素-2(rhIL-2)、重组人白细胞介素-4(rhIL-4)、干扰素-γ(IFN-γ)、重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF)购自PeproTech公司,白细胞介素-12(IL-12)和IFN-γ ELISA试剂盒购自美国R&D Systems公司;CD3单克隆抗体、异硫氰酸荧光素(fluorescein isothiocynate,FITC)标记的抗人CD3抗体、藻红蛋白(phycoerythrin,PE)标记的CD8和CD56抗体均购自德国BD Pharmingen公司;CCK-8 购自日本同仁化学研究所;RPMI 1640和胎牛血清培养液购自Gibico公司;淋巴细胞分离液(Ficoll)购自中国医学科学院血液病研究所;人前列腺癌细胞株PC3购自中国科学院。
1.2 DC和CIK的体外诱导 采集健康志愿者的外周血80 mL左右,用淋巴细胞分离液分离并收集单个核细胞(PBMC),再用含10%胎牛血清的RPMI 1640培养液重悬,并调整细胞浓度为6×106/mL,置37 ℃、5%CO2培养箱中培养2 h。收获未贴壁的细胞,取部分重悬于含有1 000 U/mL IFN-γ的完全培养基中培养,24 h后添加500 U/mL的rhIL-2和50 ng/mL的CD3单克隆抗体,每隔3 d半量换液1次,培养第7天,收获CIK细胞;另取部分细胞培养于含有50 ng/mL CD3单克隆抗体的完全培养基,每隔3 d半量换液1次,培养第7天即为T细胞。将贴壁细胞用含有10 ng/mL的rhGM-CSF和10 ng/mL的rhIL-4完全培养基继续培养,隔天半量换液1次,培养第7天收获DC细胞。
1.3 DC-CIK共培养 收获培养第7天的DC,调整细胞浓度为1×106/mL,按1∶10的比例和CIK细胞共培养,用含500 U/mL的rhIL-2完全培养基隔天半量换液1次,共培养7 d。
1.4 IL-12 和 IFN-γ的检测 分别取培养第7天的DC组、DC-CIK组、DC-T组和CIK组培养上清液100 μL,按照IL-12和IFN-γ ELISA试剂盒的操作要求,分别检测各组培养上清液中的IL-12和IFN-γ含量。
1.5 FCM检测细胞表型 分别离心收集培养第7天的DC组、DC-CIK组、DC-T组和CIK组细胞,磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤3次后,分别添加FITC标记的人CD3抗体及PE标记的CD8、CD56抗体,4 ℃避光孵育30 min后,流式细胞仪检测。
1.6 细胞毒效应检测 收集PC3细胞,调整细胞浓度至5×105/mL,并接种至96孔培养板中,作为检测细胞毒效应的靶细胞。分别取培养第7天的DC组、DC-CIK组、DC-T组和CIK组细胞,作为效应细胞。将效应细胞按10∶1、20∶1、50∶1接种到靶细胞孔中进行混合培养。24 h后,采用CCK-8法检测各孔吸光度值,按公式计算效应细胞对靶细胞的杀伤效应。杀伤活性(%)=[(靶细胞对照组A值-实验组A值)/靶细胞对照组A值]×100%。

2 结 果
2.1 IL-12 和 IFN-γ的检测 用IL-12和IFN-γ ELISA试剂盒分别检测细胞培养上清液中的IL-12和IFN-γ的浓度,结果表明:DC-CIK组细胞分泌的IL-12、IFN-γ浓度分别为(105.14±2.16)、(726.28±21.35)pg/mL,较DC组、DC-T组和CIK组均显著增高,差异有统计学意义(P<0.05),见表1。
2.2 细胞表型分析 FCM分析显示:DC-CIK组、DC-T组和CIK组细胞均高表达CD3,差异无统计学意义(P>0.05)。DC-CIK组CD3+/CD56+和CD3+/CD8+细胞数分别为(27.80±1.01)%、(60.90±1.28)%,较DC-T组和CIK组均明显增加,差异有统计学意义(P<0.05),见表2。
2.3 细胞毒效应评价 以PC3细胞为靶细胞,DC组、DC-CIK组、DC-T组和CIK组细胞分别作为效应细胞,CCK-8法检测淋巴细胞杀伤效应。结果显示:DC-CIK组细胞对PC3细胞产生高细胞杀伤率(52.31±2.14)%,相比DC组(11.14±1.02)%、DC-T组(14.19±1.63)%和CIK组(34.43±2.01)%,差异有统计学意义(P<0.05),见图1。
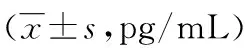
表1 ELISA检测细胞培养上清液中IL-12和IFN-γ 的浓度
*:P<0.05,与DC、DC-T、CIK组比较。
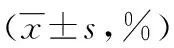
表2 细胞表型检测
*:P<0.05,与DC、DC-T、CIK组比较。
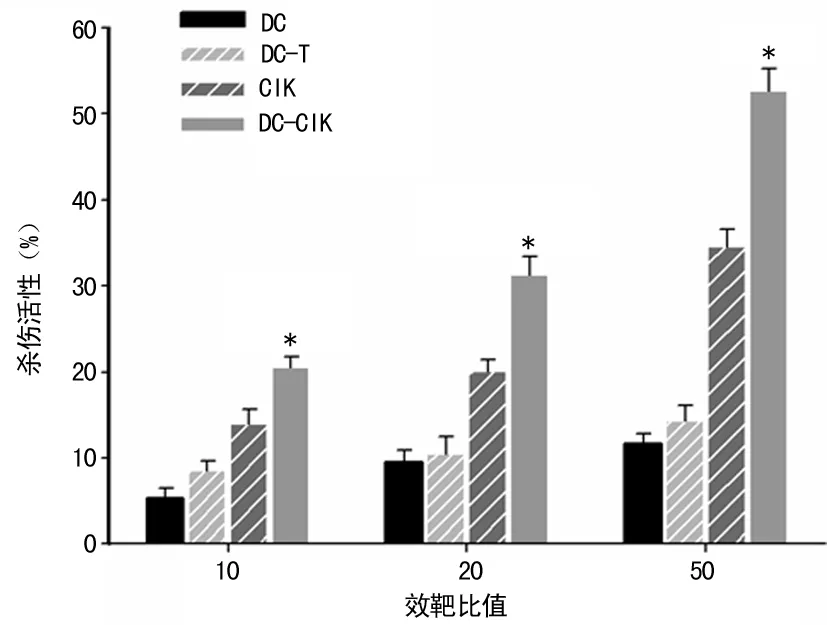
*:P<0.05,与DC组、DC-T组和CIK组比较。
图1 前列腺癌细胞杀伤活性检测
3 讨 论
前列腺癌是老年男性的常见恶性肿瘤之一,前列腺根治性切除术和放疗是治疗早期前列腺癌的有效手段。但对于局部进展期或有远处转移的前列腺癌患者,目前却没有令人满意的治疗方法[1]。为此,本研究探讨以DC-CIK为基础的免疫途径抗前列腺癌的作用。
DC-CIK细胞作为免疫效应细胞在抗肿瘤治疗中因其增殖能力强、杀瘤活性高的广谱抗瘤免疫等优势越来越引起人们的关注。目前,以自体DC-CIK细胞免疫疗法来治疗骨肉瘤、淋巴瘤等恶性肿瘤已显示出良好的应用前景[4]。研究发现,利用DC-CIK治疗自体造血干细胞移植(hematopoietic stem cell transplantation,HSCT)后复发的9例淋巴瘤患者,有2例患者部分缓解,2例患者病情稳定,其中1例持续了18个月[5]。龚奕等[6]在对50例急性髓细胞白血病进行自体DC-CIK细胞回输治疗中,发现患者总体生存率、无病生存率均高于对照组。尽管如此,DC-CIK细胞毒性增强的免疫效应机制目前尚未完全明了。
DC是目前发现最有效的抗原提呈细胞,可摄取、加工、处理抗原,通过高表达主要组织相容性复合体(major histocompatibility complex,MHC)分子、共刺激分子、细胞黏附因子1(intercellular cell adhesion molecule 1,ICAM-1)以及淋巴细胞功能相关抗原(lymphocyte functionassociated antigen1,LFA-1)等细胞表面分子,在体内外能有效激发初始和继发性T细胞免疫应答效应,同时可分泌辅助性T细胞1型细胞因子IL-12,诱导T细胞和自然杀伤细胞(natural killer,NK)产生IFN-γ和增强激活NK细胞的细胞毒活性。CIK细胞是由多种细胞因子如IL-2、IFN-γ和CD3单克隆抗体等诱导的一种免疫活性细胞,兼有T淋巴细胞强大的抗瘤活性与NK细胞的非主要组织相容性复合物(MHC)限制性杀瘤特点,并通过分泌高水平的IL-12、IFN-γ等辅助性T细胞1类细胞因子,以调节体内其他细胞因子的分泌达到促进CIK对肿瘤细胞杀伤作用的敏感性,起到抑制肿瘤和杀伤肿瘤的作用[7]。将具有强大肿瘤抗原提呈能力的DC与具有高效杀瘤活性的CIK细胞共培养,二者可分别通过识别抗原、激活获得性免疫系统和发挥自身的细胞毒活性、分泌细胞因子协同杀伤肿瘤细胞,从而形成高效能的免疫效应。本研究证实DC-CIK组培养上清液中IL-12、IFN-γ浓度水平明显高于CIK组及其他两组。可见,大量分泌细胞因子是DC-CIK细胞抗肿瘤免疫效应的重要机制。
本研究通过体外诱导扩增DC和CIK细胞,将其一起培养,观察共培养物DC-CIK细胞对前列腺癌细胞的杀伤作用。结果显示DC-CIK细胞能产生强大的抗前列腺癌效应,比同条件下单纯CIK细胞抗肿瘤活性增强,与方慧云等[8]报道的DC-CIK细胞抗鼻咽癌免疫应答效果一致。同时也证实DC-CIK细胞具有比CIK细胞更强的抗肿瘤活性。CIK细胞属于异质细胞群,其抗肿瘤作用与CD3+CD8+、CD3+CD56+双阳性细胞及分泌细胞因子的水平密切相关。同时CIK细胞又是具有NK活性的T细胞,具有T细胞的抗肿瘤活性和NK细胞的非MHC限制性杀瘤优点[9]。本研究结果表明,DC-CIK细胞具有高表达CD8+细胞和CD3+/CD56+细胞,即产生了大量的NK细胞样淋巴细胞和细胞毒性淋巴细胞,使抗前列腺癌细胞的免疫效应进一步增强。同时DC的抗原提呈作用能促使CIK细胞分泌IFN-γ的时间延长,分泌量增加,进一步增强对肿瘤细胞的细胞毒活性。本研究结果显示,DC-CIK细胞作为一类强大的抗肿瘤免疫效应细胞,可作为一种抗前列腺癌的免疫治疗方法。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[2]Bedognetti D,Wang E,Sertoli MR,et al.Gene-expression profiling in vaccine therapy and immunotherapy for cancer[J].Expert Rev Vaccines,2010,9(6):555-565.
[3]Wang QJ,Wang H,Pan K,et al.Comparative study on anti-tumor immune response of autologous cytokine-induced killer (CIK) cells,dendritic cells-CIK (DC-CIK),and semi-allogeneic DC-CIK[J].Chin J Cancer,2010,29(7):641-648.
[4]Li XD,Xu B,Wu J,et al.Review of Chinese clinical trials on CIK cell treatment for malignancies[J].Clin Transl Oncol,2012,14(2):102-108.
[5]Leemhuis T,Wells S,Scheffold C,et al.A phase Ⅰ trial of autologous cytokine-induced killer cells for the treatment of relapsed Hodgkin disease and non-Hodgkin lymphoma[J].Biol Blood Marrow Transplant,2005,11(3):181-187.
[6]龚奕,陈幸华,张曦,等.DC-CIK细胞输注治疗急性髓细胞白血病50例分析[J].重庆医学,2011,40(30):3039-3041.
[7]Sangiolo D,Mesiano G,Carnevale-Schianca F,et al.Cytokine induced killer cells as adoptive immunotherapy strategy to augment graft versus tumor after hematopoietic cell transplantation[J].Expert Opin Biol Ther,2009,9(7):831-840.
[8]方慧云,程伟民,李晓玲,等.CIK、DC-CIK细胞抗鼻咽癌CNE2细胞的作用比较[J].现代肿瘤医院,2009,17(11):2077-2078.
[9]Joshi PS,Liu JQ,Wang Y,et al.Cytokine-induced killer T cells kill immature dendritic cells by TCR-independent and perforin-dependeant mechanisms[J].J Leukoc Biol,2006,80(6):1345-1353.

