进展期胃癌应用HIFU联合PFC化疗的效果分析
田 姗 李 曾 李 翔
进展期胃癌应用HIFU联合PFC化疗的效果分析
田 姗 李 曾 李 翔
目的探讨高强度聚焦超声(HIFU)联合PFC化疗方案治疗进展期胃癌的临床疗效及安全性。方法将进展期胃癌患者80例分成治疗组和对照组,对照组采用常规PFC化疗方案进行治疗,治疗组在常规PFC化疗基础上加以高强度聚焦超声联合治疗,比较两组患者疗效等指标。结果治疗组的有效率为80%,高于对照组的50%;受益率治疗组达到97.50%,高于对照组的82.5%。两组疗效对比P=0.025 <0.05;CD3、CD8在两组治疗前后组内组间差异无统计学意义(P>0.05)。CD4、CD56、CD4/CD8在两组内治疗前后比较差异均具有统计学意义(P<0.05)。治疗后组间比较发现治疗组各指标好转优于对照组,差异具有统计学意义(P< 0.05);恶心呕吐、骨髓抑制两种不良反应在两组间差异具有统计学意义(P<0.05)。腹泻、外周神经毒性、肾功能损害在两组间比较差异不具有统计学意义(P>0.05)。结论高强度聚焦超声(HIFU)联合PFC化疗方案治疗进展期胃癌具有更好的临床疗效,能够增强患者免疫能力,不良反应发生率更低。
高强度聚焦超声;进展期胃癌;化疗
胃癌是一种常见的恶性肿瘤,具有极高的致死率,已成为威胁国民健康的严重疾病。临床将癌组织侵入胃壁浆膜层及肌层的胃癌称之为进展期胃癌,该期胃癌患者常伴有腹痛、食欲衰退、消瘦、恶心呕吐、呕血、腹泻、便黑等症状[1]。随着疾病的进展患者疾病将进入晚期,病情将进一步恶化,甚至出现癌组织转移,危及患者生命。目前,进展期胃癌主要救治方法为手术切除及放化治疗,但是由于种种因素作用,部分患者已经存在癌复发、转移等情况。在这种情况下学者们发现高强度聚焦超声治疗方案对肿瘤疾病具有良好效果,我们采用此法与PFC联合治疗取得了明显效果,现报告如下。
资料与方法
一、一般资料
研究对象来自于我院肿瘤科于2010年5月至2012年8月收治的胃癌患者80例。诊断标准[2]:符合胃癌诊断标准,主要根据CT检查、胃镜取病理组织经病理学检查确诊,胃癌分期属于进展期的患者,患者肝肾功能良好,对药物不具有过敏性,实验依从性较好,预计生存期≥4个月。排除标准[3]:预计生存期<4个月,胃癌进展分期不符,对试验药物过敏,肝肾功能损害严重,实验依从性较差。治疗组患者40例,男性24例、女性16例,年龄47~68岁,平均年龄(57±4.8)岁;其中发生肝转移的有14例、肺转移2例、骨转移5例、淋巴结转移28例。Ⅲb期12例、Ⅳ期28例。对照组患者40例,男性22例、女性18例,年龄46~69岁,平均年龄(56.3±4.4)岁;其中发生肝转移的有13例、肺转移3例、骨转移6例、淋巴结转移29例。Ⅲb期13例、Ⅳ期27例。两组患者年龄、性别、胃癌类型、临床分期等比较差异无统计学意义(P>0.05),两组资料较好的均衡性。均在签订知情同意书后开始本次实验。
二、观察指标
检测观察进展期胃癌患者对照组和治疗组治疗前后外周血淋巴细胞的改变情况,主要包括:CD3、CD4、CD56、CD4/ CD8、CD8。
三、治疗方法
对照组采用常规PFC化疗方案进行治疗:于手术后的第1、8天给予患者静脉滴注紫杉醇135 mg/m2;术后第1、2、3天给予患者静脉滴注亚叶酸钙100 mg/m2;术后第1天给予患者静脉滴注氟尿嘧啶500 mg/m2,其后给予患者2 500 mg/m2氟尿嘧啶泵注,持续70 h,21 d/周期。
治疗组在常规PFC化疗基础上加以高强度聚焦超声联合治疗。具体操作如下:选用海扶公司生产的海扶JC200型聚焦超声肿瘤治疗系统,通过计算机自动定位肿瘤预定靶区,治疗频率设置为0.8 MHz,焦域平均值设定为1.1 mm,焦域长度为9.8 mm,焦距为135 mm,功率为150~240 W。治疗时,将探头置于肿瘤对应体表部,由点到线,由线及面逐步治疗。治疗过程中还需将治疗靶区的声像形态图及时反馈,通过计算机明确治疗疗效并及时调整治疗剂量。比较两组患者疗效等指标。
四、疗效评价
根据WHO规定的肿瘤最近疗效标准[3],采用CT检查病灶大小变化情况,将疗效结果分为完全缓解(CR):治疗后肿瘤代谢消失,CT检查病灶消失。部分缓解(PR):肿瘤代谢FDG仍有存在,CT检查病灶大小稳定,临床症状明显缓解。进展(PD):肿瘤代谢FDG明显增强,CT检查病灶增大,临床症状无改善。稳定(NC):上述指标或体征无变化。受益率=(PR+CR+NC)/总例数。有效率=(CR+PR)/总例数。
观察两组患者的T细胞亚群的改变情况,采用FACS法,取肝素抗凝血3~5 mL分离淋巴细胞,用Hanks液洗3次,用含小牛血清的1640将细胞数调至109/mL,将标本分成4管,加入CD3、CD4、CD56、CD8单抗,在32℃下保持30 min,Hanks液洗3次,加入0.08%的戊二醛PBS固定液,用流式细胞仪分析。CD4、CD56均具有增强患者免疫的功能,CD3、CD8代表免疫抑制功能。
五、统计方法
所有数据录入Excel 2007,在spss10.0中进行统计分析。对计量资料均以x±s表示,采用配对资料的t检验方法,计数资料以%表示,采用χ2检验,检验水准取α=0.05。
结果
一、两组总疗效比较
治疗组的有效率为80%,高于对照组的50%;受益率治疗组达到97.50%,高于对照组的82.5%。卡方检验结果χ2= 9.386,P=0.025<0.05两组疗效差异具有统计学意义,治疗组疗效好于对照组,详细情况见表1。
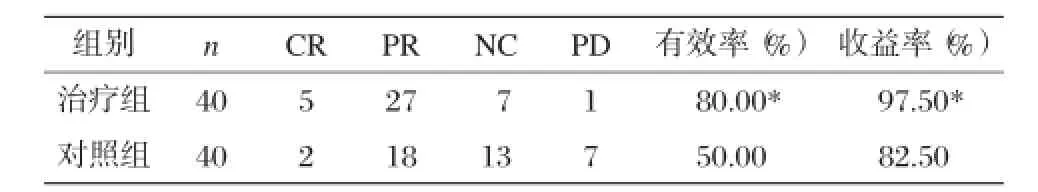
表1 治疗组和对照组疗效比较(n)
二、治疗组和对照外周血淋巴细胞的变化情况(表2)
对治疗组和对照组治疗前后外周淋巴细胞CD3、CD4、CD56、CD4/CD8、CD8进行组内和组间的比较,结果发现CD3、CD8在两组治疗前后组内组间差异无统计学意义(P> 0.05)。CD4、CD56、CD4/CD8在两组内治疗前后比较差异均具有统计学意义(P<0.05)。治疗后组间比较发现治疗组各指标好转优于对照组,差异具有统计学意义(P<0.05)。
三、治疗组和对照组不良反应发生情况
总体上看,治疗组发生不良反应例数低于对照组,其中恶心呕吐、骨髓抑制两种不良反应在两组间差异具有统计学意义(P<0.05)。腹泻、外周神经毒性、肾功能损害在两组间比较差异不具有统计学意义(P>0.05),见表3。
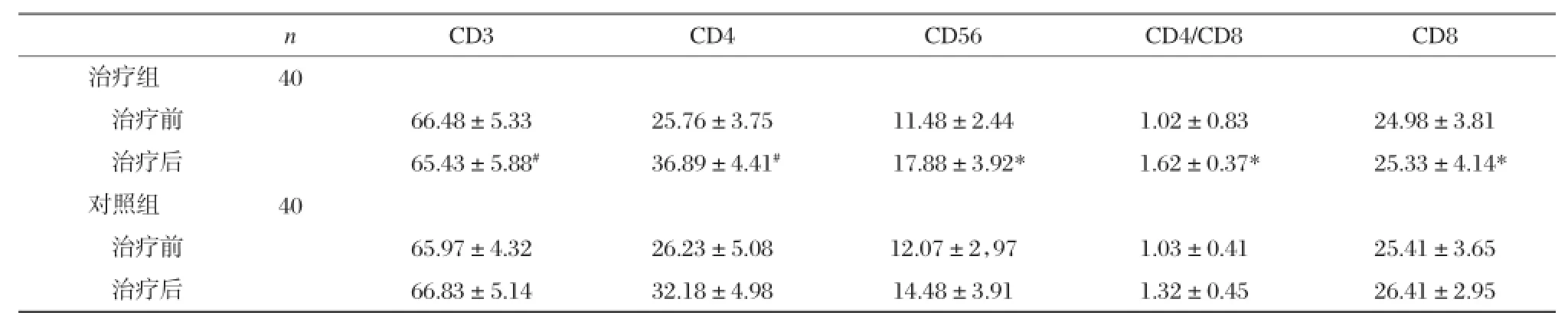
表2 治疗组和对照组外周血淋巴细胞变化情况(x±s)
讨论
胃癌是我国主要的常见肿瘤疾病,其死亡率达80%以上[4]。合理的手术病灶切除和放化疗成为挽救患者生命的主要方法。目前,临床常用的化疗方案为PFC化疗方案,该方案主要选用药物为紫杉醇、亚叶酸钙、氟尿嘧啶等[5]。其中紫杉醇是红豆杉属植物中一种次生代谢物,该物质可与人体细胞相互作用,诱使细胞分裂于G2/M期停止,进而抑制肿瘤细胞的增殖[6]。亚叶酸钙、氟尿嘧啶一直是临床常用的肿瘤化疗药剂,其疗效得到广泛肯定。虽然PFC化疗方案对胃癌疗效已被广泛证明,但是由于种种因素,部分患者依然存在肿瘤复发或转移情况[7]。在这种情况下,新的胃癌方案成为医学界的重要研究方向。

表3 比较两组不良反应(n)
高强度聚焦超声(HIFU)是一种新型的局部高温肿瘤技术。该技术作用机制为:将体表的高温低能超声波聚焦于患者体内肿瘤病灶部位,通过焦点的高能量声波产生的瞬间高温、空化效应,诱使局部肿瘤病灶凝固坏死[8]。临床研究发现高强度聚焦超声具有以下优点[9]:①微创性,高强度聚焦超声仅需体表的无创口超声照射,无放射损伤,无外科手术损伤,患者术中痛苦小,术后恢复快。②精准性,治疗靶区通过影像技术及计算机扫描确定,治疗区与非治疗区界限分明,治疗区以外组织无损伤。③实时性,在电脑监控下,医师可实时判断治疗效果,并可根据治疗效果及时调整方案和剂量。④适形救治,高强度聚焦超声方案由点及线,由线及面,声波照射深度、覆盖范围可根据肿瘤大小、形状及时调整。有学者对比高强度聚焦超声(HIFU)联合PFC化疗及单纯PFC化疗消化道肿瘤发现,联合组患者病灶总缓解率为60%,而单纯化疗组患者病灶总缓解率为46%,两者差异显著[10]。此外该学者还发现[11],联合组患者术后腹泻、恶心呕吐、体重增加、疼痛缓解情况均优于单纯化疗组。本研究中,对治疗组和对照组的治疗效果进行比较,治疗组的有效率为80%,高于对照组的50%;受益率治疗组达到97.50%,高于对照组的82.5%。其χ2=9.386,P=0.025<0.05两组疗效差异具有统计学意义,治疗组疗效好于对照组。这与上述研究相符。同时我们还可以发现,高强度聚焦超声(HIFU)联合PFC化疗在进展期胃癌救治工作中,其疗效显著高于单纯PFC化疗。与此同时,对治疗组和对照组治疗前后外周淋巴细胞CD3、CD4、CD56、CD4/CD8、CD8进行组内和组间的比较,结果发现CD3、CD8在两组治疗前后组内组间差异无统计学意义(P>0.05)。CD4、CD56、CD4/CD8在两组内治疗前后比较差异均具有统计学意义(P<0.05)。治疗后组间比较发现治疗组各指标好转优于对照组,差异具有统计学意义(P<0.05)。这表明治疗组患者术后机体恢复情况和机体免疫能力得到显著改善,这可能与高强度聚焦超声(HIFU)凝固病灶,降低肿瘤对患者免疫功能的损伤有关。此外,治疗组发生不良反应例数低于对照组,其中恶心呕吐、骨髓抑制两种不良反应在两组间差异具有统计学意义(P<0.05)。腹泻、外周神经毒性、肾功能损害在两组间比较差异不具有统计学意义(P>0.05),这与上述同类研究近似[12]。
综上所述,高强度聚焦超声(HIFU)联合PFC化疗方案治疗进展期胃癌具有更好的临床疗效,能够增强患者免疫能力,不良反应发生率更低。
1吴敏,杨大明,徐幼龙,等.高强度聚焦超声治疗老年晚期及复发性胃癌44例临床疗效观察.中华消化杂志,2011,31(8):570-571.
2高强度聚焦超声肿瘤治疗系统临床应用指南(试行).中华医学杂志,2005,85(12):797-797.
3朱红连.腹腔灌注联合化学治疗治疗中晚期胃癌62例及护理体会.中国药业,2013,22(9):115-116.
4麻周萍,徐燕舞,郑艳艳,等.护理干预对替吉奥联合奥沙利铂治疗胃癌术后患者的效果评价.中国药业,2013,22(5):80-81.
5贺单.原发性肝癌高强度聚焦超声治疗前后中医证型变化的研究.检验医学与临床,2012,9(21):2676-2677.
6王智亮,熊正爱,陈骊,等.高强度聚焦超声消融治疗围绝经期子宫肌瘤的初步研究.中国超声医学杂志,2014,30(1):55-58.
7焦玉冰,胡文莉.高强度聚焦超声治疗脾功能亢进的初步临床应用.中国医疗设备,2012,27(5):96-97,116.
8王振宇,王晨.进展期胃癌经腹行根治性全胃切除术的临床疗效.安徽医学,2011,32(6):789-790.
9宋天亮,吴阳,李捷,等.高强度聚焦超声治疗胰腺癌患者的剂量与疗效.中华肝胆外科杂志,2014,20(1):39-42.
10黄晓云,李富梅,王虹,等.高强度聚焦超声治疗子宫肌瘤临床研究.中国妇幼保健,2010,25(27):4001-402.
11丁霞娟.高强度聚焦超声联合化疗治疗中晚期胰腺癌的研究进展.微创医学,2013,8(5):613-616.
12穆庆霞,束永前,黄普文,等.PFC方案化疗联合高强度聚焦超声治疗进展期胃癌的临床观察.临床肿瘤学杂志,2005,10(3):265-267.
2014-03-04)
(本文编辑:吴保平)
10.3961/j.issn.1672-2159.2014.03.011
723000陕西省西安交通大学附属汉中市3201医院肿瘤内科

