大肠癌演化过程中PAK5的表达及临床意义
陶进勇 袁岸龙 许艳东 赵运志 官 瑜 王燕霞 鲁 斌 寇继光 龚 伟
·短篇论著·
大肠癌演化过程中PAK5的表达及临床意义
陶进勇1袁岸龙1许艳东1赵运志1官 瑜1王燕霞1鲁 斌1寇继光1龚 伟2
目的研究PAK5在大肠癌演化过程中的表达及临床意义。方法采用免疫组织化学法,检测PAK5基因分别在正常肠黏膜组织98例、增生性息肉40例、PJS息肉9例、腺瘤38例、大肠癌原发灶106例和转移灶25例中的表达水平。结果PAK5在正常肠黏膜、息肉、腺瘤、大肠癌原发灶及转移灶中表达依次增强(P<0.0001);在Dukes A-D期的大肠癌组织中,PAK5的表达水平也逐渐增强(P<0.01);在由高至低分化的大肠癌组织中,PAK5的表达也逐渐增强(P<0.01)。结论PAK5参与大肠癌的演化过程,可能与大肠癌的发生与转移机制有关。
PAK5;大肠癌
PAK5是近年来发现的PAK(P21-activated kinases)家庭成员,主要在神经组织中高表达[1],在NIE-115细胞中,PAK5的高表达可以促进丝状伪足(filopodium)的形成从而促进神经轴突的生长。在神经纤维瘤细胞中,PAK5参予了鸟嘌呤核苷酸交换因子(GEFT)介导的神经生长[2]。作为小GTPase的效应因子,PAK5可与细胞骨架中的肌球蛋白以及微管网结合,促进微管形成,影响细胞运动[3]。除了影响细胞的黏附和迁移外,PAK5同样也参与细胞的凋亡抵抗[4-5],提示PAK5可能参与肿瘤的发生与转移过程。为探讨PAK5在大肠癌组织中的表达及与大肠癌的相关性,我们收集正常肠黏膜组织,息肉,腺瘤,大肠癌原发灶及转移灶的标本,采用免疫组化法,检测PAK5基因分别在其中的表达。
材料与方法
一、材料
收集南方医院消化内科近期标本:正常肠黏膜组织98例、增生性息肉40例、PJS息肉9例、腺瘤38例、大肠癌原发灶106例和转移灶25例。
二、方法
1.免疫组织化学(IHC)检测
免疫组化染色采用SP法,步骤如下:石蜡切片5 μm,切片常规脱蜡至脱水;将切片置于柠檬酸缓冲液(PH 6.0,0.1 M),于微波炉中用最高档加热沸腾之后,调至解冻档加热10 min修复抗原,取出切片,冷却至室温;于室温下以3%H2O2孵育10 min消除内源性过氧化物酶,PBST(0.1 M PBS+4 mL Tween 20)冲洗,3×5 min;正常非免疫动物血清(迈新生物)室温封闭10 min;去除封闭液,不洗,滴加第一抗体(抗兔PAK5多克隆抗体,1:400;抗鼠Ki-67单克隆抗体,DAKO Cytomation,1:400),采用兔IgG取代一抗为阴性对照,4℃孵育过夜;去除一抗,PBST洗,3×5 min,滴加生物素标记二抗(迈新生物),室温孵育10 min;去除二抗,PBST洗,3×5 min,滴加链菌素-过氧化物酶溶液(迈新生物),室温孵育10 min;去除链菌素-过氧化物酶溶液,PBST洗,3×5 min,DAB(迈新生物)染色,苏木素复染,PBST返蓝;切片梯度酒精脱水,二甲苯透明,中性树脂封片。
2.免疫组化结果评价
结果采用半定量方法的12分法:①按染色的强度,阴性(不染色)为0分(如图1A),弱阳性(黄色)为1分(如图1B),中度阳性(褐色)为2分(如图1C),强阳性(深褐色)为3分(如图1D);②按阳性细胞数,阳性细胞数小于1%时为0分(如图1E),1%~10%为1分,11%~50%为2分,51%~75%为3分,大于75%为4分(如图1H)。最后,将两者的积分相乘(即0~12分),不染色为0分,乘积<4记为1+分,乘积=4记为2+分,乘积≥5记为3+分。不染色者为阴性,染色者为阳性,3+分者为强阳性。记录染色结果(如表1)。
三、统计学处理
采用SPSS17.0统计软件进行统计学分析。各因素间的差异比较和相关性分析采用χ2检验。
结果
本组正常肠黏膜组织98例、增生性息肉40例、PJS息肉9例、腺瘤38例、大肠癌原发灶106例和转移灶25例标本均有效进行了免疫组化检测,结果如下。
一、PAK5在正常肠黏膜、息肉、腺瘤、大肠癌原发灶及转移灶中的表达
在本组正常肠黏膜98例上皮组织中,44(44.9%)例呈现PAK5蛋白阴性表达(0分),3(3.1%)例为强阳性表达(3+分);增生性息肉40例中,23(57.5%)例为阴性(见图1AE),1(2.5%)例为强阳性;PJS息肉9例中,4(44.5%)例为阴性,1(11.1%)例为强阳性;腺瘤38例中,16(21.1%)例为阴性,6(15.8%)例为强阳性(见图1C);大肠癌原发灶106例中,11(10.4%)例为阴性,51(48.1%)例为强阳性(见图1DF);转移灶25例中,2(8.0%)例为阴性,16(64.0%)例为强阳性(见图1GH)。表明PAK5在正常肠黏膜、息肉、腺瘤、大肠癌原发灶及转移灶中表达依次增强(P<0.0001),见表1。
二、PAK5在临床病理不同Dukes分期中的表达
对大肠癌原发灶106例根据Dukes分期分组染色(见图2A-D)结果显示:A期20例中,4(20.0%)例为阴性,4(20.0%)例为强阳性;B期40例中,4(10.0%)例为阴性,18(45.0%)例为强阳性;C期31例中,2(6.4%)例为阴性,20(64.5%)例为强阳性;D期15例中,0(00.0%)例为阴性,10(66.7%)例为强阳性。表明根据临床病理不同Dukes分期,肿瘤组织浸润程度越深,PAK5的表达越强(P<0.01),见表1。
三、PAK5在肿瘤细胞不同分化程度中的表达

表1 PAK5在各组织类型中的表达[n(%)]

图1 PAK5在各组织类型中的表达[A:增生性息肉(表达为阴性);B:PJS息肉;C:腺瘤;D:大肠癌原发灶;E-H:同一个病人的不同组织,E正常肠黏膜,F大肠癌原发灶,G淋巴结,H肝脏转移灶,(A-C、E-H,200×;D,100×)]
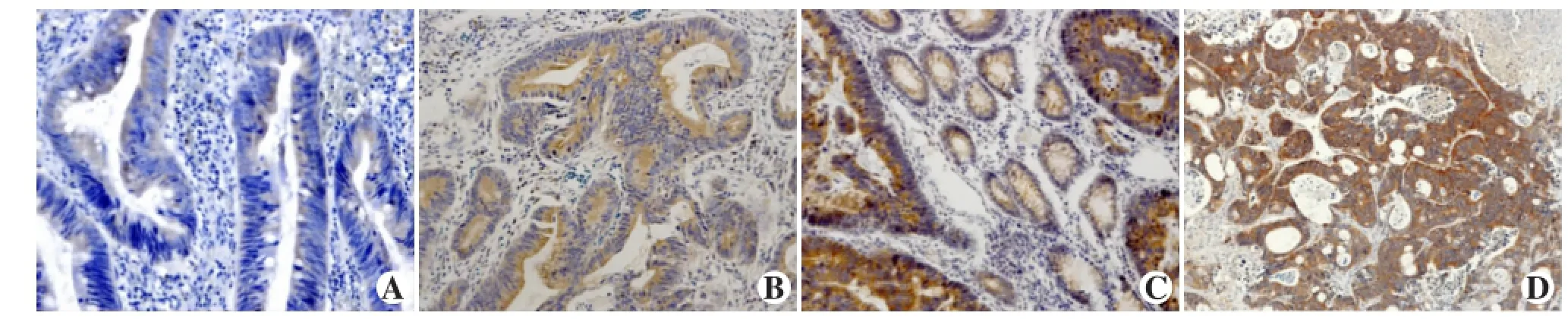
图2 PAK5在不同Dukes分期中的表达[A:A期(200×);B:B期(200×);C:C期(200×);D:D期(100×)]
对大肠癌原发灶106例按照肿瘤分化程度分组染色结果显示:低分化10例中,1(10.0%)例为阴性,7(70.0%)例为强阳性;中分化52例中,3(5.8%)例为阴性,30(57.7%)例为强阳性;高分化44例中,6(13.6%)例为阴性,15(34.1%)例为强阳性。表明PAK5在肿瘤组织中的表达与肿瘤细胞的分化程度呈负相关(P<0.01),见表1。
讨论
PAKs是一族新发现的丝氨酸/苏氨酸蛋白激酶,由6个成员组成即PAK1-6。在分子结构上,PAKs的N-末端为高度保守的Cdc42/Rac结合结构域(CRIB),C-末端为激酶活性区域。PAK1-3构成第一组PAK,分子量为62~64 kd。由于第一组PAK均具有自动抑制结构域(autoinhibitory domain)与其CRIB结构域部分重叠形成二聚体,因此PAK1-3需要通过CRIB结构域与Cdc42以及Rac1的相互作用被激活,从而调节细胞黏附、迁徙以及凋亡。PAK4-6构成第二组PAK,其分子量为65-68 kd,与PAK1-3不同,PAK4-6不具有自动抑制结构域,通过CRIB结构域主要与Cdc42相互作用,但不需要与Cdc42相互作用并被激活来获得激酶活性,并且与Cdc42的相互作用并不再增强PAK4-6的激酶活性,而是使其细胞定位发生改变[6-7]。如在HEK293细胞中共转染野生型PAK5以及持续活化型Cdc42质粒以后,细胞形成片状伪足,PAK5则从细胞核转位至片状伪足,调节细胞的黏附与迁徙[8]。
PAKs(p21-activated kinases)作为Rho GTP酶的下游靶蛋白,参与了黏附结构的解体,促进细胞运动,并且参与细胞凋亡抵抗过程。细胞黏附、迁徙能力的改变导致细胞侵袭能力的增强以及细胞凋亡抵抗是大多数肿瘤细胞的所具有的特性,大量的研究报道也表明:多数调节细胞黏附与迁徙以及细胞凋亡抵抗的分子在肿瘤组织中高表达,并与肿瘤的发生以及转移相关。PAK家族也被证明与诸多恶性肿瘤的演化过程相关,如在很多人类肿瘤的瘤细胞都高表达PAK1,尤其是在乳腺癌、卵巢癌以及胰腺癌中,PAK1的表达远高于其正常组织[9]。在乳腺癌中,PAK1在胞浆的高表达或者核表达,可磷酸化雌激素受体α(ER-α),从而导致乳腺癌患者对他莫昔芬的化疗抵抗[10]。在大肠癌中,PAK1的表达水平随大肠癌的演化过程逐渐升高,且大肠癌中PAK1的高表达的病人预后较差[10]。
本组试验数据结果表明,PAK5在正常肠黏膜、息肉、腺瘤、大肠癌原发灶及转移灶中表达依次增强;根据Dukes分期肿瘤浸润程度越深,PAK5的表达越强;肿瘤分化程度越低,PAK5的表达越强。提示其可能参与大肠癌的演化过程,PAK5在大肠癌组织中的过度表达提示其可能与大肠癌的转移相关。至于PAK5在大肠癌转移中的具体作用机理,有学者通过采用基因转染以及RNA干扰的方法,分别上调及下调PAK5在LST细胞株以及SW480细胞株中的表达水平,结果发现在低表达PAK5的LST细胞株中,通过上调前者的表达水平,PAK5在细胞中表达增强以后,细胞在Ⅰ型胶原上的黏附能力减弱,但迁移能力增强;在高表达PAK5的SW480细胞中,通过下调前者的表达水平,PAK5在细胞中的表达减弱以后,细胞的黏附能力增强,但迁移能力减弱。提示PAK5可能与大肠癌细胞的粘附与迁移能力相关,此机理可能是大肠癌转移机制之一[11]。该结论与本文观点一致。通过本组试验表明,PAK5可作为判断大肠癌的恶性程度与进展的新的标志物之一。
1Dan C,Nath N,Liberto M,et al.PAK5,a new brain-specific kinase, promotes neurite outgrowth in N1E-115 cells.Mol cell Biol, 2002,22(2):567-577.
2Bryan B,Kumar V,Stafford LJ,et al.GEFT,a Rho family guanine nucleotide exchange factor,regulates neurite outgrowth and dendritic spine formation.J Biol Chem,2004,297(44):45824-45832.
3Matenia D,Griesshaber B,Li XY,et al.PAK5kinase is an inhibitor of MARK/Par-1,which leads to stable microtubules and dynamic actin.Mol Biol Cell,2005,16(9):4410-4422.
4Cotteret S1,Jaffer ZM,Beeser A,et al.p21-activated kinase 5 (Pak5)localizes to mitochondria and inhibits apoptosis by phosphorylating BAD.Mol Cell Biol,2003,23(16):5526-5539.
5Cotteret S,Chernoff J.Nucleocytoplasmic shuttling of pak5 regulates its antiapoptotic properties.Mol Cell Biol,2006,26(8):3215-3230.
6Wells CM,Jones GE.The emerging importance of group II PAKs. Biochem J,2010,425(3):465-473.
7Wu X,Frost JA.Multiple Rho proteins regulate the subcellular targeting of PAK5.Biochem Biophys Res Commun,2006,351(2):328-335.
8Bokoch GM.Biology of the p21-activated kinases.Ann Rev Biochem,2003,72:743-781.
9Bagheri-Yarmand R,Mandal M,Taluker AH,et al.Etk/Bmx tyrosine kinase activates Pak1 and regulates tumorigenicity of breast cancer cells.J Biol Chem,2001;276(31):29403-29409.
10 Carter JH,Douglass LE,Deddens JA,et al.Pak-1 Expression Increases with Progression of Colorectal Carcinomas to Metastasis. Clinical Cancer Research,2004,10(10):3448-3456.
11龚伟,姜泊,张宏权,等.PAK5对大肠癌细胞黏附及迁移的影响.广东医学,2010,18(2):820-822.
2014-02-08)
(本文编辑:肖冰)
10.3961/j.issn.1672-2159.2014.03.007
1 432100湖北省孝感市中心医院消化科;2 510515南方医科大学南方医院消化内科
龚伟,E-mail:drgwei@foxmail.com
国家自然科学基金(No.81101610)

