铁皮石斛组培快繁关键技术研究
吴 菊,严中琪,杨 飞,殷武平
(浙江省舟山市农业科学研究院,浙江 舟山 316000)
铁皮石斛组培快繁关键技术研究
吴 菊,严中琪,杨 飞,殷武平
(浙江省舟山市农业科学研究院,浙江 舟山 316000)
以铁皮石斛种子和茎段为材料,研究铁皮石斛快繁从原球茎诱导、增殖、分化,及壮苗生根的过程中不同时期的基本培养基及激素浓度和有机物等。结果表明,3/4MS为种子及茎段诱导、增殖、分化、壮苗生根阶段较合适的基本培养基,且种子作为外植体诱导增殖效果较茎段好;原球茎诱导培养基3/4MS+1.0 mg· L-16-BA+0.2 mg·L-1NAA,增殖激素浓度为1.0~2.0 mg·L-16-BA+0.1~0.2 mg·L-1NAA时效果最好,原球茎的分化激素配比为1.0 mg·L-1NAA+0.1 mg·L-16-BA,壮苗和生根培养基为3/4MS+1.0 mg·L-1NAA+0.1 mg·L-16-BA+10%马铃薯汁;有机添加物为10%的马铃薯汁,效果较好。
铁皮石斛;组培;快繁
铁皮石斛又名黑节草,是兰科石斛属多年生草本植物,为传统名贵中药,在 《神农本草经》中被列为上品,具有滋阴清热、生津益胃、润肺止咳、润喉明目、延年益寿之功效,被称为中华九大“救命仙草”之首。铁皮石斛含有石斛碱、石斛次碱等生物碱及石斛宁和多糖等成分,具有抗肿瘤、抗衰老和扩张血管的作用[1-3]。然而,铁皮石斛生长对环境要求苛刻,自然条件下萌发率极低,加上其具有极高的药用与经济价值,人们长期无节制的采挖,致使野生铁皮石斛资源愈来愈稀少,种源已临枯竭,被列为濒危种。为实现铁皮石斛资源的可持续利用,多年来国内外不少机构对铁皮石斛人工栽培技术进行了研究,尤其是进入21世纪,我国研究人员在铁皮石斛组培快繁技术方面的研究报道很多[4-8]。本研究在前人研究的基础上,以铁皮石斛为研究材料,系统地研究从外植体到原球茎诱导,增殖、分化及试管苗壮苗、生根过程的技术,为工厂化育苗提供技术支撑。
1 材料与方法
l.l 试验材料
以野生铁皮石斛种子和一年生铁皮石斛茎段为试材。
l.2 试验方法
1.2.1 无菌系建立
种子。取铁皮石斛成熟蒴果保持新鲜,未开裂。采取人工授粉180 d以后,成熟,尚未开裂蒴果,用洗洁精溶液清洗蒴果表面,并在自来水下面冲洗30 m in。用刀片轻轻削去表面脏物,冲洗干净后,在超净工作台上用75%的酒精消毒30 s,然后用无菌水冲洗3次,然后再将茎段放入0.1%的HgCl2溶液中灭菌12 m im,灭菌过程中不断轻轻摇动烧杯使灭菌更加彻底,最后用无菌水冲洗5~6次,置于无菌滤纸上,表面水吸干后,用刀片从前端切去1段,使种子可以从前端孔处倒出,用镊子夹住蒴果,将种子轻轻抖动播在诱导培养基上。
茎段。从生长旺盛的1年生铁皮石斛植株上选择生长健壮的茎段,摘去叶片和膜质叶鞘,以茎芽为中心,芽的上下各留1 cm,取长约2 cm的茎段,用洗洁精溶液浸泡20 m in,并在自来水下面冲洗30 min。在超净工作台上用75%的酒精消毒30 s,用无菌水冲洗3次,然后再将茎段放入0.1%的HgCl2溶液中灭菌10 mim,灭菌过程中不断轻轻摇动烧杯使灭菌更加彻底,最后用无菌水冲洗5~6次,然后将茎段放在无菌滤纸上,将茎段的前后分别切去0.2 cm,切成长约0.5 cm左右的茎段,接种到诱导培养基上。
1.2.2 培养条件
在无菌室内进行培养,培养温度 (25±1)℃,全光谱日光灯照射,光照强度为1 600~2 000 lx,光照时数12 h·d-1。
1.2.3 培养基的配制
根据不同试验阶段配置不同基本培养基,以MS或1/2MS作为基本培养基,然后根据不同培养目的添加不同浓度的激素,糖和有机添加物等,培养基pH值5.8。加7.5 g·L-1的琼脂粉。灭菌条件是121℃,0.105 MPa,灭菌时间为30 min。
l.3 研究内容
1.3.1 铁皮石斛原球茎的诱导和增殖研究
外植体诱导培养基筛选。采用 1/2MS,3/ 4MS,MS,B5,N6等5种基本培养基,附加1.0 mg·L-16-BA+0.1 mg·L-1NAA进行不同培养基对铁皮石斛原球茎和拟原球茎诱导和增殖试验。
原球茎 (拟原球茎)诱导和增殖激素的筛选。将铁皮石斛种子和茎段各自分别接种于含不同浓度的生长素2,4-D,NAA,IBA和不同浓度的细胞分裂素6-BA和KT进行生长素和细胞分裂素交互作用对原球茎 (拟原球茎)诱导和增殖试验。
原球茎增殖激素配比试验方法。选取相同条件下生长良好的原球茎,约1.5 cm直径的团块,分别接种到9种不同培养基,每种接种5瓶,每瓶接种3个原球茎团,35 d后统计结果。
天然有机附加物对原球茎 (拟原球茎)增殖影响研究。在3/4MS基本培养基中加1.0 mg·L-16-BA+0.1 mg·L-1NAA条件下,分别添加20%的椰乳、马铃薯汁、香蕉泥、番茄汁,考察原球茎的增殖率和苗的健壮程度。
1.3.2 铁皮石斛原球茎分化培养基激素的筛选
以3/4MS为基本培养基,取相同条件下生长良好的原球茎,切成1.5 cm直径的团块,分别接种到附加NAA,6-BA和KT等培养基上进行激素配比筛选试验,每种培养基接种10瓶,每瓶接种3个原球茎团,45 d后统计结果。
1.3.3 铁皮石斛试管苗壮苗和生根研究
以3/4MS为培养基,研究不同添加物及不同激素配比对铁皮石斛试管苗壮苗和生根的影响。取株高为1~2 cm,具有1~2片真叶的无根丛生苗,分别接种到不同培养基中。每种培养基接10瓶,每瓶接6株小苗,分别于45 d和60 d后统计结果。
2 结果和分析
2.l 铁皮石斛原球茎的诱导和增殖
2.1.1 不同外植体诱导培养基筛选
采用1/2MS,3/4MS,MS,B5,N6等5种基本培养基,附加1.0 mg·L-1NAA+0.5 mg·L-16-BA进行不同培养基对铁皮石斛不同外植体的原球茎 (拟原球茎)诱导和增殖试验。
由表1可以看出,种子在这5种培养基上诱导率均较高,且种子比茎段的诱导率高,而诱导时间不同,培养基差异不明显。相比而言,MS培养基上种子的诱导率较高,其中3/4MS培养基上诱导率最高,为85%,可见种子萌发及发育需要盐分较高的培养基,但过高的盐分也会使种子萌发率下降,原球茎颜色偏黄。在不同培养基上,种子诱导的原球茎均为鱼籽状,较小,量大,颜色为淡绿色或绿色;茎段产生的愈伤较小,有拟原球茎产生,但量比较少。B5和N6培养基诱导率较高,诱导率达60%~70%,原球茎或拟原球茎颜色为淡绿或黄绿色。总体看来,3/4MS培养基效果最好,以种子作为外植体的原球茎产生的数量大,快繁速度优于茎段。

表1 不同外植体诱导培养基对原球茎 (拟原球茎)诱导情况
由表2,3可以看出,这5种基本培养基以3/ 4MS培养基增殖系数最高,为10.5,且健壮程度最高;其次是B5和N6,且健壮程度较高;种子平均增殖系数为8.5,显著高于茎段的3.7,种子的年增殖率为8.36×109显著高于茎段的6.58×106,种子的原球茎增殖速度显著高于茎段,且原球茎绿色,较小,节间短。
2.1.2 拟原球茎诱导激素的筛选
将茎段分别接种于以3/4MS为基本培养基,含不同浓度的生长素2,4-D,NAA,IBA和不同浓度的细胞分裂素6-BA进行生长素和细胞分裂素交互作用对拟原球茎诱导和增殖试验。

表2 不同培养基、外植体对原球茎增殖情况

表3 种子及茎段外植体原球茎平均增殖情况比较
由试验结果表4可知,不同处理对拟原球茎的诱导影响有显著差异,6-BA+NAA激素组合的平均拟原球茎诱导率51.94%,高于其他激素组合,同时诱导时间为20.25 d,总体比较短,处理2组合的拟原球茎诱导率最高,为60.00%,但NAA浓度过高,原球茎较松散且有玻璃化现象,所以拟原球茎的诱导培养基为1.0 mg·L-16-BA+0.2 mg· L-1NAA,诱导率达60.00%,诱导时间最短,仅为17 d。
2.1.3 原球茎增殖激素的筛选
在铁皮石斛组织培养过程中,原球茎增殖是关键环节,原球茎增殖是用最短的时间获得大量组培苗的有效方法,其中影响原球茎增殖系数的一个关键因素是培养基中激素浓度的配比。为研究激素配比对石斛原球茎增殖的影响,以3/4MS为基本培养基,添加6-BA和NAA等激素进行配比试验,表5表明,6-BA和NAA配合使用有利于原球茎的增殖,原球茎生长状况良好,原球茎簇生,较为松散、淡绿色;且处理1~6的原球茎生长还比较健壮,颜色为绿色或淡绿色,原球茎为致密或较松散,增殖系数随处理浓度的提高而增加;随着6-BA和NAA浓度的提高,即处理7~9增殖系数最高,为6.17~9.13,但玻璃化现象越来越严重,原球茎为黄绿色,甚至透明,更松散。这表明:较高浓度的6-BA配合较低浓度的NAA,有利于原球茎的增殖,但浓度过高会引起玻璃化现象,原球茎不健康,造成畸形,根据本试验结果:较为理想的原球茎增殖激素浓度为1.0~2.0 mg·L-16-BA+0.1~0.2 mg· L-1NAA。

表4 拟原球茎诱导激素种类的筛选
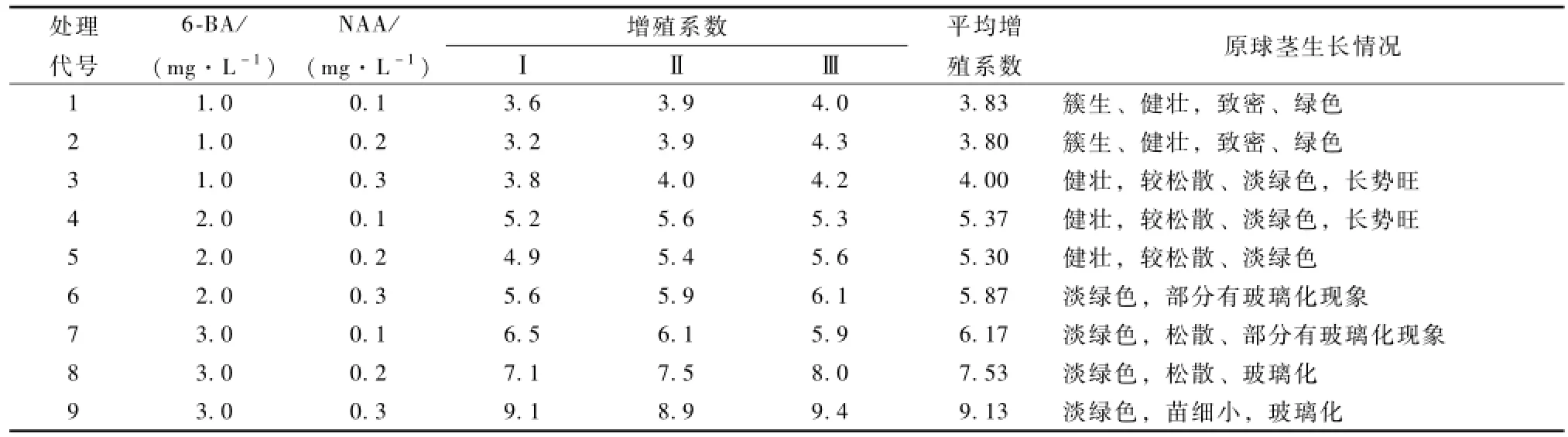
表5 6-BA与NAA浓度对原球茎增殖的影响
2.1.4 天然有机附加物对原球茎增殖影响研究
在3/4MS基本培养基加1.0 mg·L-16-BA+ 0.1 mg·L-1NAA条件下,分别添加20%的椰乳、马铃薯汁、香蕉泥、番茄汁,考查原球茎的增殖率和苗的健壮程度。
由表6可见,4种天然有机添加物对铁皮石斛苗增殖的影响不同,椰子汁与马铃薯汁效果最好,且两者差异不显著,组培苗均较粗壮,叶色浓绿。香蕉泥增殖效果次之,苗长势一般,叶色稍浅,但与前两者差异极显著,番茄汁增殖效果最差,且组培苗细弱发黄。
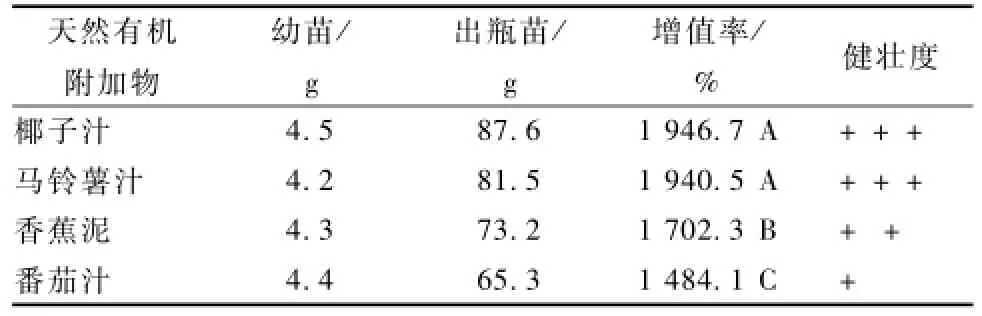
表6 天然有机添加物对幼苗增殖率的影响
2.2 铁皮石斛分化培养基激素的筛选
为研究不同激素配比对铁皮石斛原球茎分化的影响,以3/4MS为基本培养基,附加NAA,6-BA和KT等进行激素配比试验。培养45 d后统计原球茎分化的情况,结果如表7所示。 (1)添加一定浓度的NAA,6-BA,KT,可以增加分化芽数。处理①不使用激素的分化芽数最少,为30个;处理④,⑤,⑧之间差异不显著,分化芽数较多,为60个左右,其中,处理⑧的效果最好,分化芽数为65个。处理④,⑤,⑧与处理⑥,⑦间差异显著,而处理⑥,⑦与处理①,②,③间差异显著,这表明1.0~2.0 mg·L-1NAA与0.1~0.2 mg· L-16-BA对原球茎的分化有较好的促进作用,且苗的健壮度和整齐度较好,1.0 mg·L-1NAA+0.1 mg·L-16-BA+0.1 mg·L-1KT的激素组合,原球茎的分化率最高,健壮度较好,但整齐度一般,原球茎增殖较多。据此建议原球茎的分化激素配比为1.0 mg·L-1NAA+0.1 mg·L-16-BA,分化率较高,健壮度、整齐度最好。
2.3 铁皮石斛壮苗及生根
为研究不同添加物对石斛试管苗壮苗和生根的影响,以3/4MS为基本培养基,附加NAA,6-BA, IBA和有机物马铃薯汁,培养45 d后统计壮苗和生根情况 (表8)。(1)培养基中不添加任何植物生长调节剂和马铃薯汁,植株长势差,叶色淡绿,健壮度低。(2)在培养基中加入较高浓度的NAA(1~2 mg·L-1)和较低浓度的6-BA(0.1~0.2 mg·L-1),以及马铃薯汁,试管苗的叶色更绿,长势更强,健壮程度也会提高。在苗的生长势均较强的情况下,尽量降低植物生长素的使用浓度,以利于提高组培苗移栽成活率,所以建议壮苗培养基为1.0 mg·L-1NAA+0.1 mg·L-16-BA+10%马铃薯汁。

表7 不同激素对原球茎分化的影响

表8 不同激素及添加物对试管苗壮苗的影响
当分化后的小苗长成1~2 cm高,并分化出1~2片叶片时,将小苗接种在小苗生根培养基上,接种60 d后记录生根情况。无根小苗在接种20 d后开始出现根的分化,在茎基部或节上出现浅黄绿色突起,尖端颜色较浅,长度约1 mm。接种60 d后各处理的生根率在10%~65%。平均根长在2.43~4.10 cm,平均根数在5~12条,根为浅绿色,根表面光滑,一些小苗长出气生根,气生根特点是其表面有白色茸毛组成的根被。表9研究了不同浓度的NAA,6-BA,IBA及马铃薯汁对试管苗生根的影响 (表9),当不用任何激素和有机添加物时,60 d后生根率最低,仅为20%,平均根数也最少为5条,平均根长最短为2.43 cm,生长势也较弱,使用一定浓度的生长素NAA,配合一定浓度的6-BA,和添加10%的马铃薯汁对生根诱导有明显的促进作用,其中处理④和⑤组合的生根率相对较高,分别为60%和65%,平均根数和根长及生长势综合表现最好。建议生根植物生长调节剂为1.0~2.0 mg·L-1NAA+0.1~0.2 mg·L-16-BA,并添加10% 的马铃薯汁。

表9 不同激素配比及添加物对试管苗生根的影响
3 小结
采用1/2MS,3/4MS,MS,B5,N6等5种基本培养基,附加1.0 mg·L-1NAA+0.5 mg·L-16-BA进行不同培养基对铁皮石斛不同外植体的原球茎 (拟原球茎)诱导和增殖的影响,发现3/ 4MS为种子及茎段诱导最合适的基本培养基,且种子作为外植体,原球茎产生的数量大,从快繁速度上优于茎段,种子诱导原球茎增殖速度显著高于茎段,即种子做为外植体诱导增殖效果较茎段好。
茎段在3/4MS的基本培养基,在不同浓度的生长素2,4-D,NAA,IBA和不同浓度的细胞分裂素6-BA进行生长素和细胞分裂素交互作用对拟原球茎诱导和增殖试验得出,茎段的诱导培养基1.0 mg·L-16-BA+0.2 mg·L-1NAA组合下,诱导率最高可达60.00%,诱导时间最短,仅为17 d。原球茎增殖激素浓度为1.0~2.0 mg·L-16-BA +0.1~0.2 mg·L-1NAA时效果最好。
在3/4MS基本培养基加1.0 mg·L-16-BA+ 0.1 mg·L-1NAA条件下,分别添加20%的椰乳、马铃薯汁、香蕉泥、番茄汁,考查天然有机附加物对原球茎 (拟原球茎)增殖影响结果表明,椰子汁与马铃薯汁效果最好,且两者差异不显著,组培苗均较粗壮,叶色浓绿。有机物因地制宜采用本地资源马铃薯较为适宜,效果较好。
以3/4MS为基本培养基,附加NAA,6-BA和KT等进行激素配比试验研究不同激素配比对铁皮石斛原球茎分化的影响,结果表明,原球茎的分化激素配比为1.0 NAA+0.1 mg·L-16-BA,分化率较高,健壮度、整齐度最好。
以3/4MS为基本培养基,附加NAA,6-BA, IBA和有机物马铃薯汁研究不同添加物对石斛试管苗壮苗和生根的影响得出,壮苗培养基为1.0 mg· L-1NAA+0.1 mg·L-16-BA+10%马铃薯汁。生根培养基为1.0~2.0 mg·L-1NAA+0.1~0.2mg· L-16-BA,并添加10%马铃薯汁。
4 讨论
4.l 不同外植体研究
可用于铁皮石斛离体快繁的外植体有茎尖、茎节、叶片、花梗、侧芽、腋芽和种子等类型,据调查,现在生产应用最多是种子和茎段的快繁,由种子离体培养产生的胚性组织称为原球茎,茎尖、茎段等诱导形成的胚性组织称为拟原球茎。
种子作为外植体相比茎段,原球茎产生的数量多大,从快繁速度上优于茎段,种子的年增殖率为8.36×109,显著高于茎段的6.58×106;种子诱导原球茎增殖速度显著高于茎段,即种子作为外植体诱导增殖效果较茎段好。且种子诱导萌发后,约40 d左右转接1次,基本培养基选择3/4MS,用较低浓度的植物生长素,原球茎增殖激素浓度为1.0~2.0 mg·L-16-BA+0.1~0.2 mg·L-1NAA,原球茎的分化激素配比为1.0 mg·L-1NAA +0.1 mg·L-16-BA;壮苗培养基为1.0 mg·L-1NAA+0.1 mg·L-16-BA+10%马铃薯汁。生根培养基为1.0~2.0 mg·L-1NAA+0.1~0.2 mg·L-16-BA,并添加10%马铃薯汁。只要及时转接,原球茎和幼苗生长健壮,成苗周期相对较短,基本上从播种到瓶苗移出,可以控制在8个月左右,且苗的移栽成活率在95%以上。
4.2 基本培养基对铁皮石斛快繁的影响
在组织培养中,各种营养元素主要从培养基中获得,氧、氢元素从水中得到。矿物元素主要靠加入适量的无机盐类提供。常用的氮素有硝态氮和氨态氮,大多数培养基都以硝态氮为主。植物组织从培养基中吸收硝态氮以后,经过一系列的反应转化成氨基酸,进一步合成蛋白质。不同配方所采用的盐类及其数量有所差异,甚至出入很大,常根据培养基中含盐量的不同将培养基分为4大类[8]:第1类富集元素平衡培养基即高盐培养基,如 MS, LS,BL,ER等;第2类为高硝酸钾类培养基,如B5,N6等;第3类中无机盐含量的培养基,如H, Nitch;第4类为低无机盐培养基如White,WS, HE。目前使用最广泛的培养基为MS,其特点是高含量的氮、钾,尤其是硝酸盐的用量大,且含有一定数量的铵盐,因此营养丰富,能支持培养材料快速生长。
本试验采用1/2MS,3/4MS,MS,B5,N6等5种基本培养基,附加1.0 mg·L-1NAA+0.5 mg· L-16-BA进行不同培养基对铁皮石斛不同外植体的原球茎 (拟原球茎)诱导和增殖的影响,发现3/4MS为种子及茎段诱导最合适的基本培养基,1/ 2MS培养基盐分较低,原球茎颜色为淡绿色,3/ 4MS和MS培养基上诱导率较高,其中3/4MS培养基上诱导率最高,为85%,可见种子萌发及发育需要盐分较高的培养基,但过高的盐分也会使种子萌发率稍微下降,原球茎颜色偏黄。
在原球茎增殖分化阶段用3/4MS基本培养基,配合适当浓度的激素,效果较好,原球茎簇生、健壮、致密、绿色;壮苗生根阶段用3/4MS培养基,配合1.0 mg·L-1NAA+0.1 mg·L-16-BA+10%马铃薯汁,苗的健壮度最好。
4.3 生长调节剂与原球茎诱导增殖和分化成苗
在培养基的各种成分中,植物激素的作用是独特的。一般来说,大多数植物在任何一种基本培养基上的生长状况是相似的,基本培养基可保证植物材料的生存与最低的生理活动。但是若要植物进行细胞分裂、愈伤组织的诱导、分化和再生,根、芽的分化以及胚状体的发育等一系列生理活动,则必须用植物激素来调节。本试验在不同浓度的2,4-D,NAA,IBA和不同浓度的6-BA进行生长素和细胞分裂素交互作用对拟原球茎诱导和增殖试验得出:茎段的诱导培养基1.0 mg·L-16-BA+0.2 mg· L-1NAA组合下,诱导率最高可达60.00%,诱导时间最短,仅为17 d。原球茎增殖激素浓度为1.0~2.0 mg·L-16-BA+0.1~0.2 mg·L-1NAA时效果最好。
本试验在原球茎分化与幼苗生长阶段,使用较高浓度的生长素,配合较低浓度的细胞分裂素,即壮苗阶段培养基为1.0 mg·L-1NAA+ 0.1 mg·L-16-BA+10%马铃薯汁。生根培养基为1.0~2.0 mg·L-1NAA+0.1~0.2 mg·L-16-BA,并添加10%马铃薯汁,铁皮石斛苗长势最好,生根速度较快,这一结论说明了较高浓度的NAA与较低浓度的6-BA的配合有利于幼苗生长和生根,且效果较好。单独使用NAA或2,4-D,对幼苗生长效果并不好,说明同一类激素不同种类间的效应差异和植物物种或品种对激素反应的特异性,反映了激素作用的复杂性,因此植物组培的不同阶段激素配比试验是组培能否成功的关键。
[1] 徐建华,陈立钻.铁皮石斛与西洋参的养阴生津作用研究[J].中草药,1995,26(2):79-80.
[2] 吉占和.中国植物志 [M].北京:科学出版社, 1999,85-88.
[3] 周根余,谢薇.影响铁皮石斛原球茎生长的若干因素[J].江西科学,1999,17(4):231-235.
[4] 张启香,付素静,方炎明,等.铁皮石斛拟原球茎的发生过程 [J].浙江林学院学报,2009,26(3):444-448.
[5] 陈兆贵,谭俊.不同激素配比对铁皮石斛组织培养的影响研究 [J].惠州学院学报,2006,26(3):11-14.
[6] 张书萍,白石,陈丽静.铁皮石斛的组织培养与快速繁殖[J].辽宁农业科学,2008(6):12-15.
[7] 蒙平,张向军,蒋慧萍,等.铁皮石斛组培苗规模化驯化技术 [J].农技服务,2009,26(1):120-122.
[8] 薛庆善,肖渝平,林娟.体外培养的原理与技术 [M].北京:科学技术出版社,2001.
(责任编辑:张瑞麟)
S 567
:A
:0528-9017(2014)04-0492-06
文献著录格式:吴菊,严中琪,杨飞,等.铁皮石斛组培快繁关键技术研究 [J].浙江农业科学,2014(4):492-497.
2013-12-09
舟山市科技计划项目 (10123)
吴 菊 (1979-),江苏睢宁人,农艺师,本科,从事植株组培快繁、蔬菜无土栽培技术研究工作。E-mail:wuju-79-2000 @tom.com。

