人脂肪来源干细胞与左旋聚乳酸/聚己内酯支架的体内外生物相容性研究
姚海军 赵 阳 周 哲 肖冬冬 周 娟 张 明 王 忠 何创龙 卢慕峻
人脂肪来源干细胞与左旋聚乳酸/聚己内酯支架的体内外生物相容性研究
姚海军 赵 阳 周 哲 肖冬冬 周 娟 张 明 王 忠 何创龙 卢慕峻
目的观察人脂肪来源干细胞(Human adipose-derived stem cells,hA D SCs)在左旋聚乳酸/聚己内酯(Poly-L-lactide/Polycaprolactone,PLLA/PCL)复合支架材料中的生长情况及其生物相容性。方法体外分离、培养和扩增hA D SCs,制备PLLA/PCL复合支架。取PLLA/PCL浸提液培养hADSCs,CCK-8法检测细胞活力,评价支架的细胞毒性。hADSCs传代扩增后,接种到PLLA/PCL支架材料上。体外培养1周,裸鼠皮下分别培养1周、2周,HE染色观察细胞在支架上的生长情况。免疫荧光检测裸鼠体内复合支架材料内细胞平滑肌肌动蛋白(Smooth muscle actin,SMA)表达情况。结果hADSCs在PLLA/PCL浸提液中可保持较高的增殖率,表明PLLA/PCL浸提液无细胞毒性。hA D SCs接种于PLLA/PCL支架上,经体外、体内培养后,均能长入PLLA/PCL支架的孔隙内,且体内培养比体外培养有更多的细胞长入支架内部。经体内培养后,复合细胞的支架比单纯支架有更多的细胞渗入支架内部。细胞材料复合物体内培养2周后,免疫荧光检测发现,支架材料内部分细胞SMA表达阳性。结论PLLA/PCL复合支架材料,安全无毒,与hA D SCs生物相容性好,可作为种子细胞的载体用于组织工程膀胱缺损修复的研究。
人脂肪来源干细胞左旋聚乳酸聚己内酯生物相容性
膀胱肿瘤、结核、神经源性膀胱以及一些先天性膀胱疾病(如膀胱外翻)都可导致膀胱缺损,需进行膀胱修复。利用胃肠道替代膀胱是目前最常用的方法,但存在着诸多并发症,如结石、肿瘤、电解质紊乱等,且会造成供区损伤,如肠梗阻、肠瘘和尿瘘等。近年来利用组织工程技术进行膀胱修复重建的实验和临床研究逐年增加[1-2]。目前,大部分膀胱组织工程重建研究都采用种子细胞复合支架材料的方法。脂肪来源干细胞(A dipose-derived stem cells,ADSCs)具有自我更新及多向分化潜能,能够向平滑肌细胞、尿路上皮样细胞、内皮细胞、神经样细胞等分化,并可分泌多种生长因子,具有来源丰富、取材方便、安全等优势,是具有巨大研究潜力和广阔临床应用前景的种子细胞源。左旋聚乳酸(Poly-L-lactide,PLLA)和聚己内酯(Polycaprolactone,PCL)都是人工合成聚合材料,安全无毒,是FDA认可的生物材料[3-4]。但是PLLA的分子链呈刚性,脆性太高,亲水性差[5-6],而PCL的分子链较软,具有良好的柔韧性和可加工性,亲水性强,但降解速度过慢[7-8]。研究表明,单一成分材料难以满足膀胱组织工程重建的要求,但可以利用PCL对PLLA进行改性,联合两种材料的优势,制备符合膀胱重建需求的复合型支架。本实验将hADSCs置于PLLA/PCL浸提液中培养,检测PLLA/ PCL的细胞毒性,并将hADSCs种植于PLLA/PCL支架上,进行体内、外培养,观察细胞生长情况。进一步探讨PLLA/PCL作为hADSCs的支架材料用于组织工程膀胱缺损修复的可行性。
1 材料与方法
1.1 材料
本实验研究得到上海交通大学医学院伦理委员会批准。hADSCs取自我院整复外科抽脂术后废弃的人脂肪组织,并获患者知情同意。PLLA(宁波环球塑料制品有限公司),PCL(上海天清材料有限公司),PLLA-PCL复合支架由东华大学化学化工与生物工程学院制备并提供。
1.2 方法
1.2.1 hADSCs的分离培养
将抽脂术后废弃的人脂肪组织用PBS冲洗3遍,洗去血液和麻醉液。加入等体积的0.075%的胶原酶Ⅳ,37℃恒温振荡消化1 h,1 500 r/min,5 min,37℃离心,去除悬浮的脂肪和上清液,加入含10%胎牛血清的低糖DMEM培养基,重悬细胞,并置于37℃含5%CO2的细胞培养箱中培养。48 h后更换培养液1次,以后每3天换液1次。4~6 d细胞生长融合达80%~90%后,0.25%胰酶-EDTA消化,按1∶3进行传代培养。
1.2.2 PLLA/PCL支架的制备及扫描电镜观察
将PLLA与PCL按照质量比3∶1混合后,利用热致相分离技术得到多孔PLLA-PCL聚合物复合支架,PLLA/PCL孔径约40μm,孔隙率约为90%,孔间连通性较好。将材料制备成10 mm×10 mm,厚2 mm的补片,乙醇消毒备用。将上述方法制备得到的PLLA-PCL支架喷金镀膜,在液氮中脆断,喷金处理,扫描电镜观察。
1.2.3 hADSCs在PLLA-PCL浸提液中增殖率测定
PLLA-PCL支架用75%乙醇浸泡消毒过夜,PBS洗去残留乙醇,并加入低糖DMEM完全培养基,置37℃、5%CO2的细胞培养箱中24 h,收集浸提液,备用。将第3代hADSCs接种于96孔板中培养24 h后吸出培养基,分别添加100μL低糖DMEM完全培养基(对照组)和100μL PLLA-PCL浸提液(实验组),继续培养。于第1、3、7天,每组各取6个孔。每孔加入10μL CCK-8溶液,混匀后继续培养2 h。然后酶标仪测定450 nm波长时的A值,计算相对增殖率并进行毒性分级。
1.2.4 hADSCs种植于PLLA/PCL支架
消毒后备用的PLLA/PCL支架用PBS冲洗后,加入低糖DMEM完全培养基预培养过夜。将上清及材料表面的培养基吸净,选取生长较好的第3代hADSCs,制成密度为1×107cells/m L的细胞悬液,每个材料表面均匀滴加200μL细胞悬液,静置2 h后加入低糖DMEM完全培养基,并置于37℃、5%CO2及饱和湿度的培养箱中培养,3 d换液一次;用于体内试验的细胞材料复合物预先在体外培养3 h再植入裸鼠皮下,并植入单纯支架材料作为对照。
1.2.5 组织学观察
体外培养的细胞-支架复合物培养1周后取材。体内培养的材料1周、2周后取材。4%多聚甲醛固定6 h,30%蔗糖脱水过夜,OCT包埋,冰冻切片(8μm厚),HE染色。光镜下观察细胞在支架内的生长情况。
1.2.6 体内培养的细胞-支架复合物免疫荧光检测
体内培养的细胞-支架复合物于2周后取材,冰冻切片。将切片浸水10 h,洗去OCT,柠檬酸微波法修复抗原,自然冷却,用0.3%的Triton破膜15 min,滴加羊血清封闭非特异性抗原,一抗为兔抗人SMA抗体,4℃过夜,二抗为带有红色荧光标记的羊抗兔抗体,DAPI染细胞核,荧光封片,避光保存。
1.2.7 统计学分析
SPSS17.0软件行统计学分析,数据以x±s表示。组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 hADSCs的形态和生长特性
经胶原酶消化后的原代细胞培养96 h后,已有部分成纤维细胞样形态的细胞贴壁,培养液上层可见悬浮的红细胞和脂滴。贴壁细胞多呈长梭形,可见少量三角形及多边形细胞(图1A)。随培养时间延长,细胞转为梭形。培养5~7 d细胞可达80%~90%融合。传代的细胞主要为梭形,少数为三角形或多边形(图1B)。我们的前期研究表明[9],该方法分离的细胞可成骨、成脂诱导。流式细胞鉴定发现:CD29表达为99.77%,CD44表达为97.1%,CD73表达为96.54%,CD105表达为93.06%,CD45表达为0.37%,CD34表达为1.38%,提示分离得到的细胞是hADSCs。
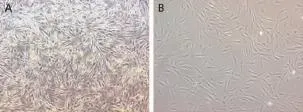
图1 hADSCs形态学观察(40×)Fig.1 Morphological observation of hADSCs(40×)
2.2 支架材料的制备
制备的PLLA-PCL多孔支架外观呈白色(图2A),孔径为40μm左右,但大小不一(图2B),孔隙率为91.45%左右,与理论值(约90%)相似。

图2 PLLA/PCL支架材料大体观及扫描电镜观察Fig.2 Gross observation and SEMobservation of PLLA/PCL
2.3 hADSCs在PLLA/PCL浸提液中增殖率的测定
第1、3、7天实验组相对增殖率分别为98.1%、100.7%和108.4%,平均相对增殖率为102.4%,与对照组无显著差异(P>0.05),说明浸提液对细胞增殖无明显影响。浸提液在第1、3、7天的细胞毒性分别为I级、0级和0级,说明PLLA/PCL浸提液无细胞毒性。
2.4 细胞在支架上的生长情况
hADSCs种植在PLLA/PCL支架后,经过体外、内培养,hADSCs均能黏附在支架的边缘,部分细胞渗透入支架,但支架内部长入细胞较少。其中体外培养1周,已有细胞贴附在材料边缘生长,少量细胞渗透入支架内部浅层。体内培养1周,细胞黏附生长在PLLA/PCL支架的边缘,且已有部分渗透到材料内部。体内培养2周后,较多细胞能渗透到材料内部。且体内培养比体外培养有更多的细胞长入支架;经体内培养后,复合种子细胞的支架比单纯支架有更多的细胞渗入支架内部,且细胞-材料复合支架体内培养2周后,免疫荧光a-SMA抗体检测发现,材料内部部分细胞阳性表达(图3)。
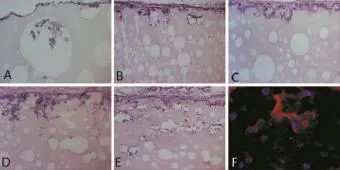
图3 细胞材料复合物形态学观察(200×)和免疫荧光检测(a-SMA,200×)Fig.3 Morphological observation(200×)and immunofluorescence assay(a-SMA,200×)of PLLA-PCL scaffold compound with hA D SCs
3 讨论
组织工程膀胱缺损的修复主要涉及平滑肌细胞(Smooth muscle cell,SMC)和尿路上皮细胞(Urothelial cell,UC)。ADSCs通过诱导可向SMC分化,表达平滑肌特异性的标志物,并具备收缩和舒张功能,可用于修复膀胱肌层缺损[10-13]。近期发现ADSCs还能向UC表型分化[9,14-15]。脂肪组织还具有来源丰富、取材方便、损伤小等优势,已成为理想的种子细胞来源。
支架材料是组织工程膀胱修复重建的重要基础。理想的膀胱修复材料应具有良好的生物相容性,可靠的机械性能,能抵抗腹膜内及腹膜外感染,不影响正常肾功能,具有良好的收缩能力,并通过神经和膀胱平滑肌再生后具有自主排尿功能等[16]。单一成分材料难以满足膀胱修复重建的需求[10,17-19]。研究表明,人工合成高分子聚合材料可制备成不同形状与结构的三维支架,并精确地控制其机械性能、降解率、孔隙率和孔径。PLLA分子链呈刚性,脆性太高,降解速度快;而PCL具有良好的生物降解性和柔韧性,本实验联合两者优势性能,制备成PLLA/PCL复合支架,并复合hADSCs,探讨其细胞相容性。
本实验将hADSCs在PLLA/PCL浸提液中培养1、3、7 d,各时间点实验组和对照组细胞相对增殖率无显著性差异(P>0.05)。说明PLLA/PCL浸提液无明显的细胞毒性。hADSCs种植于PLLA/PCL支架,经体内、外培养后,均能长入PLLA/PCL支架孔隙内,表明PLLA/PCL具有良好的细胞亲和性,PLLA用PCL修饰后,其疏水性能改善明显,有利于细胞的黏附生长。实验结果表明体内培养比体外培养有更多的细胞长入支架内部,可能是由于体内环境为细胞生长提供了丰富的血供和营养,更利于细胞的黏附、增殖。而经体内培养后,复合种子细胞的支架比单纯支架有更多的细胞渗入支架内部,可能是hADSCs在体内进一步扩增的结果,亦或是hADSCs分泌的细胞因子,促进了裸鼠细胞向支架内部生长,其中可能涉及自分泌和旁分泌的机制[20-22]。SMA抗体检测发现,支架材料内部分细胞阳性表达,说明PLLA/PCL支架内部分细胞来源于hADSCs。我们前期分别用猪膀胱脱细胞基质(Bladder acellular matrix graft,BAMG)和人工合成材料聚羟基乙酸(Polyglycolic acid,PGA)作为支架材料用于组织工程膀胱修复[23-24]。发现BAMG虽然材料致密,细胞渗透材料内部较少,但具有多种活性因子,生物相容性较好,可促进细胞黏附,有利于组织修复,在体外成功进行了膀胱平滑肌结构的构建。PGA生物相容性及可塑性良好,作为支架材料并复合膀胱平滑肌细胞和尿路上皮细胞,可体外构建类似复层膀胱壁结构。而尽管PLLA/PCL复合材料具有多孔结构,但细胞长入支架内部尤其是中心区域较少,和上述复合材料相比,该复合材料的渗透性仍需改进[l4]。
[1]Chung YG,Algarrahi K,Franck D,et al.The use of bi-layer silk fibroin scaffolds and small intestinal submucosa matrices to support bladder tissue regeneration in a rat model of spinal cord injury [J].Biomaterials,2014,35(26):7452-7459.
[2]Zhu WD,Xu YM,Feng C,et al.Different bladder defects reconstructed with bladder acellular matrix grafts in a rabbit model[J]. Urologe A,2011,50(11):1420-1425.
[3]Rotunda AM,Narins RS.Poly-L-lactic acid:a new dimension in soft tissue augmentation[J].Dermatol Ther,2006,19(3):151-158.
[4]Pihlajamaki H,Bostman O,Tynninen O,et al.Long-term tissue response to bioabsorbable poly-L-lactide and metallic screws:an experimental study[J].Bone,2006,39(4):932-937.
[5]Zhao Z,Zhang Z,Chen L,et al.Biodegradable stereocomplex micelles based on dextran-block-polylactide as efficient drug deliveries[J].Langmuir,2013,29(42):13072-13080.
[6]Rasal RM,Janorkar AV,Hirt DE.Poly(lactic acid)modifications [J].Prog Polym Sci,2010,35(3):338-356.
[7]Jung Y,Park MS,Lee JW,etal.Cartilage regeneration with highlyelastic three-dimensional scaffolds prepared from biodegradable poly(L-lactide-co-epsilon-caprolactone)[J].Biomaterials,2008, 29(35):4630-4636.
[8]Cha KJ,Lih E,Choi J,et al.Shape-memory effect by specific biodegradable polymer blending for biomedical applications[J]. Macromol Biosci,2014,14(5):667-678.
[9]Zhang M,Peng Y,Zhou Z,etal.Differentiation ofhuman adiposederived stem cells co-cultured with urothelium cell line toward a urothelium-like phenotype in a nude murine model[J].Urology, 2013,81(2):e15-e22.
[10]Atala A,Bauer SB,Soker S,et al.Tissue-engineered autologous bladders for patients needing cystoplasty[J].Lancet,2006,367 (9518):1241-1246.
[11]Yoo JJ,Meng J,Oberpenning F,et al.Bladder augmentation using allogenic bladder submucosa seeded with cells[J].Urology,1998, 51(2):221-225.
[12]Zhang Y,Lin HK,Frimberger D,et al.Growth of bone marrow stromal cells on small intestinal submucosa:an alternative cell source for tissue engineered bladder[J].BJU Int,2005,96(7): 1120-1125.
[13]Yokoyama T,Huard J,Pruchnic R,et al.Muscle-derived cell transplantation and differentiation into lower urinary tract smooth muscle[J].Urology,2001,57(4):826-831.
[14]Taha MF,Hedayati V.Isolation,identification and multipotential differentiation of mouse adipose tissue-derived stem cells[J]. Tissue Cell,2010,42(4):211-216.
[15]Rodriguez LV,Alfonso Z,Zhang R,et al.Clonogenic multipotent stem cells in human adipose tissue differentiate into functional smooth muscle cells[J].Proc Natl Acad Sci U S A,2006,103(32): 12167-12172.
[16]Maurer S,Feil G,Stenzl A.In vitro stratified urothelium and its relevance in reconstructive urology[J].Urologe A,2005,44(7): 738-742.
[17]Xu F,Wang Y,Jiang X,et al.Effects of different biomaterials: comparing the bladdersmooth muscle cells on waterborne polyurethane or poly-lactic-co-glycolic acid membranes[J].Kaohsiung J Med Sci,2012,28(1):10-15.
[18]Stankus JJ,Freytes DO,Badylak SF,et al.Hybrid nanofibrous scaffolds from electrospinning of a synthetic biodegradable elastomer and urinary bladder matrix[J].J Biomater Sci Polym Ed,2008,19 (5):635-652.
[19]Engelhardt EM,Micol LA,Houis S,et al.A collagen-poly(lactic acid-co-varepsilon-caprolactone)hybrid scaffold for bladder tissue regeneration[J].Biomaterials,2011,32(16):3969-3976.
[20]Zhang R,Jack GS,Rao N,et al.Nuclear fusion-independent smooth muscle differentiation of human adipose-derived stem cells induced by a smooth muscle environment[J].Stem cells, 2012,30(3):481-490.
[21]Huang YC,Ning H,Shindel AW,et al.The effect of intracavernous injection of adipose tissue-derived stem cells on hyperlipidemiaassociated erectile dysfunction in a rat model[J].J Sex Med, 2010,7(4 Pt 1):1391-1400.
[22]Nishimatsu H,Suzuki E,Kumano S,etal.Adrenomedullin mediates adipose tissue-derived stem cell-induced restoration of erectile function in diabetic rats[J].J Sex Med,2012,9(2):482-493.
[23]卢慕峻,王忠,周广东,等.组织工程化膀胱壁复层结构的体外构建[J].中华泌尿外科杂志,2007,27(Suppl):67-70.
[24]卢慕峻,王忠,董国勤,等.聚羟基乙酸作为支架材料体外构建复层膀胱壁结构的探讨[J].临床泌尿外科杂志,2009,24(12):935-938.
Biocompatibility on Human Adipose-Derived Stem Cells Co-cultured with Poly-L-lactide/Polycaprolactone Scaffold
YAO Haijun1,ZHAO Yang1,ZHOU Zhe1,XIAO Dongdong1,ZHOU Juan1,ZHANG Ming1,WANG Zhong1,HE Chuanglong2, LU Mujun1.1 Department of Urology,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine, Shanghai 200011,China;2 College of Chemistry,Chemical Engineering and Biotechnology,Donghua University,Shanghai 200051,China.Corresponding author:LU Mujun(E-mail:lumujun@163.com).
ObjectiveTo observe the growth of human adipose-derived stem cells(hA D SCs)on Poly-L-lactide/ Polycaprolactone composite scaffold materials and the biological compatibility.MethodshASCs were isolated from human subcutaneous adipose tissue and PLLA/PCL scaffold was prepared.The cytotoxicity of scaffold was evaluated by CCK-8 cell viability assay.The P3 hASCs were seeded onto the PLLA/PCL scaffolds.The growth of cell in PLLA/PCL biomaterials in vivo(1 w and 2 w)and in vitro(1 w)was observed by HE staining.The expression of SMA of the seeding cells in vivo was detected by immunofluorescence.ResultshA D SCs maintained high proliferation rate in the leaching solution of the PLLA/ PCL and the PLLA/PCL scaffolds were nontoxic absolutely.The histological study found that hA D SCs could grow into the space of the PLLA/PCL scaffolds after cultured in vitro and in vivo.There were more cells in the scaffolds cultured in vivo than in vitro,also more cells in the cell-seeded scaffold than simple scaffold.Some of the seeding cells were positive for SMA after 2 weeks implanted in the scaffold in vivo.ConclusionPLLA-PCL composite scaffolds are nontoxic and have a good biocompatibility with hA D SCs,which can be used as a vehicle for hA D SCs in the repair of bladder defect.
Human adipose-derived stem cells;Poly-L-lactide;Polycaprolactone;Biocompatibility
Q813.1+1
A
1673-0364(2014)05-0255-04
2014年4月21日;修复日期:2014年6月12日)
10.3969/j.issn.1673-0364.2014.05.005
国家自然科学基金面上项目(81370860,81070605);上海交通大学“医工(理)交叉研究基金”(YG2011MS14)。
200011上海市上海交通大学医学院附属第九人民医院泌尿外科(姚海军,赵阳,周哲,肖冬冬,周娟,张明,王忠,卢慕峻);200051上海市东华大学化学化工与生物工程学院(何创龙)。
卢慕峻(E-mail:lumujun@163.com)。
注:姚海军,赵阳为共同第一作者。

