丙酮提取菠萝皮抑菌物的条件研究
谭雯文,刘亭君
(1.广西工业职业技术学院,广西 南宁 530001;2.桂林理工大学化学与生物工程学院,广西矿冶与环境科学实验中心,广西 桂林 541004)
菠萝又名凤梨,主要分布在我国广西、云南、广东、海南、台湾等地区,是我国南方栽培面积最大,产量较多的大宗水果之一,华南地区年产量超过110万t[1]。目前国内菠萝的加工产品主要是糖水菠萝罐头、菠萝果汁,但在加工过程中几乎有50%~60%的下脚料——菠萝皮渣被随意丢弃[2],不仅浪费了大量的资源,又严重影响加工区的生态环境。据报道[3-4],菠萝皮渣中含有的营养成分与果肉相接近,如何综合高效地利用废弃的菠萝皮,使其变废为宝,国内外已有很多有益的尝试,但主要集中在作为发酵原料生产饮料、果酒,而有关菠萝皮抑菌作用的研究,目前国内尚未见公开报道。
寻找安全有效的天然防腐保鲜剂是目前国内外研究的热点。本实验以对4种常见的食品污染菌的抑菌圈为优化指标,以丙酮为溶剂对菠萝皮进行提取,采用正交法确定菠萝皮有效抑菌成分的提取条件,并研究该条件下提取液的最小抑菌浓度(MIC),为开辟菠萝皮新用途提供理论依据。
1 材料与方法
1.1 材料与仪器
菠萝皮:将新鲜的菠萝皮切片,于60℃恒温干燥箱烘24h,粉碎后装入密封袋室温保存。
供试菌种:细菌:大肠杆菌(Escherichia col i)、金黄色葡萄球菌(Staphyl ococcus aureus);霉菌:黑曲霉(Aspergill us niger)、桔青霉(Penicil lium citrinum)。以上菌种均由桂林理工大学生物工程实验室保藏。
培养基:大肠杆菌采用牛肉膏蛋白胨琼脂培养基,金黄色葡萄球菌采用营养肉汤培养基,霉菌采用马铃薯葡萄糖(PDA)培养基[5]。
HWS-24电热恒温水浴锅,LSH-150-2振荡培养箱,SWCJ-IF超净操作台,RE-2000A真空旋转蒸发仪,TDZZ5-WS台式低速自动平衡离心机,SHZD(Ⅲ)循环水式真空泵,DFY-800高速粉碎机。
1.2 实验方法
1.2.1 菌种活化及菌悬液的制备
将4种供试菌种接入相应的摇瓶培养基中进行活化,细菌活化18h,霉菌活化40h,然后再将活化后的菌种转接到相对应的斜面培养基上进行培养。用接种环分别刮取一定量已活化好的菌种于9mL无菌生理盐水中,充分摇匀,再用10倍稀释法将菌悬液稀释至含菌量为107CFU·mL-1的实验用菌悬液[6]。
1.2.2 菠萝皮提取物的制备及工艺条件研究
由于影响菠萝皮有效抑菌成分提取的因素很多,经反复小试,决定对料液比、丙酮浓度、提取时间、提取温度4个主要因素,3个水平进行正交试验,方案见表1[7]。

表1 正交因素水平表
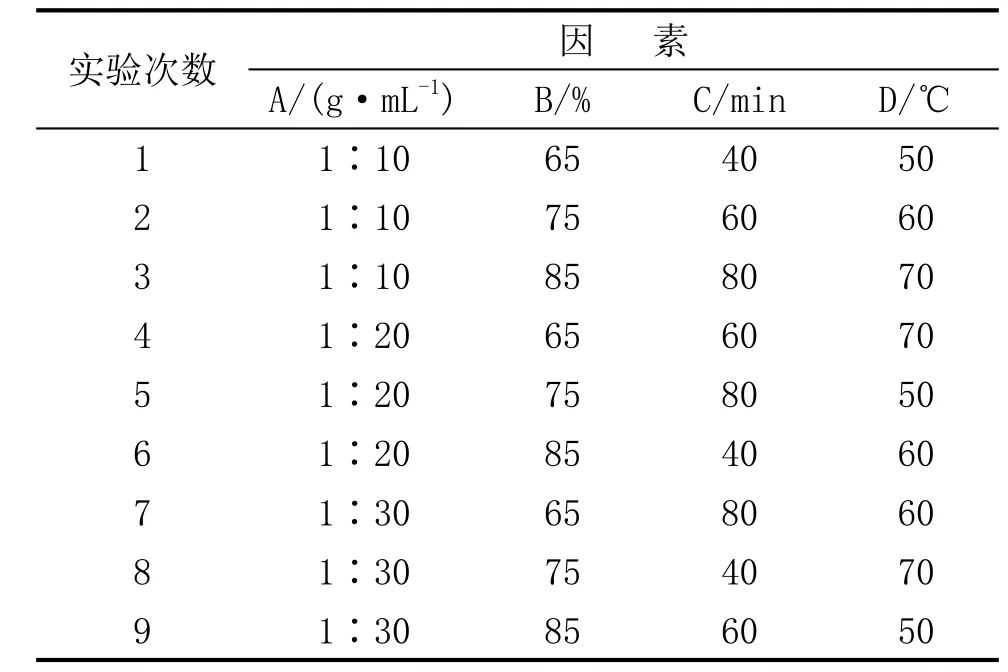
表2 菠萝皮提取液试验设计方案
具体操作如下:称取粉碎后的菠萝皮10g,按规定的料液比加入相应浓度的丙酮溶液于具塞三角瓶中,在恒温水浴锅中震荡浸提至规定时间,然后3000r·min-1离心5min,用纱布过滤,取清液用真空旋转蒸发器浓缩至膏状,再用蒸馏水溶解定容至10mL,其浓度为 1000mg·mL-1(指 1mL提取液相当于1000mg菠萝皮干样品),最后置于4℃冰箱中保存待用。
1.2.3 提取物抑菌活性的测定
将15mL经高压灭菌的培养基倒入无菌培养皿中,静置冷却,待凝后加入0.1mL菌悬液于平板上,用无菌玻璃涂布棒将菌液涂布均匀,制成带菌平板[8]。然后用无菌打孔器打出直径为6mm的孔,在每个孔加入80 µL菠萝皮丙酮提取液,以无菌水做空白对照,平行3次。细菌于36℃恒温培养24h,霉菌于27℃培养48h。观察菌落生长情况,采用十字交叉法测量抑菌圈直径。
1.2.4 最低抑菌浓度(MIC)的测定
按1.2.3的试验结果,将在最佳提取工艺条件下提取的丙酮菠萝皮提取物配制成600、400、300、250、200、150、100、 80、 60、40mg·mL-1等系列浓度,参照抑菌活性实验步骤,以未加提取物的培养基为对照培养各测试平板至相应培养时间,观察各菌体生长情况,比较提取物不同浓度溶液的抑菌效果, 每个浓度做3个平行。以培养基打孔周围无菌生长的最低提取浓度为该提取物的最低抑菌浓度(MIC)[9-10]。
2 结果与分析
2.1 正交提取过程因素的变化对提取物抑菌效果的影响
表3是提取工艺条件的正交实验结果。从表3中可以看出,菠萝皮丙酮提取物对大肠杆菌、金黄色葡萄球菌和黑曲霉都有抑菌作用,其中对大肠杆菌的抑制作用最强,最大抑菌直径达(28.40±0.31)mm,抑菌效果为大肠杆菌>黑曲霉>金黄色葡萄球菌;而提取物对桔青霉无抑菌效果。

表3 提取工艺条件正交试验结果
2. 2 正交试验结果的极差分析
表4~6分别为正交试验对大肠杆菌、黑曲霉、金黄色葡萄球菌的极差分析表。从表4、5、6中数据可知,菠萝皮丙酮提取物对大肠杆菌和黑曲霉的抑菌效果最佳的提取工艺条件均为料液比1∶30,丙酮浓度75 %,提取时间40 min,提取温度70℃。各因素对大肠杆菌抑制能力的影响顺序为:丙酮浓度>料液比>提取时间>提取温度。对黑曲霉抑制能力的影响顺序为:料液比>丙酮浓度>提取温度>提取时间。其中丙酮浓度对结果的影响比较显著。而抑菌物对金黄色葡萄球菌最佳的提取工艺条件为:料液比1∶10,丙酮浓度65 %,提取时间40 min,提取温度50℃。各因素对金黄色葡萄球菌抑制能力的影响大小顺序为:丙酮浓度>提取时间>提取温度>料液比。

表4 正交试验对大肠杆菌的极差分析表

表5 正交试验对黑曲霉的极差分析表
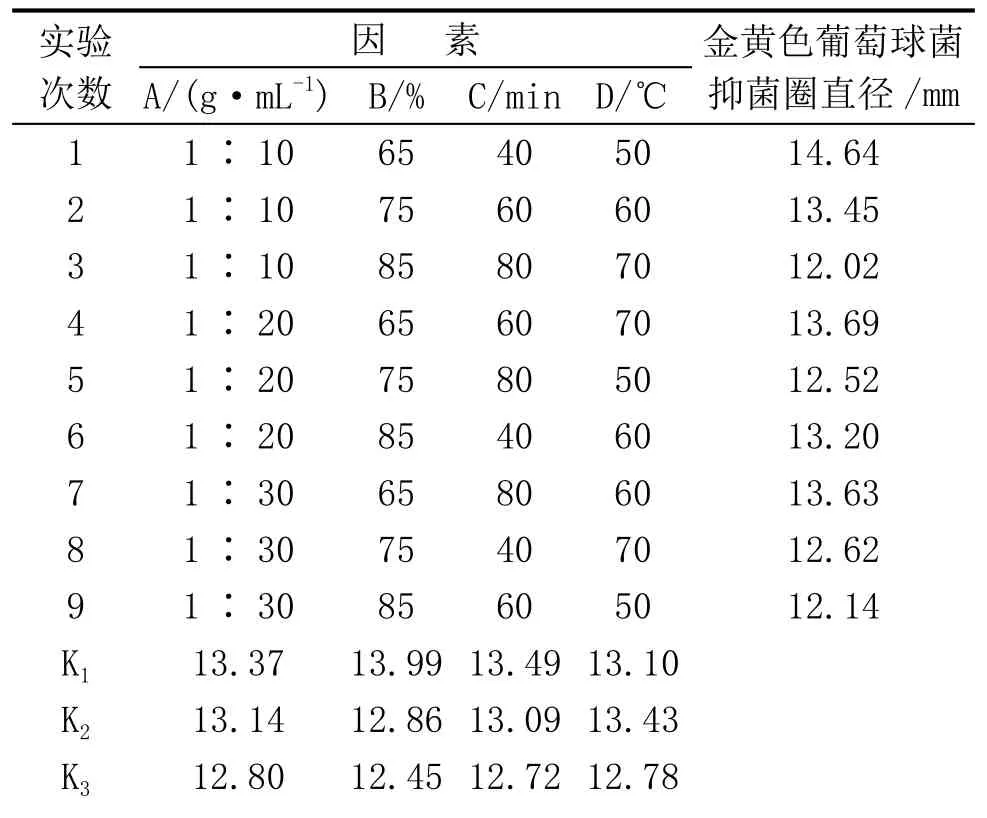
表6 正交试验对金黄色葡萄球菌的极差分析表
注:Ki代表各因素i水平下抑菌圈平均值
2.3 最低抑菌浓度(MIC)的测定结果
表7是菠萝皮提取物最小抑菌浓度的测定结果。从表7可知,在各自最佳提取工艺条件下,丙酮菠萝皮提取物对大肠杆菌、金黄色葡萄球菌、黑曲霉的最低抑菌浓度(MIC)分别为 60、250、100mg·mL-1。
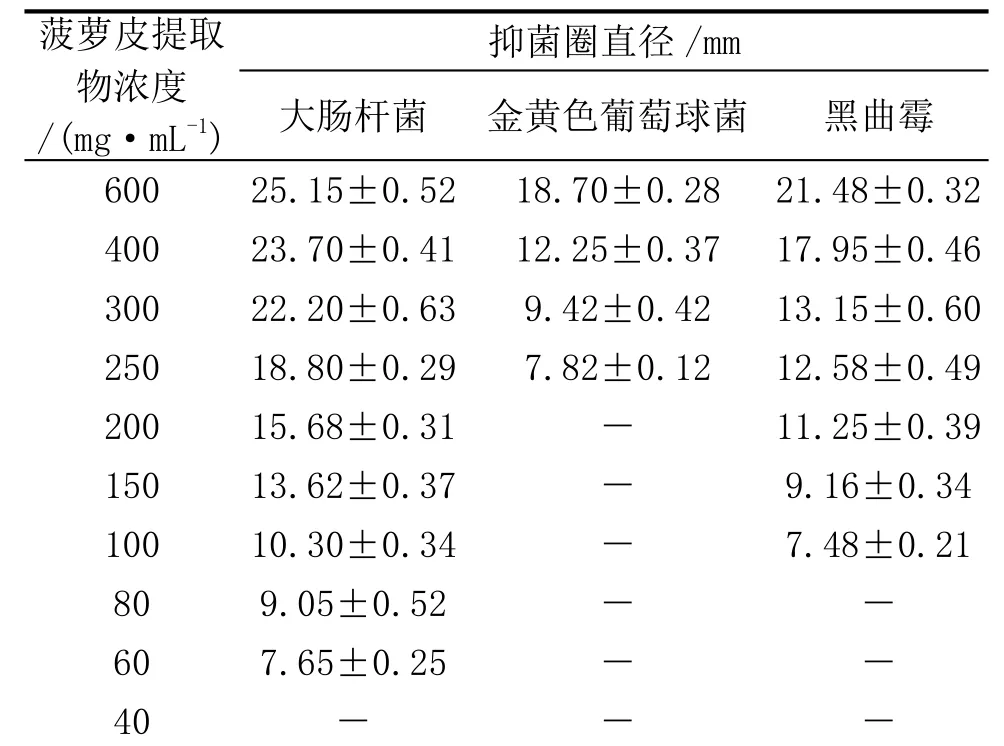
表7 菠萝皮提取物最小抑菌浓度的测定
3 结果与讨论
1) 试验证明了菠萝果皮中含有抑菌物质,以丙酮为溶剂提取,提取液对大肠杆菌、金黄色葡萄球菌、黑曲霉等常见的食品污染菌具有较强的抑制作用,对桔青霉则无。同一条件下,提取液对大肠杆菌的抑制效果最强。
2) 通过正交试验优化丙酮的提取条件,对大肠杆菌和黑曲霉的抑菌效果最佳的提取工艺条件均为:料液比1∶30,丙酮浓度75%,提取时间40 min,提取温度70℃。对金黄色葡萄球菌最佳的提取工艺条件为:料液比1∶10,丙酮浓度65%,提取时间40 min,提取温度50℃。
3) 在优化条件下,菠萝皮丙酮提取物对大肠杆菌、黑曲霉、金黄色葡萄球菌的MIC分别为60、100、250mg·mL-1。
[1] 刘海清,李光辉,黄媛媛,等.2011年中国菠萝产业发展现状分析[J].热带农业科学,2011,32(3):79-83.
[2] 黄发新,詹云辉. 菠萝皮渣酿制白兰地的初步研究[J ].广西热作科技,1997(2):31-35.
[3] Sanchaisurinya P, Thammabut B. Effect of pineapple waste in growing-finishing pig diets[J]. Kaen-Kaset Agriculture Journal,l 944,22(4):193-197.
[4] 苑艳辉.菠萝皮的综合利用[J].食品与发酵工业,2005,31(2):145-147.
[5] 程丽娟,薛泉宏.微生物学试验技术[M].西安:世界图书出版社公司,2000.
[6] 沈萍,范秀容,李广武.微生物学实验(第3版)[M].北京:高等教育出版社,1999.
[7] 北京大学数学力学系数学专业概率统计组.正交设计:一种安排多因素试验的数学方法[M].北京:人民教育出版社,1977:95-130.
[8] 古丽扎尔. 阿布都克依木,等.红果龙葵水提液与乙醇提取液的抑菌作用[J].食品科学,2010,31(17):133-135.
[9] 杨洋,覃记杰,等.仙人掌提取物的抑菌作用[J].精细化工,2005,22(4):269-272.
[10] 张文波,韦文龙,李宏睿.苦瓜多糖超声波提取与抑茵活性的研究[J].时珍国医国药,2011,22(7):1676-1677.

