牛病毒性腹泻病毒E2截短基因重组卡介苗安全性和最佳免疫剂量的研究
杨宇航,李 晶,张 云,郝俊伟,刘东旭,时 坤,李健明,曾范利杜 锐.2*
(1.吉林农业大学,吉林长春130118;2.教育部动物生产及产品质量安全重点实验室,吉林省药用动物二级实验室,吉林长春130118)
牛病毒性腹泻病毒E2截短基因重组卡介苗安全性和最佳免疫剂量的研究
杨宇航1,李 晶1,张 云1,郝俊伟1,刘东旭1,时 坤1,李健明1,曾范利1杜 锐1.2*
(1.吉林农业大学,吉林长春130118;2.教育部动物生产及产品质量安全重点实验室,吉林省药用动物二级实验室,吉林长春130118)
将6组BVDV-E2截短基因重组卡介苗用生理盐水稀释,分别进行革兰染色和伊红美蓝平板检测,6组重组卡介苗均无杂菌污染。再对6周龄~8周龄雄性豚鼠进行免疫接种,每只腹腔注射1 m L(5×106cfu/只),免疫接种豚鼠无任何症状,精神、食欲、排便及发育等均不受影响,且无死亡,说明重组病毒对试验豚鼠是安全的。使用BVDV抗体检测试剂盒对60头健康牛的母源抗体含量进行检测,不含母源抗体占85.00%。取重组卡介苗中的一组,用生理盐水稀释,使重组卡介苗达到105、106、107、108、109cfu/m L共5组,每组不含母源抗体的牛3头,免疫接种前对每头牛进行尾颈静脉采血,析出血清,用BVDV抗体检测试剂盒测牛血清中抗体水平。采完血后对牛进行皮下免疫接种,4周后,采取血液,检测牛血清中抗体水平。通过免疫接种后的检测结果可知,重组疫苗对牛最佳免疫剂量为108cfu/m L,为进一步进行重组疫苗回归本动物的免疫效果研究提供了可靠依据。
牛病毒性腹泻病毒;E2截短基因;重组卡介苗;最佳免疫剂量;安全性
牛病毒性腹泻(Bovine viral diarrhea,BVD)是由牛病毒性腹泻病毒(Bovine vival dirrhea virus,BVDV)所致的一种广为传播的传染病,以消化道黏膜发炎、糜烂、坏死和腹泻为主要特征[1]。该病呈世界性分布,牛、鹿、羊、猪和马等[2-3]均有不同程度的感染。在国内外基本应用弱毒疫苗或灭活疫苗防控该病,虽然弱毒疫苗的免疫效果较好,但弱毒株的毒力易返强[4],对一些极易感动物存在一定的危险性,其免疫效果易受多种因素的影响。因此,研究重组疫苗为防控牛病毒性腹泻提供了可能路径。为筛选出既安全又有效的重组疫苗,本试验测定BVDV-E2截短基因重组卡介苗的安全性和最佳免疫剂量。
1 材料与方法
1.1 材料
1.1.1 试验用动物 6周龄~8周龄雄性豚鼠共70只,每只豚鼠体重约18 g~20 g,购于长春实验动物繁育场;24月龄左右的健康牛60头,选取于吉林农业大学畜牧教研基地。
1.1.2 重组卡介苗 BVDV-E2截短基因重组卡介苗由经济动物疫病实验室构建保存。
1.1.3 试剂与仪器 HRP标记的鼠抗牛酶标二抗为BD公司产品;酶标仪、酶标板为Tecan公司产品;BVDV抗体检测试剂盒为北京祥龙环宇生物有限公司产品;碘液、乙醇、蕃红等革兰染色和伊红美蓝培养基等。
1.2 方法
1.2.1 重组卡介苗安全性的测定 取BVDV-E2截短基因重组卡介苗进行革兰染色和伊红美蓝平板检测。取6组BVDV-E2截短基因重组卡介苗,用生理盐水稀释。对6周龄~8周龄雄性豚鼠进行腹腔注射,每组10只,每只接种1 m L(5×106cfu/只)[5],作为空白对照,接种后观察豚鼠的精神状态、食欲、排便以及死亡情况。
1.2.1.1 革兰染色法 略。
1.2.1.2 伊红美蓝鉴定法 ①制作伊红美蓝培养基,趁热注入培养皿中,凝成平板,待用。②6组重组卡介苗分别取100μL接种于伊红美蓝培养基上,再接种100μL的大肠埃希菌作对照组,用涂抹棒涂抹均匀。③将涂抹好的培养皿倒置37℃温箱中培养18 h~24 h后观察生长情况。
1.2.2 母源抗体检测 随机采取60头24月龄左右的健康牛3 m L~5 m L血液,析出血清,使用BVDV抗体检测试剂盒检测血清中抗体含量,并与阴、阳性血清的抗体含量进行比较。
1.2.3 最佳免疫剂量的测定 将18头牛随机分成6组,每组3头,分别为A组、B组、C组、D组、E组、生理盐水对照组。取一组BVDV-E2截短基因重组卡介苗进行免疫接种,其中A、B、C、D、E各组分别皮下免疫接种105、106、107、108、109cfu/m L BVDVE2截短基因重组卡介苗,对照组不进行处理。在免疫接种前,对每头牛进行颈静脉采血5 m L~10 m L,置于5 m L离心管中析出血清,按耳牌对号标记,用BVDV抗体检测试剂盒检测牛血清中抗体水平。按照上述剂量进行免疫,免疫4周后,颈静脉采血5 m L~10 m L,置于离心管中析出血清,对号标记,用BVDV抗体检测试剂盒检测牛血清中抗体水平。1.2.4 BVDV抗体检测试剂盒使用方法 所有的试剂盒组分在使用之前都必须恢复到室温(18℃~25℃)。①取出用BVDV抗原包被的微量反应板,样品检测区、阴、阳性对照组均做好标记;②在样品检测区加入100μL被检血清样品,每组3个平行对照;③在阴、阳性对照组的小孔中各加入100μL阴、阳性血清,在37℃温箱孵育1 h;④在不弃去血清样品的情况下,每孔加入50μL稀释好的过氧化物酶标记物,使每个小孔都能轻轻的混匀,在37℃温箱孵育1 h;⑤用稀释好的洗涤液洗涤微量反应板5次,3 min/次~5 min/次,扣干。⑥加入底物溶液100μL/孔,室温避光作用10 min~15 min,加入终止液50μL/孔。⑦酶标仪调零,在加入终止液5 min内于450 nm单波长测定被检样品和对照组的吸光度(OD)值。⑧以OD 450 nm<0.4为阳性血清,OD 450 nm>0.8为阴性血清,统计结果。
2 结果
2.1 重组卡介苗的安全性试验
2.1.1 革兰染色检测结果 6组BVDV-E2截短基因重组卡介苗通过革兰染色后,染色反应既无紫色,又无红色,说明此6组重组卡介苗无杂菌污染。
2.1.2 伊红美蓝平板检测结果 6组BVDV-E2截短基因重组卡介苗进行美蓝平板涂板,经37℃温箱培育24 h,6组重组卡介苗均无细菌生长,而涂有大肠埃希菌的对照组长出菌落,说明此6组重组卡介苗中没有感染大肠埃希菌。
2.1.3 重组卡介苗豚鼠注射试验结果 6组重组卡介苗接种试验豚鼠后,刚开始有些躁动不安,1 d后便好转,接种疫苗7 d~14 d后,所有试验豚鼠均无明显的全身症状,精神、食欲、排便正常,持续生长。
2.2 牛免疫接种前母源抗体的检测
由表1可以看出,应用BVDV抗体检测试剂盒对60头牛的母源抗体进行检测,以OD 450 nm<0.4为阳性血清,OD 450 nm>0.8为阴性血清,对照组阳性血清 OD 450 nm 为0.250 9,阴性血清 OD 450 nm为1.589 4,空白组 OD 450 nm 为0.051 2。被检血清阳性血清2份,阴性血清51份,阴性占有率为85.00%,即被检测的60头牛不含母源抗体的比例为85.00%。
2.3 重组卡介苗最佳免疫剂量的确定
由表2可以看出,通过ELISA检测牛体内抗体水平变化,从A组~D组抗体水平一直随免疫剂量增加而升高,在D组的差值0.170 4最大,在D组之后开始下降,而生理盐水组基本没变化,因此,抗体水平在D组时免疫效果最好,达到了最大值,即BVDV-E2截短基因重组卡介苗免疫牛的最佳免疫剂量为108cfu/m L。
3 讨论
革兰染色法是细菌学中广泛使用的一种鉴别染色法,其能够缩小细菌的鉴定范围,有利于进一步分离鉴定,并能对疾病做出诊断。该方法通过对细菌细胞壁结构和成分染色,具有较好的敏感性。在革兰染色过程中,脱色是否完全决定实验的成败,脱色不完全易造成假阳性[6],而脱色过度又容易造成假阴性,因此脱色时间必须掌握得当。6段重组卡介苗染色后,既无紫色又无红色呈现在视野中,说明这6组重组卡介苗中无杂菌污染。伊红美蓝培养基是酸碱染料结合使用,对嗜酸性菌有一定的敏感性,而对一些嗜碱性菌有抑制作用,其常用来鉴别大肠埃希菌是否存在。在配制伊红美蓝培养基时,20 g/L伊红水溶液和5 g/L美蓝水溶液要求的量特别少,配置起来有点费事。通过伊红美蓝平板平培养,未形成无黑色菌落,说明这6组重组卡介苗中没有被大肠埃希菌污染。豚鼠对结核分支杆菌、大肠埃希菌等多种病原体敏感,经常用于各种病原菌的分离、鉴别、诊断,同时也是各种抗病药物筛选以及病理研究的最佳动物[7]。用6段重组卡介苗免疫豚鼠,豚鼠均没有明显的全身反应,精神、食欲、排便正常,生长发育正常,且无豚鼠死亡。综合评价,6段截短基因重组卡介苗是安全的。
本试验应用BVDV抗体检测试剂盒对牛的母源抗体进行检测,检出阴性血清51份,阴性率为85.00%。为后续6组BVDV-E 2截短基因重组卡介苗免疫牛进行免疫效果评价奠定基础。牛接种重组卡介苗后抗体水平变化表明,A组、B组、C组、D组、E组等试验组的抗体水平明显高于生理盐水组抗体水平,说明BVDV-E2截短基因重组卡介苗对控制牛病毒性腹泻病是有一定的效果。当每头牛最佳免疫剂量达到108cfu/m L时,抗体含量就达到了峰值,随着接种剂量的增加,抗体水平有下降趋势,因此,从牛免疫后抗体水平变化来看,每头牛免疫接种108cfu/m L是最佳免疫剂量。

表1 BVDV母源抗体检测Table 1 BVDV maternal antibody detection
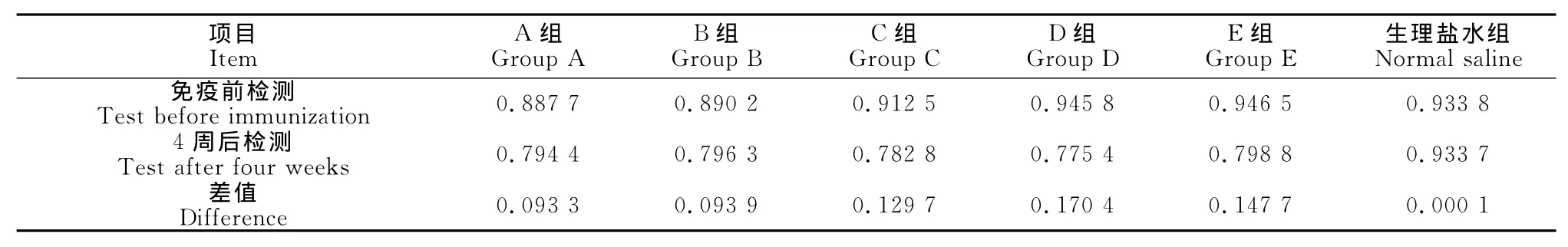
表2 牛免疫后抗体水平变化Table 2 Antibody level changes in the cattle after immunication
当前,卡介苗免疫预防作为一种常用于控制牛病毒性腹泻的方法,由于其长期使用及剂量的不断增加,动物体内已产生药物残留[8]及高度的耐受性与抗药性[9]。随着时间的推进,卡介苗单位用量越来越大,但免疫效力却越来越低。近年来,研究开发重组卡介苗与基因缺失疫苗[10]已成为时下的热点,许多学者都在致力于重组卡介苗的构建和免疫原性分析方面的研究,使其具有多价疫苗的效果,并解决重组卡介苗的稳定性等问题[11-12]。本试验是在构建的重组卡介苗基础上,鉴定其安全性,并通过免疫接种牛来确定重组卡介苗的最佳免疫剂量,为检测重组卡介苗的免疫效果及相关重组卡介苗的研制提供依据。重组卡介苗免疫接种牛病毒性腹泻效力的提高,为预防牛病毒性腹泻提供了可靠途径,同时为疫苗的推广使用和专利申请奠定了基础,以保障我国养牛业的健康发展。
[1] 陈溥言.兽医传染病学[M].5版.北京:中国农业出版社,2008:275-278.
[2] Jonese L R,Weber E L.Application of single strand conformation polymorphism to the study of bovine viral diarrhea virus isolates[J].J Vet Diagn Invest,2001,13:50-56.
[3] 王先炜,习向峰,季 伟,等.猪圆环病毒2型灭活疫苗最小免疫保护剂量研究[J].中国预防兽医学报,2011,33(9):723-726.
[4] Colditz G A,Brewer T F,Berkey C S,et al.Efficacy of BCG vaccine in the prevention of tuberculosis.Meta analysis of the published literature[J].JAMA,1994,271(9):698-702.
[5] 张 梦.BVDV-E2基因在BCG中的优化表达及其表达产物免疫效果的研究[D].吉林长春:吉林农业大学,2012:37.
[6] 崔潇婷,洪伟鸣,王妲妲.革兰氏染色技术的实验研究[J].考试周刊,2012,73:159.
[7] 李 萌,魏肖云,戴启刚,等.变应性鼻炎动物模型的研究现状[J].现代中西医结合杂志,2013,22(12):1360-1363.
[8] Francisca C V,Annemarie B,Arjan S J,et al.Transmission of a liveEimeriaacervulinavaccine strain and response to infection in vaccinated and contact-vaccinated broilers[J].Vaccine,2012,30(2):322-328.
[9] 李 瑾,黄炳成.基因重组卡介苗研究进展[J].中国热带医学,2009,9(1):160-162.
[10] Karuppannan A K,Jong M H,Lee S H,et al.Attenuation of porcine circovirus 2 in SPF piglets by abrogation of ORF3 function[J].Virology,2009,383(2):338-347.
[11] 陈向东,吴梧桐.重组卡介苗的研究与应用[J].药学进展,2003,27(5):259-263.
[12] 陶 冬,周 然,王 丹,等.柔嫩艾美耳球虫F2株弱毒疫苗最佳免疫剂量和安全性的研究[J].动物保健品,2013(3):120-122.
Studies on Safety and Optimal Immune Dose of BVDV-E2 Truncated Gene RBCG
YANG Yu-hang1,LI Jing1,ZHANG Yun1,HAO Jun-wei1,LIU Dong-xu1,SHI Kun1,LI Jian-ming1,ZENG Fan-li1,DU Rui1,2
(1.JilinAgriculturalUniversity,Changchun,Jilin,130118,China;2.KeyLaboratoryofAnimalProduction,Product QualityandSecurity,MinistryofEducationofthePeople'sRepublicofChina,Level2Laboratoryof MedicalAnimalofJilinProvince,Changchun,Jilin,130118,China)
In this experiment,6 groups of BVDV-E2 truncated gene recombinant BCG which had been diluted with normal saline were tested by Gram stain and eosin methylene blue plate detection respectively,the result showed no bacterial infection.Then the 6-8-week-old male Guinea pigs were immunized intraperitoneally with 1m L(5×106cfu)recombinant BCG each one.All of the Guinea pigs had no any systemic symptoms and their spirit,appetite,feces and growth etc.were not affected,and no deaths,which proved that the recombinant BCGs were safe to the Guinea pigs.The levels of maternal antibodies of 60 healthy cows were detected with the BVDV antibody detection kit and the proportion that had no maternal antibodies was 85.00%.Then one group of recombinant BCG was diluted with saline to make the amount of recombinant BCG to 105,106,107,108,109cfu/m L respectively.Subsequently,three 24-month-year-old cows which had no maternal antibodies were immunized with each dose.Before immunization,every cow's blood were collected from tail vein,for testing the level of antibody in the serum with the BVDV antibody detection kit.The subcutaneous immunization was made after the blood was collected.Four weeks later,the blood was collected again for seral antibody detection.The result showed that the optimal immune dose of recombinant vaccine was 108cfu/m L,which provided a reliable basis to study the immune effect of the recombinant vaccine when it was applied to the original animals.
Bovine viral diarrhea virus;E2 truncated gene;recombinant BCG;optimal immune dose;safety
S852.659.6
A
1007-5038(2014)07-0034-04
2013-12-09
国家自然科学基金项目(31372436);国家科技支撑计划项目(2011BAI03B02-1);吉林省科技创新人才培育
计划项目(20130521023JH);吉林省科技成果转化促进计划项目(20125067)
杨宇航(1987-),男,陕西富平人,硕士研究生,主要从事经济动物疾病学研究。*通讯作者

