罗非鱼hepcidin 1-5成熟肽在毕赤酵母中的表达和活性研究*
梁 盈,梁 瑞,张永安,祁克宗,涂 健,彭开松 ,*
(1.安徽农业大学动物科技学院,安徽合肥230036;2.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,湖北武汉430072)
罗非鱼hepcidin 1-5成熟肽在毕赤酵母中的表达和活性研究*
梁 盈1,梁 瑞1,张永安2,祁克宗1,涂 健1,彭开松1,2*
(1.安徽农业大学动物科技学院,安徽合肥230036;2.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室,湖北武汉430072)
为获得重组酵母分泌表达的莫桑比克罗非鱼hepcidin并进行其功能研究,将罗非鱼hepcidin 1-5(TH1-5)成熟肽c DNA插入表达载体pPIC9K,获得重组分泌表达质粒pPIC9K-TH1-5,电转化毕赤酵母GS115,阳性克隆经甲醇诱导获得表达上清;表达上清冻干品经Dot-ELISA检测,并分析了表达产物对指示菌和鸡外周血淋巴细胞的影响。结果表明,TH1-5成熟肽可通过表达质粒pPIC9K在毕赤酵母中实现分泌型表达,Dot-ELISA检测表达上清中含有TH1-5。重组表达的TH1-5对大肠埃希菌(CMCC44102)、金黄色葡萄球菌(ATCC25923)、铜绿假单胞菌(ATCC27853)、粪肠球菌(ATCC29212)具有明显的抑菌活性;含重组表达 TH1-5的上清冻干品(6.25 mg/m L)可协同Con A(0.125μg/m L)或LPS(0.125μg/m L)促进鸡外周血淋巴细胞的增殖。
罗非鱼hepcidin;酵母表达;斑点-酶联免疫吸附试验;抑菌活性;淋巴细胞增殖
罗非鱼是联合国粮食及农业组织(Food and Agriculture Organization,FAO)推广的世界性养殖品种,其对世界水产养殖的重要性仅次于鲤科鱼类和鲑鳟鱼类。中国是世界上罗非鱼产量最大的国家,罗非鱼也是我国出口量最大的淡水养殖品种。但近年来,水产动物的细菌性疾病引起的损失惨重,虽然抗菌药物是目前的主要防治手段,但容易产生耐药性和导致组织中抗菌药物残留,给食品安全埋下隐患,并影响水产品出口[1]。因此,很有必要寻找新的抗生素替代品。抗菌肽是一类广泛存在于生物体的内源性小肽,其独特的作用机制使得微生物不容易产生抗药性,是备受关注的抗生素替代品。抗微生物肽除了具有抗菌、抗囊膜病毒、抗肿瘤、抗真菌等天然免疫活性外,还具有趋化、免疫调节等功能[2]。自2000年hepcidin被发现以来就成为研究最为活跃的抗微生物肽类群,hepcidin主要在肝脏表达,但在其他组织和体液中也有广泛的分布。hepcidin含有8个半胱氨酸,通过二硫键形成稳定的β折叠,这种结构可以通过成孔作用增加细胞膜的通透性,阻断呼吸链,杀伤病原微生物[3]。莫桑比克罗非鱼有3种hepcidin,人工合成的罗非鱼hepcidin具有抗菌、抗病毒和抗肿瘤活性[4-6];而转罗非鱼hepcidin基因的虾和鱼对水产动物病原菌抵抗能力增强[7-8]。至于基因工程表达的罗非鱼hepcidin及其功能,还未见报道。本文拟采用酵母分泌型表达系统表达罗非鱼hepcidin 1-5,建立检测hepcidin的Dot-ELISA方法,并检测其对常见病原菌的抗菌活性及其对鸡外周血淋巴细胞增殖的效应,期望能为新型绿色抗生素替代品的研发提供借鉴。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 酵母表达质粒p PIC9K和毕赤酵母GS115,为Invitroge公司产品;大肠埃希菌DH5α、大肠埃希菌(CMCC44102)、金黄色葡萄球菌(ATCC25923)、铜绿假单胞菌(ATCC27853)和粪肠球菌(ATCC29212),均由本实验室保存。
1.1.2 主要试剂和培养基 限制性核酸内切酶EcoRⅠ、NotⅠ和BglⅡ为Frement公司产品;T4 DNA Ligase和培养基为BBI公司产品;Premix ExTaqTMVersion 2.0为天根生化科技(北京)生物有限公司产品;小牛肠碱性磷酸酶(CIAP)和DL 2 000等为Ta KaRa公司产品;辣根过氧化物酶标记的山羊抗兔IgG和DAB显色试剂盒等为北京中杉金桥生物技术有限公司产品;LPS和Con A为Sigma公司产品;其他试剂均为分析纯;罗非鱼hepcidin 1-5(GIKCRFCCGCCTPGICGVCCRF,纯度95%)和KLH偶联的hepcidin 1-5为上海强耀生物科技有限公司产品;兔抗罗非鱼hepcidin 1-5抗体由本实验室制备;淋巴细胞分离液(聚蔗糖-泛影葡胺,ρ=1.077 g/m L±0.001 g/m L)为Solarbio公司产品;胎牛血清为杭州四季青生物工程材料有限公司产品;YPD、MD、MM、BMGY、BMMY 等均按Invitrogen毕赤酵母表达操作手册配方配制。
1.2 方法
1.2.1 TH1-5成熟肽基因合成 参考报道的TH1-5成熟肽基因序列[9],按毕赤酵母GS115偏爱密码子进行优化[10],并在两端加上EcoRⅠ和NotⅠ酶切位点,由生工生物工程(上海)股份有限公司合成,序列如下:GAATTCGGTATCAAGTGTAGATTCTGCTGTGGTTGCTGCACCCCAGGTATCTGTGGAGTTTGCTGCAGATTCTAA GCGGCCGC(下划线部分分别为EcoRⅠ、NotⅠ酶切位点),并将其克隆到 PUC57-DNA-simple载体上,构建克隆载体PUC57-DNA-simple-TH1-5。
1.2.2 pPIC9K-TH1-5成熟肽重组质粒的构建分别用EcoRⅠ和NotⅠ双酶切p PIC9K和PUC57-DNA-simple-TH1-5,回 收 目 标 片 段,并 在T4 DNA Ligase作用下16℃连接12 h,连接产物化学转化感受态E.coliDH5α,并涂布于含 Amp(100μg/m L)的LB平板上,筛选阳性单菌落,抽提质粒。以 5′AOX1(5′-GACTGGTTCCAATTGACAAGC-3′)、3′AOX1(5′-GCAAATGGCATTCTGACATCC-3′)为引物,进行PCR鉴定。PCR反应条件为:94℃4 min;94℃30 s,50℃30 s,72℃30 s,共25个循环;68℃10 min。将筛选得的阳性重组质粒送上海生工生物工程技术服务有限公司测序鉴定。
1.2.3 p PIC9K-TH1-5电转化毕赤酵母 GS115将重组表达质粒p PIC9K-TH1-5用SacⅠ酶切线性化后,回收目的片段。电击法转化感受态毕赤酵母GS115。1 500 r/min离心转化液3 min,弃大部分上清,留100μL重悬沉淀后涂于不含组氨酸的MD平板,30℃培养2 d。从MD平板上挑取阳性转化子接种YPD培养基中过夜培养,无菌条件下取1 m L菌液,3 000 r/min离心3 min,收集沉淀重悬于500μL的PBS(p H 7.4);3 000 r/min离心3 min,收集沉淀重悬于100μL的 TE,沸水煮10 min,在-80℃冷冻30 min后再次煮沸10 min,3 000 r/min离心5 min。取离心后上清3μL为模板,以5′AOX1、3′AOX1为引物用PCR法筛选和鉴定阳性重组酵母转化子,并测序验证。同时将BglⅡ线性化的pPIC9K空白质粒转化酵母,挑选出pPIC9K转化GS115菌株作为空白对照。
1.2.4 重组酵母转化子的诱导表达 将p PIC9KTH1-5和空载体p PIC9K转化成功的阳性转化子接种到100 m L的BMGY中,26℃~28℃,250 r/min摇床培养至OD 600 nm=2.0~6.0,4℃静置2 h~4 h后弃上清收集沉淀,重悬于50 m L的BMMY,28℃摇床培养96 h,每隔24 h按终浓度5 m L/L添加甲醇。收集表达上清冷冻干燥后,置-80℃冻存备用。
1.2.5 Dot ELISA方法的建立
1.2.5.1 兔抗TH1-5血清的制备 取人工合成的TH1-5-KLH蛋白与等体积的弗氏完全佐剂乳化均匀后免疫接种健康雄性家兔(体重2 kg),首免后隔2周用TH1-5-KLH蛋白与等体积弗氏不完全佐剂乳化均匀后加强免疫1次,再隔3周加强免疫1次,3免后14 d,心脏采血获得 TH1-5血清[11]。
1.2.5.2 Dot-ELISA 检测重组 TH1-5 试验共设计8组,其中第2组为阳性对照组,3组~8组为阴性对照组。待检样品包括pPIC9K-TH1-5表达上清冻干粉(100 mg/m L)、空载体表达上清冻干粉(100 mg/m L)和 TH1-5合成肽(100μg/m L),取待检样品各1.5μL,点在各对应组的硝酸纤维素膜光面压印圈的中央,其中完全空白对照组(第8组)不做任何处理,显示硝酸纤维素膜光面压印圈本来底色,置4℃冰箱过夜。将膜置于20 g/L BSA(p H 7.4,0.01 mol/L的PBS配置)中37℃摇床封闭30 min~60 min。自然干燥后,将膜片(第1、2、3、6组)浸入到1∶50(含20 g/L BSA的PBST溶液稀释)的一抗(兔抗TH1-5血清)中37℃孵育2 h;第4组(阴性血清对照)浸入到不含TH1-5抗体的未免血清中;第5(空白一抗)和7组(空白一二抗)用PBS代替一抗。自然干燥后,按同样方法封闭膜30 min~60 min。然后将第1、2、3、4、5组的膜片置于1∶200稀释的酶标二抗(辣根过氧化物酶标记羊抗兔IgG)中,37℃孵育1 h;第6和7组膜片用PBS代替二抗。将膜片放入洗涤液(含20 g/L BSA的PBST)中振荡洗涤4次,每次3 min~5 min。晾干后,在避光条件下,每个压印圈内点1.5μL的DAB显色液,避光显色10 min,去离子水冲洗3次终止反应,自然干燥后判定结果。阳性结果为棕黄色颗粒。
1.2.6 表达上清抑菌活性检测 以大肠埃希菌(CMCC44102)、金黄色葡萄球菌(ATCC25923)、铜绿假单胞菌(ATCC27853)、粪肠球菌(ATCC29212)为指示菌,分别取过夜培养的指示菌用灭菌蒸馏水稀释1 000倍后,取100μL均匀涂布于含LB固体培养基20 m L直径为9 cm,厚度为3 mm的平板。将冷冻干燥的表达产物用灭菌蒸馏水配置成浓度为1 g/m L的待检样品,0.22μm滤膜除菌,分别点接pPIC9K-TH1-5/GS115表达上清浓缩液、pPIC9K/GS115表达上清浓缩液(阴性对照)和卡那霉素(100μg/m L)到直径7 mm 的琼脂孔,30μL/孔,37℃培养过夜,观察抑菌圈。
1.2.7 重组表达TH1-5对淋巴细胞增值的影响
按说明书推荐程序分离鸡外周血淋巴细胞,用完全RPM Ⅰ1640培养液(含100 m L/L胎牛血清和10 m L/L三抗)稀释淋巴细胞浓度到约为106cell/m L,按试验目的将细胞加入96孔板中,置于细胞培养箱(40℃、体积分数为5%CO2、饱和湿度)平衡2 h后加入对应测试物,其中LPS与TH1-5共刺激组、Con A与TH1-5共刺激组同时加入2种刺激物。将96孔板置于细胞培养箱培养24 h后,所有孔加入MTT溶液10μL,继续培养4 h后,每孔加入100 g/L SDS-0.01 mol/L HCl溶液100μL,置培养箱反应过夜(溶解时间不超过18 h)后测定OD 570 nm值。所用试验设6个重复,结果表示为平均值±标准误,用 MINITAB release 10.1 package(Minitab Inc.USA)软件计算。单因素差异性分析用ANOVA Procedure from SAS Software Release 8.1(SAS Institute Inc.,Cary,NC,USA)软件分析。
2 结果
2.1 TH1-5成熟肽基因在毕赤酵母中的表达
2.1.1 p PIC9K-TH1-5重组质粒的鉴定 PCR扩增产物经10 g/L琼脂糖凝胶电泳显示,连接成功的重组表达质粒比空载体(p PIC9K)大(图1)。测序结果显示,构建的重组酵母表达质粒的碱基序列与预期完全相同,表明重组表达质粒p PIC9K-TH1-5构建成功。
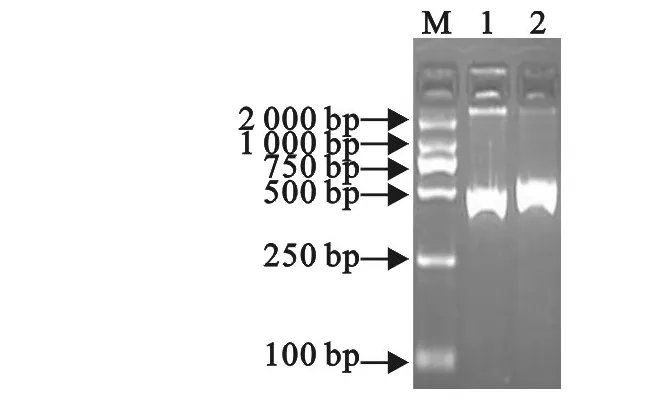
图1 重组质粒的PCR鉴定Fig.1 Identification of recombinant plasmid pPIC9K-TH1-5 by PCR
2.1.2 阳性酵母菌株的鉴定 挑取电转化成功的酵母菌株,提取基因组,以5′AOX1、3′AOX1为引物进行PCR扩增并测序,结果显示阳性重组子基因组(pPIC9K-TH1-5/GS115)为模板可扩增出2 200 bp和556 bp的条带,而以空质粒转化酵母菌基因组(pPIC9K/GS115)为模板可扩增出 2 200 bp 和493 bp的条带(图2),PCR结果与预期大小一致,测序结果证明重组质粒已经成功同源重组整合到GS115。从泳道1的PCR产物可知转化子为mut+表型。

图2 重组酵母的PCR鉴定Fig.2 Identification of recombinant Pichia pastoris GS115 by PCR
2.2 重组酵母菌株表达上清的检测
用建立的 Dot-ELISA法检测阳性重组子(p PIC9K-TH1-5/GS115)的表达上清(图 3 中第1组)和人工合成TH1-5(阳性对照,图3中第2组)有清晰的棕黄色斑点,而含pPIC9K空质粒的GS115表达上清(图3中第3组)和其他阴性对照(图3中第4组~第7组)均无显色,这表明建立的Dot-ELISA法可成功检测重组表达的TH1-5。

图3 重组酵母诱导表达产物的Dot-ELISA分析Fig.3 Dot-ELISA analysis of inducible expressed products of recombinant Pichiapastoris
2.3 重组表达产物TH1-5抗菌活性的检测
p PIC9K-TH1-5/GS115诱导表达的上清为待检样品,以空质粒酵母菌株p PIC9K/GS115诱导表达的上清作为阴性对照,以卡那霉素为阳性对照。经毕赤酵母分泌表达的TH1-5对大肠埃希菌(CMCC44102)、金黄色葡萄球菌(ATCC25923)、铜绿假单胞菌(ATCC27853)和粪肠球菌(ATCC29212)均有不同程度的抑菌作用(图4中1号孔)。而含空载体的pPIC9K/GS115的表达上清对4种指示菌均无抑菌作用(图4中2号孔)。

图4 表达上清抑菌活性的检测Fig.4 Bacteriostatic activity detection of expressed supernatant
2.4 重组表达的TH1-5对淋巴细胞增殖的影响
由表1可知,6.25 mg/m L的重组表达 TH1-5粗制品虽然对鸡外周血淋巴细胞增殖无显著影响,但重组表达 TH1-5粗制品(6.25 mg/m L)与 Con A(0.125μg/m L)共刺激鸡外周血淋巴细胞时,具有协同促进增殖效应。由表2可知,重组表达TH1-5粗制品(6.25 mg/m L)虽然对鸡外周血淋巴细胞增殖无显著影响,但其与LPS(0.125μg/m L)共刺激鸡外周血淋巴细胞时,具有协同促进增殖效应。
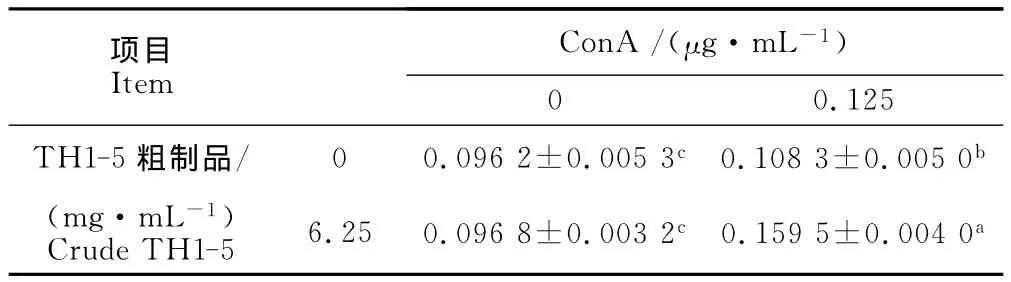
表1 重组表达的TH1-5粗制品与Con A共刺激对鸡外周血淋巴细胞增殖的影响Table 1 Effect of recombinant expressed crude TH1-5 and Con A on proliferation of peripheral blood lymphocytes
3 讨论
内源性抗菌肽是比较理想的抗生素替代品,有望用于动物生产,特别是水产养殖。但要获得大量用于生产的抗菌肽产品,通过基因工程重组表达应该是比较可行的途径。已有大量研究显示,基因工程重组表达的抗菌肽与人工合成的抗菌肽或生化纯化的天然抗菌肽具有相同或相似的抗菌活性[12]。由于抗菌肽对原核宿主菌(如大肠埃希菌和乳酸菌)通常具有很强的杀伤作用,一般采用原核融合表达[12]或在酵母真核表达系统中表达[13];而原核融合表达产物由于含有标签使得表达产物分子质量变大,虽然有些研究显示携带融合标签的抗微生物肽的抗菌活性并没有受到影响[12],但原核融合表达后下游加工过程复杂。因此,毕赤酵母分泌表达系统是比较理想的选择,其表达上清中含有重组抗菌肽可以直接使用或添加载体制成饲料添加剂使用。毕赤酵母表达系统是比较成熟的表达系统,已经用于表达多种类型的抗菌肽,包括富含半胱氨酸的抗菌肽(如hepcidin和defensin)和不含半胱氨酸的抗菌肽(如cathelicidin)等[14-18]。这些抗菌肽来源于包括哺乳类、鸟类、鱼类、甲壳类等。目前,包括大菱鲆、大黄鱼、石斑鱼在内的多种鱼类的hepcidin已经成功地在毕赤酵母获得表达[14-18],并对待检菌具有不同程度的抗菌活性。但还未见罗非鱼hepcidin在毕赤酵母成功表达的报道。本研究通过酵母密码子优化后表达的TH1-5对大肠埃希菌(CMCC44102)、金黄色葡萄球菌(ATCC25923)、铜绿假单胞菌(ATCC27853)和粪肠球菌(ATCC29212)均有不同程度的抑菌作用,这与报道的类似研究结果一致。
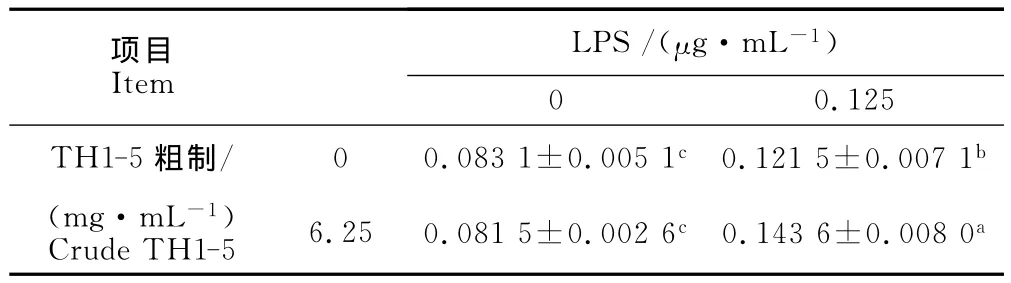
表2 重组表达的TH1-5粗制品与LPS共刺激对鸡外周血淋巴细胞增殖的影响Table 2 Effect of recombinant expressed crude TH1-5 and LPS on proliferation of peripheral blood lymphocytes
基因工程表达抗菌肽的检测,主要是通过Tricine-SDS-PAGE分析表达产物[19],通过分子质量是否与预期相同来初步判断抗菌肽是否表达,但由于抗菌肽分子质量小(分子质量小于10 ku)或由于表达产物中浓度太低,不容易被检测到;此外,由于表达标签的存在或表达的肽分泌时切割不完全或表达系统导致的表达产物N端氨基酸增加等,也会导致表达产物的分子质量可能与预期并不完全一致。以抗体为基础的检测重组表达抗菌肽方法主要为蛋白质印迹[20],但该方法需要专业化设备和较长试验时间。本研究建立的Dot-ELISA法能用于检测表达的TH1-5,具有所需设备简单和快速等特点[21],可为基因工程表达抗菌肽的检测提供方法借鉴。
重组表达的抗菌肽的功能评价,大多仅限于抗菌活性的评价,关于抗菌肽对免疫调节活性的评价少有报道。人淋巴细胞的正常增殖可能需要Hepcidin参与[22]。虽然本研究显示重组表达TH1-5粗制品(6.25 mg/m L)对鸡外周血淋巴细胞增殖无作用,但 能 协 同 LPS (0.125μg/m L)或 Con A(0.125μg/m L)刺激外周血中的B细胞或T细胞增殖,表现出免疫调节作用,这与同样具有多半胱氨酸的β-defesin 类 似[23-24]。此外,本 实验室研 究 显 示TH1-5协同LPS或Con A刺激淋巴细胞增殖作用呈现剂量依赖性(未发表数据)。同时,本研究结果还表明鱼类hepcidin对鸡淋巴细胞增殖有活性,提示hepcidin对淋巴细胞增殖活性的影响可跨种属发挥作用。因此,hepcidin不仅具有天然免疫活性,而且还可能参与对获得性免疫的调节作用。
[1] Rico A,Tran Minh P,Satapornvanit K,et al.Use of veterinary medicines,feed additives and probiotics in four major internationally traded aquaculture species farmed in Asia[J].Aquaculture,2013,412-413:231-243.
[2] Rajanbabu V,Chen J Y.Applications of antimicrobial peptides from fish and perspectives for the future[J].Peptides,2011,32(2):415-420.
[3] Shi J,Camus A C.Hepcidins in amphibians and fishes:Antimicrobial peptides or iron-regulatory hormones[J].Dev Comp Immunol,2006,30(9):746-755.
[4] Chang W T,Pan C Y,Rajanbabu V,et al.Tilapia(Oreochromismossambicus)antimicrobial peptide,hepcidin 1-5,shows antitumor activity in cancer cells[J].Peptides,2011,32(2):342-352.
[5] Huang P H,Chen J Y,Kuo C M.Three different hepcidins from tilapia,Oreochromismossambicus:Analysis of their expressions and biological functions[J].Mol Immunol,2007,44(8):1922-1934.
[6] Rajanbabu V,Chen J Y.Antiviral function of tilapia hepcidin 1-5 and its modulation of immune-related gene expressions against infectious pancreatic necrosis virus(IPNV)in Chinook salmon embryo(CHSE)-214 cells[J].Fish Shellfish Immunol,2011,30(1):39-44.
[7] Hsieh J C,Pan C Y,Chen J Y.Tilapia hepcidin(TH)2-3 as a transgene in transgenic fish enhances resistance toVibriovulnificusinfection and causes variations in immune-related genes after infection by different bacterial species[J].Fish Shellfish Immunol,2010,29(3):430-439.
[8] Pan C Y,Peng K C,Lin C H,et al.Transgenic expression of tilapia hepcidin 1-5 and shrimp chelonianin in zebrafish and their resistance to bacterial pathogens[J].Fish Shellfish Immunol,2011,31(2):275-285.
[9] 赵 翔,霍克克,李育阳.毕赤酵母的密码子用法分析[J].生物工程学报,2000,16(3):308-311.
[10] 崔鹏飞,邓国华,韦良孟.鸡干扰素调节因子7的原核表达及多克隆抗体的制备[J].动物医学进展,2013,34(4):1-4.
[11] Peng K S,Ruan L S,Tu J,et al.Tissue distribution,expression,and antimicrobial activity ofAnasplatyrhynchosavian β-defensin 6[J].Poultry Sci,2013,92(1),97-104.
[12] 王海霞,缪 刘,祁克宗,等.鸡β防御素2成熟肽基因在毕赤酵母中的表达及其抗菌活性分析[J].中国兽医科学,2012,42(7):719-724.
[13] 白俊杰,刘碧莲,劳海华,等.大口黑鲈抗菌肽hepcidin c DNA 序列和结构分析[J].广东海洋大学学报,2008,28(1):1-5.
[14] 李 伟,陈松林.大菱鲆抗菌肽基因酵母表达载体的构建及表达[J].长江大学学报:自然科学版农学卷,2008,5(4):61-66.
[15] 汪玉华,敖敬群,陈新华.大黄鱼抗菌肽hepcidin在巴斯德毕赤酵母中的表达及其产物的抑菌活性[J].应用海洋学学报,2013,32(3):83-89.
[16] 金俊琰,周 莉,桂建芳.石斑鱼β-防御素的酵母表达及其产物抗菌活性分析[J].水生生物学报,2011,35(5):739-744.
[17] 蔡晶晶,杨 明,蔡 灵,等.黑鲷抗菌肽hepcidin在毕赤酵母中的表达及其抗菌活性[J].厦门大学学报:自然科学版,2009,48(5):738.
[18] Qi K Z,Miao L,Peng K S,et al.Cloning and expression of chicken AvBD8 mature peptide gene inLactococcuslactis[J].J Anim Vet Adv,2012,11(23):4369-4373.
[19] 徐 丹,曹利利,魏 峰,等.细粒棘球绦虫G1型Eg95基因的原核表达及蛋白鉴定[J].动物医学进展,2013,34(4):46-49.
[20] 高小燕,王长法,刘顺德,等.高表达牛气管防御素的真核重组载体的构建及其鉴定[J].西南农业学报,2010,23(6):2066-2069.
[20] Pinto J P,Dias V,Zoller H,et al.Hepcidin messenger RNA expression in human lymphocytes[J].J Immunol,2010,130(2):217-230.
[22] Baroni A,Donnarumma G,Paoletti I,et al.Antimicrobial human beta-defensin-2 stimulates migration,proliferation and tube formation of human umbilical vein endothelial cells[J].Peptides,2009,30(2):267-272.
[23] Yang Y R,Jiang Y B,Yin Q Q,et al.Chicken intestine defensins activated murine peripheral blood mononuclear cells through the TLR4-NF-κB pathway[J].Vet Immunol Immunopathol,2010,133(1):59-65.
Expression of TH1-5 Mature Peptide inPichiapastorisand Analysis of Its Biological Activites
LIANG Ying1,LIANG Rui1,ZHANG Yong-an2,QI Ke-zong1,TU Jian1,PENG Kai-song1,2
(1.CollegeofAnimalScienceandTechnology,AnhuiAgriculturalUniversity,Hefei,Anhui,230036,China;2.StateKeyLaboratory ofFreshwaterEcology&Biotechnology,InstituteofHydrobiology,ChineseAcademyofSciences,Wuhan,Hubei,430072,China)
To obtain the expressing recombinant hepcidin1-5 ofOreochromismossambicus(TH1-5)byPichiapastorisand study their function,the recombinant expression vector pPIC9K-TH1-5 were constructed,and then transformed intoP.pastorisGS115 by electroporation.The recombinant TH1-5 was expressed in the positive clones of recombinant GS115 under the induction of methanol.The expressed supernatant was detected by Dot ELISA,and antibacterial activity and the effect of proliferation of peripheral blood lymphocyte were analysis.The results showed that the recombinant TH1-5 was expressed by vector p PIC9K in the supernatant ofPichiapastorisGS115,and could be detected by Dot ELISA.Recombinant expressed TH1-5 demonstrated obvious antibacterial activities toEscherichiacoli(CMCC44102),Stapylococcusaureus(ATCC25923),Pseudomonasaeruginosa(ATCC27853)andEnterococcusfaecalis(ATCC29212).The lyophilized supernatant of recombinant expressed TH1-5 in concentration of 6.25 mg/m L can synergistically promote the proliferation of chicken peripheral blood lymphocytes with LPS(0.125 μg/m L)or Con A(0.125μg/m L).
Oreochromismossambicushepcidin;expression inPichiapastoris;Dot ELISA;antibacterial activity;lymphocyte proliferation.
R979.5
A
1007-5038(2014)07-0038-06
2013-12-06
国家自然科学基金项目(30800811);国家重点基础研究发展计划项目(2014CB138600);安徽农业大学引进
与稳定人才基金项目(yj2006-13)
梁 盈(1988-),女,河南孟州人,硕士,主要从事基础兽医学研究。* 通讯作者

