发酵菜粕中菜籽小肽分离纯化及其体外抗氧化活性研究
■张 瑞 吴彩红 凡海佳 李吕木 匡厚坤 汪双喜 丁小玲
(1.安徽农业大学动物科技学院,安徽合肥230036;2.安徽太阳禽业有限公司,安徽宁国242300)
菜籽肽是菜籽蛋白经蛋白酶作用,得到的蛋白质水解物,由许多分子链长度不等的低分子小肽混合物组成。菜籽粕是油菜籽榨油后的副产物,是一种廉价而蛋白质含量高的动物饲料。大量研究证实蛋白质在生物体内并不仅仅是分解为氨基酸后才能被吸收,体内还存在独立的小肽直接吸收机制,且小肽的吸收效果更好[1]。小肽还具有某些特殊的生物活性,如增强免疫功能[2]、抗疲劳[3]、抑制血压升高[4]及降低胆固醇[5]等作用,而这些作用均与其抗氧化活性密切相关。研究表明双酶水解菜籽蛋白可得三种组分,各组分均有特定的抗氧化活性[6]。酶解所得到的菜籽肽具有较强的抗氧化活性和羟自由基清除能力,当水解度达25%时,体外实验羟基自由基清除率可高达80%[7],且枯草杆菌中性蛋白酶水解产物的抗氧化活性大于枯草杆菌碱性蛋白酶酶水解产物的抗氧化活性,并且其抗氧化活性随酶水解产物添加量的增加而增强[8]。Yoshie等[9]通过测定菜籽蛋白水解产物对DPPH(1,1-dipheny l-2-picrylhydrazy;1,1-二苯基-2-苦肼基自由基;DPPH)自由基的清除能力来研究其抗氧化活性,结果表明菜籽蛋白经过胃蛋白酶和胰蛋白酶水解后,其抗氧化能力显著增强。有研究表明,利用单菌固态发酵可以生产出不同分子量的菜籽肽,这些小肽具有清除自由基的能力,而且,肽的分子量越小,其清除自由基的能力越强[10],即抗氧化活性越强。本实验室利用枯草芽孢杆菌和乳酸菌混菌固态发酵菜麻粕后经测定也富含小肽,但它们是否也具有抗氧化活性及其抗氧化活性强弱与否不得而知,为此,本研究通过分离纯化发酵菜粕小肽,研究其抗氧化能力,为揭示发酵菜粕的生物功能的物质基础提供科学依据。
1 材料与方法
1.1 材料、试剂与仪器
发酵菜籽粕:由乳酸菌与枯草芽孢杆菌按照1∶1比例混合发酵,菌种由安徽农业大学饲料科技研究所提供,接种比例6%。
试剂L-酪氨酸、蓝色葡聚糖-2000、氧化型谷胱甘肽(还原型谷胱甘肽、氧化型谷胱甘肽用于标准曲线绘制)和还原型谷胱甘肽由北京索莱宝科技有限公司生产;2,2-二苯基-1-苦味肼基(DPPH)由上海源叶生物技术有限公司生产;胶Sephadex G-15购自北京瑞达恒辉科技发展有限公司。
752紫外可见分光光度计和层析柱(2.6 cm×60 cm)分别为上海浦东物理光学仪器厂和上海锦华层析设备厂产品;HD-21-1核酸蛋白检测仪、DHL-A电脑恒流泵和SBS-100自动液相色谱层析仪均为上海青浦泸西仪器厂生产。
1.2 方法
1.2.1 发酵菜籽粕粗提液中的蛋白多肽的测定
采用福林酚法测定。按照料水比1∶6.0的比例(W:V),先用无菌水浸泡发酵菜粕并搅拌5 min,然后过滤,滤液即为发酵菜粕蛋白多肽的粗提液。试管中加入粗提液样品1.0 ml(空白为1.0 ml纯水),加A液(体积比A1∶A2∶A3=100∶1∶1,A1为20 g无水碳酸钠+4 g氢氧化钠溶于1 L水所得,A2为0.2 g五水硫酸铜溶于20 ml水所得,A3为0.4 g酒石酸溶于20 ml水所得)5ml,混匀后室温放置10 min,再加B液(福林酚试剂)0.5 ml立即混匀,室温放置30 min,在750 nm波长下以空白对照调零,测OD值,根据标准曲线,计算待测粗提液样品的蛋白多肽浓度。
1.2.2 发酵菜籽粕中小肽的提取优化
将样品调成不同的料水比,通过Sephadex G-15分离纯化,分析不同料水比的样品经Sephadex G-15层析后的洗脱曲线,得到最佳的提取效果。
1.2.3 发酵菜籽肽的分离纯化
发酵菜籽肽粗提液过0.45 μm滤膜后进行分离纯化,分离纯化所用采用凝胶层析柱为Sephadex G-15。上样量为1 ml,流速是0.5 ml/min,检测波长为280 nm,洗脱双蒸水的pH=7.0。
1.2.4 标准曲线绘制
凝胶层析组分小肽分子质量测定用蓝色葡聚糖-2 000测定外体积V0,用铬酸钾测总体积Vt。分别用L-酪氨酸(Mw=181.19)、还原型谷胱甘肽(Mw=307.32)、氧化型谷胱甘肽(Mw=612.6)上柱,层析柱(2.6 cm×60 cm),上样量为1 ml,洗脱流速是 0.5 ml/min,洗脱液为双蒸水,检测波长是280 nm,测得标准蛋白的洗脱体积Ve。将标准蛋白质分子质量的对数(lgM)作为横坐标,洗脱体积(Ve)作为纵坐标,制作标准曲线。用菜籽肽粗提液代替标准蛋白,按照标准曲线的制作方法操作,得出洗脱体积,重复测定1~2次,取洗脱体积的平均值。从标准曲线的方程算出样品的分子质量。
1.2.5 小肽含量及抗氧化测定
小肽的测定采用福林酚法[11],重复测定2次。DPPH自由基清除作用的测定、·OH清除作用的测定和还原力测定参照彭惠惠等方法[12]。
2 结果与分析
2.1 福林酚法测定多肽结果
2.1.1 标准曲线的制作
根据福林酚试剂使用方法,分别测定浓度(mg/ml)为0.05、0.1、0.2、0.285 7、0.4、0.5的牛血清蛋白的OD值,得到结果分别是0.121、0.160、0.291、0.420、0.478、0.508。制成的标准曲线见图1。
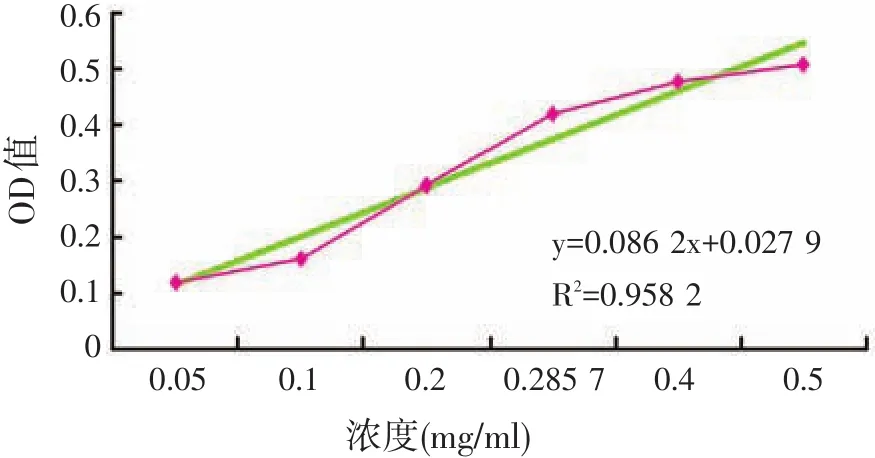
图1 菜籽多肽浓度标准曲线
2.1.2 发酵菜籽粕蛋白多肽粗提液OD值测定
测得料水比为1∶6.0的发酵菜籽粕蛋白多肽粗提液的OD值为0.303,根据标准曲线得到蛋白浓度为3.191 4 mg/ml,因此该发酵菜籽粕粗提液的蛋白多肽含量为19.15%。
2.2 发酵菜籽粕中小肽的提取优化结果
研究不同梯度料水比对菜籽肽提取的影响,发现不同的料水比提取效果不同,在料水比为1∶5.5时取得最佳提取效果。
2.3 发酵菜籽粕中不同小肽的分离提取
2.3.1 标准曲线的制作
用L-酪氨酸(Mw=181.19)、还原型谷胱甘肽(Mw=307.32)、氧化型谷胱甘肽(Mw=612.6)的洗脱体积分别为 96、124、142 ml。所作标准曲线如图2所示,拟合后所得回归方程为:y=-87.117x+339.62,其相关系数为0.997 6,可见lgM与洗脱体积具有线性相关性。
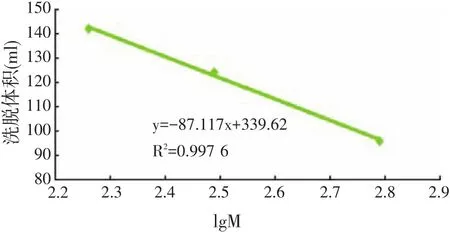
图2 Sephadex G-15测分子量标准曲线
2.3.2 Sephadex G-15检测菜籽肽的相对分子质量分布
经Sephadex G-15凝胶色谱柱分离菜籽肽粗提液后,得到2个峰(见图3),峰1和峰2的洗脱体积分别为87 ml和145 ml。将其代入标准曲线拟合方程,即可求得这两个组分的分子质量分别为794Da和171Da,即两个组分为8肽、2肽。将收集的2个组分的洗脱液进行冷冻存放,待进一步分析。

图3 菜籽肽Sephadex G-15柱层析洗脱图谱
2.4 菜籽肽的抗氧化活性研究
2.4.1 菜籽肽对DPPH自由基清除作用(见图4)
由图4可知,分离得到的各菜籽8肽和菜籽2肽对DPPH自由基均具有清除能力,并且表现出很好的量效关系。2肽的清除率在各浓度下都高于8肽,可以得出对于浓度相同、分子量不同的小肽而言,清除DPPH自由基的能力2肽强于8肽。这与Chen等[13]的研究结果一致,即肽的分子量大小直接影响其抗氧化活性程度,其可能的原因是具有抗氧化活性小肽含有某些特殊的供氢基团能与自由基反应,而这些基团只当小肽分子量适当时,才能得到最大的暴露充分并与自由基作用,进而发挥较强的抗氧化作用。
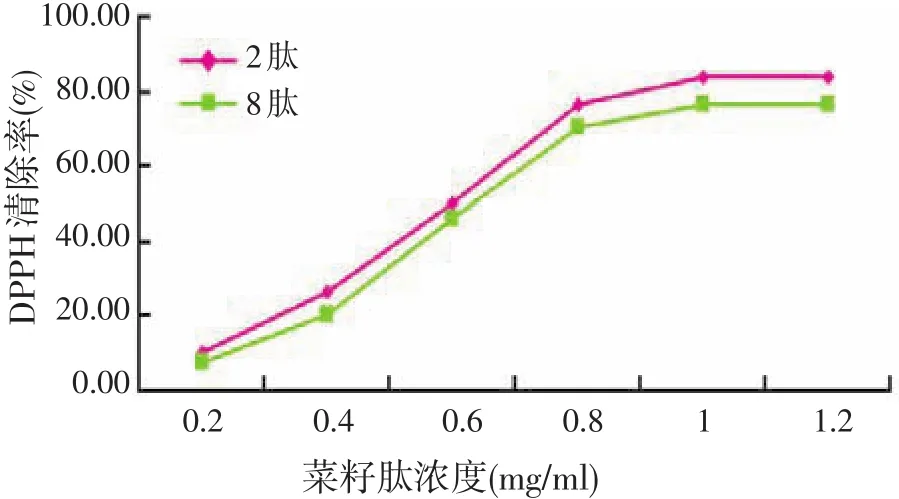
图4 菜籽肽清除DPPH自由基能力的比较
2.4.2 菜籽肽对·OH自由基清除作用(见图5)
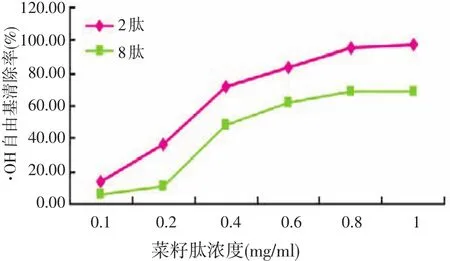
图5 菜籽肽清除·OH自由基能力的比较
由图5可见,在试验浓度(0.1~1 mg/ml)范围内菜籽肽对·OH均有清除作用,并且其抗氧化活性随着菜籽肽浓度的增加而增强。由于菜籽肽中含有供氢体,能够还原具有氧化性的自由基的质子,从而使自由基连锁反应终止,实现抑制或清除自由基的目地。因此,随着浓度的增加导致供氢体增多,使得提供质子的能力增强,致使抗氧化性随之提高。从图5不难看出,羟基自由基的清除能力,菜籽2肽要强于菜籽8肽。
2.4.3 菜籽肽还原力测定(见图6)
测定样品的吸光度的大小可反映出还原力大小,还原力强则吸光度大。由图6可见,在试验浓度(0.5~5 mg/ml)范围内,菜籽肽总还原力与浓度的关系也是线性相关关系。众所周知,抗氧化剂是通过还原作用给出电子来清除自由基的[14],抗氧化性越强,其还原力也越强。本试验中随着肽浓度的增加,肽的抗氧化性也随之增强,且2肽的还原力比8肽强,这一结果与清除DPPH、·OH自由基活性一致。用还原型谷胱甘肽作为对照,3 mg/ml 2肽、5 mg/ml 8肽和0.5 mg/ml谷胱甘肽的OD值相同,说明这些物质的总还原力是相当的。

图6 菜籽肽总还原力的比较
3 结论
菜籽粕经固态发酵产生的2肽与8肽均具有抗氧化性,其抗氧化性与菜籽肽的浓度呈正相关,并且2肽的抗氧化能力比8肽强。
——以渤海S油田为例

