健脾解毒方逆转大肠癌细胞多药耐药的作用机制
李先茜,吴嘉熙,范忠泽,孙燕妮,高 虹
(1上海市徐汇区中心医院,上海200031;2上海中医药大学附属普陀医院)
多药耐药(MDR)是指肿瘤细胞对一种化疗药 物产生耐药性后,对从未使用过的、结构和机制不同的多种化疗药物也产生交叉耐药性[1],是导致化疗效果差的主要原因[2]。MDR与MDR基因MDR-1的过度表达导致肿瘤细胞内MDR-1编码产物P-糖蛋白(P-gp)增多有关[3],因此通过药物影响MDR-1的表达来消除肿瘤细胞对化疗的耐药性,可增加化疗效果[4]。研究发现,对晚期大肠癌患者加用健脾解毒方后,其化疗效果明显增强。2004年1月~2013年12月,我们观察了健脾解毒方对大肠癌MDR基因表达的影响,检测用药前后肿瘤细胞内信号因子Akt磷酸化的改变,探讨健脾解毒方逆转大肠癌MDR基因的作用机制。
1 材料与方法
1.1 材料 体质量约250 g的SD大鼠20只,大肠癌细胞敏感株(HCT-8)及耐药株(HCT-8/V)购于南京凯基生物科技发展有限公司,PI3K抑制剂LY294002 购自Cell Signaling Technology,Inc(Danvers,MA,USA),健脾解毒方(由生黄芪、党参等11味中药组成)购于上海中医药大学附属普陀医院中药房,长春新碱(VCR)购自深圳万乐药业有限公司,抗p-Akt抗体购自SANTA公司。
1.2 方法
1.2.1 药物血清配制[3]与细胞培养 将大鼠随机分为药物组和对照组各10只,分别给予健脾解毒方剂和生理盐水连续灌胃5 d,腹主动脉取血,分离血清。药物组血清应用对照组血清分别配制成0%(空白血清)、5%、10%、15%、20% 的药物血清,-20℃保存备用。HCT-8和HCT-8/V细胞加入含10%小牛血清的RPMI1640高糖培养基,置37℃、饱和湿度、5%CO2培养箱中常规培养。当细胞贴壁并覆盖培养皿底80%后,用0.25%胰酶消化,每3~4 d传代1次。
1.2.2 细胞生长抑制实验 取对数生长期细胞,用含10%小牛血清的RPMI1640培养液配制成单个细胞悬液,调整细胞浓度至1×105/mL,以100 μL/孔接种于96孔培养板,置5%CO2、饱和湿度、37℃孵箱中预培养24 h后,分别加入100 μL含5%、10%、15%、20%健脾解毒方的药物血清,以及空白血清+10 mol/L LY294002组,20%药物血清+10 mol/L LY294002组,对照组为不含药物的等体积空白血清。分别培养24、48、72 h,每组每个时间点设5个复孔。实验组于相应时间点分别加入100 μL长春新碱(终浓度20 g/mL),对照组加入等量生理盐水。继续培养24 h后,用倒置相差显微镜观察,并进行MTT比色实验,于酶标仪570 nm处检测吸光度A值,以空白组平均值调零,计算细胞生长抑制率:抑制率(%)=[(1-实验孔平均A值)/对照孔平均A值]×100%。
1.2.3 实时荧光定量 PCR法检测 MDR-1 mRNA表达 取对数生长期细胞,分为空白血清组、20%药物血清组、空白血清+10 mol/L LY294002组、20%药物血清+10 mol/L LY294002组培养48 h。按Trizol说明书提取总RNA,逆转录合成cDNA。MDR-1 mRNA上游引物:AAAAAGATCAACTCGTACCACTC,下游引物:GCACAAAATACACCAACAA;βactin上游引物:CTACGTCGCCCTGGACTTCGAGC,下游引物GATGGAGCCGCCGATCCACACGG。反应体系:100 ng/μL cDNA 1 μL,PCR 混合物 10 μL,上、下游引物各 1 μL(10 μmol/L),DNA polymerase 0.2 μL,DEPC-H2O 6.8 μL,总体积 20 μL。反应条件:94 ℃ 10 s,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,共40个循环,最后72℃延伸10 min。反应结束后,记录相关Ct值。使用未处理的HCT-8/V细胞的RNA作为标准品绘制标准曲线,求出各组MRD-1 mRNA的相对模板数,以β-actin作为内参。
1.2.4 Western blot方法测定 P-gp 及磷酸化 Akt蛋白(p-Akt)[6]取对数生长期细胞,分为空白血清组、20%药物血清组、空白血清+10 mol/L LY294002组、20%药物血清+10 mol/L LY294002组,培养48 h。PBS冲洗,加入细胞裂解液,离心取上清,蛋白定量后分别取50 μg蛋白加入上样缓冲液,95℃变性10 min。12%聚丙烯酰胺-SDS凝胶电泳后,电转移至硝酸纤维膜上,5%脱脂奶粉封闭,依次加入一抗、二抗,室温孵育2 h。TBST缓冲液洗涤,加入化学发光试剂,压片,显影,定影,照相。使用抗MDR-1兔多克隆抗体检测MDR-1蛋白,抗p-Akt鼠单克隆抗体检测p-Akt。
1.2.5 统计学方法 应用 PEMS3.1医学统计软件,结果以±s表示。多样本比较以单因素方差分析,组间比较采用t检验,相关性分析采用直线相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组细胞生长抑制率比较 见表1。长春新碱对HCT-8/V的生长抑制作用与健脾解毒方的药物血清浓度及作用时间呈正相关。使用LY294002预处理HCT-8/V后,长春新碱的细胞生长抑制率增高了4~6倍;联合使用20%药物血清和LY294002后,长春新碱的生长抑制率增高了5~8倍(P均<0.01)。
2.2 MDR-1 mRNA在大肠癌细胞中的表达 见表2。MDR-1 mRNA在HCT-8/V中的相对表达量较HCT-8明显增高(P<0.01)。使用20%的药物血清预处理 HCT-8/V 细胞24、48、72 h,MDR-1 mRNA 在HCT-8/V中的相对表达量明显降低(P<0.01)。在相同的作用时间里,HCT-8/V中MDR-1 mRNA表达水平与药物血清浓度呈线性反比关系,使用同一药物血清浓度预处理细胞,MDR-1 mRNA表达量和作用时间呈线性反比关系。使用LY294002预处理细胞24、48、72 h,HCT-8/V 中 MDR-1 mRNA 表达较空白血清明显降低(P均<0.01)。
表1 药物血清与LY294002对细胞生长抑制率的影响(n=5,%,±s)
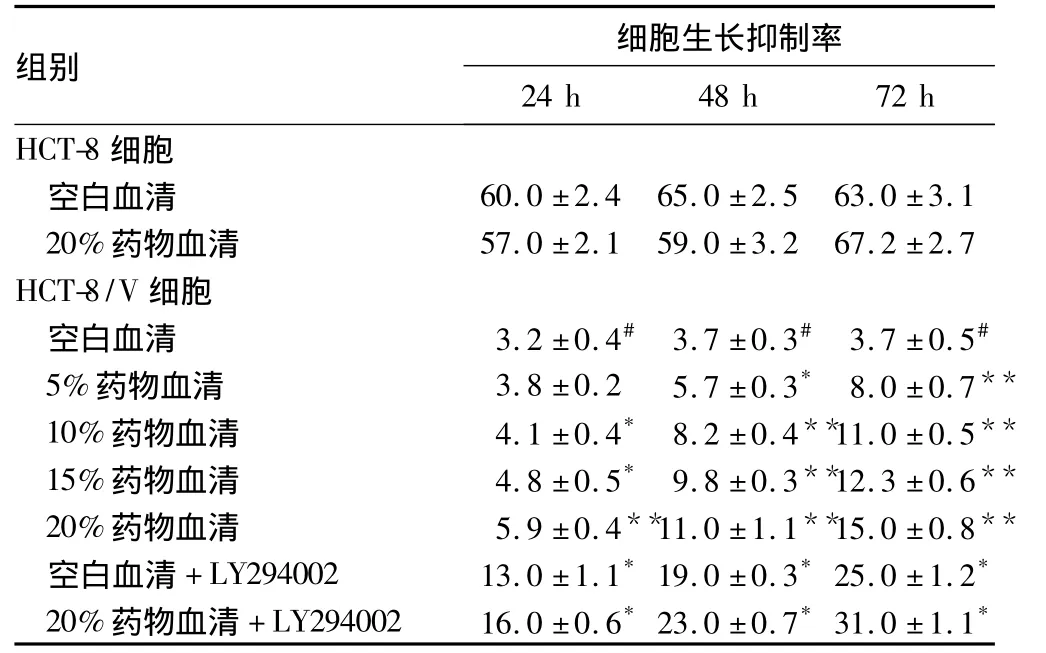
表1 药物血清与LY294002对细胞生长抑制率的影响(n=5,%,±s)
注:与同组空白血清比较,*P <0.05,**P <0.01;与 HCT-8空白血清比较,#P <0.01
组别 细胞生长抑制率24 h 48 h 72 h HCT-8细胞空白血清 60.0 ±2.4 65.0 ±2.5 63.0 ±3.1 20%药物血清 57.0 ±2.1 59.0 ±3.2 67.2 ±2.7 HCT-8/V细胞空白血清 3.2 ±0.4# 3.7 ±0.3# 3.7 ±0.5#5%药物血清 3.8 ±0.2 5.7 ±0.3* 8.0 ±0.7**10%药物血清 4.1 ±0.4* 8.2 ±0.4**11.0 ±0.5**15%药物血清 4.8 ±0.5* 9.8 ±0.3**12.3 ±0.6**20%药物血清 5.9 ±0.4**11.0 ±1.1**15.0 ±0.8**空白血清 +LY294002 13.0 ±1.1*19.0 ±0.3*25.0 ±1.2*20%药物血清 +LY294002 16.0 ±0.6*23.0 ±0.7*31.0 ±1.1*
表2 药物血清与LY294002对大肠癌细胞MDR-1 mRNA 表达的影响(n=3,±s)
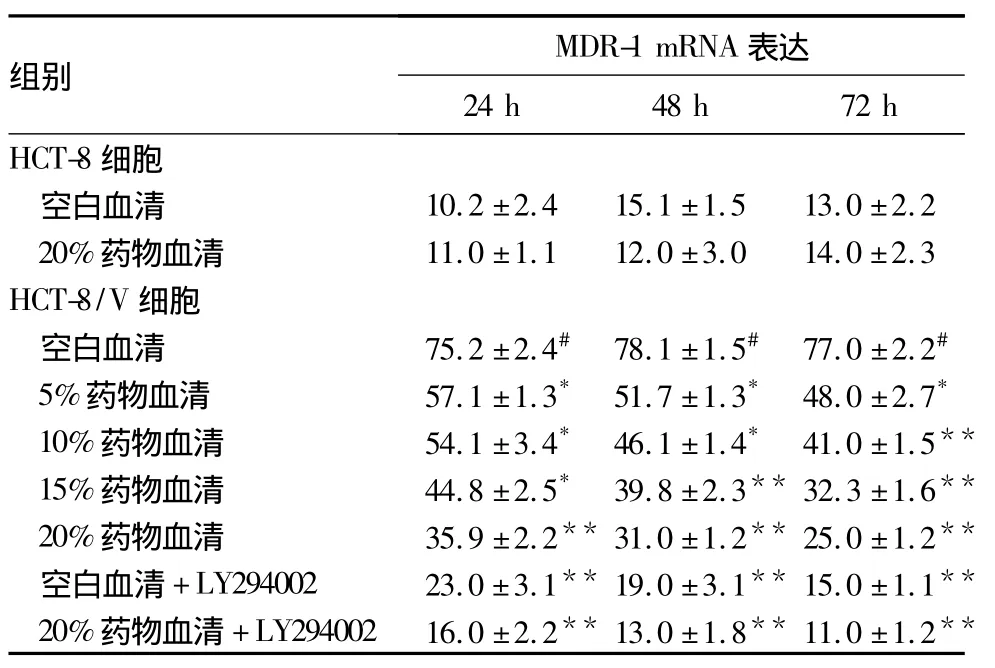
表2 药物血清与LY294002对大肠癌细胞MDR-1 mRNA 表达的影响(n=3,±s)
注:与同组空白血清比较,*P <0.05,**P <0.01;与 HCT-8空白血清比较,#P <0.01
组别MDR-1 mRNA 表达24 h 48 h 72 h HCT-8细胞空白血清 10.2 ±2.4 15.1 ±1.5 13.0 ±2.2 20%药物血清 11.0 ±1.1 12.0 ±3.0 14.0 ±2.3 HCT-8/V细胞空白血清 75.2 ±2.4# 78.1 ±1.5# 77.0 ±2.2#5%药物血清 57.1 ±1.3* 51.7 ±1.3* 48.0 ±2.7*10%药物血清 54.1 ±3.4* 46.1 ±1.4* 41.0 ±1.5**15%药物血清 44.8 ±2.5* 39.8 ±2.3** 32.3 ±1.6**20%药物血清 35.9 ±2.2** 31.0 ±1.2** 25.0 ±1.2**空白血清+LY294002 23.0 ±3.1** 19.0 ±3.1** 15.0 ±1.1**20%药物血清 +LY294002 16.0 ±2.2** 13.0 ±1.8** 11.0 ±1.2**
2.3 健脾解毒方对大肠癌细胞P-pg蛋白表达及p-Akt的影响 P-pg在HCT-8/V中的相对表达量明显高于 HCT-8。应用健脾解毒方药物血清和LY294002预处理HCT-8/V细胞48 h,P-pg表达均下降,二者联合预处理HCT-8/V细胞48 h,MDR-1 mRNA和 P-pg蛋白均明显下降(P均 <0.05)。20%药物血清处理HCT-8/V细胞48 h后,细胞内p-Akt表达水平无明显改变,使用LY294002处理细胞后,p-Akt明显下降,药物血清与LY294002联合处理HCT-8/V,两者在降低p-Akt上呈现协同效应。见表3。
表3 药物血清及LY294002对人结肠直肠腺癌细胞中P-gp 蛋白表达及 p-Akt的影响(n=3,±s)
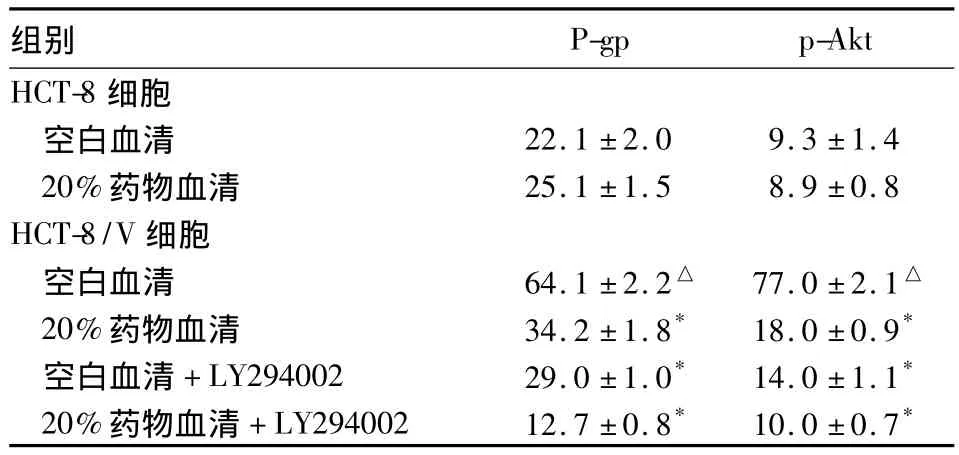
表3 药物血清及LY294002对人结肠直肠腺癌细胞中P-gp 蛋白表达及 p-Akt的影响(n=3,±s)
注:与同组空白血清比较,*P<0.05;与 HCT-8空白血清比较,△P <0.05
组别P-gp p-Akt HCT-8细胞空白血清 22.1 ±2.0 9.3 ±1.4 20%药物血清 25.1 ±1.5 8.9 ±0.8 HCT-8/V细胞空白血清 64.1 ±2.2△ 77.0 ±2.1△20%药物血清 34.2 ±1.8* 18.0 ±0.9*空白血清 +LY294002 29.0 ±1.0* 14.0 ±1.1*20%药物血清 +LY294002 12.7 ±0.8* 10.0 ±0.7*
3 讨论
中医学认为,大肠癌是由毒邪损伤肠络、痰瘀凝聚肠道及正气不足所致,其病机以脾胃虚弱为本,瘀毒内结为标,治则为健脾化瘀解毒。健脾解毒方具有健脾解毒活血之功效,用于治疗大肠癌已取得一定效果。
MDR是常见的化疗耐药现象,这种耐药性多针对各种天然来源的亲脂性药物,包括长春新碱、蒽环类、表鬼臼毒素类、放线菌素D、丝裂霉素、秋水仙碱以及紫杉醇等[7]。化疗药物与细胞膜上的P-gp结合后,ATP结合区被活化水解释放能量,药物尚未发挥抗肿瘤作用时,水解释放能量将抗肿瘤药物从细胞膜内向膜外的转换,细胞膜内药物浓度降低,达不到抗肿瘤效果,产生耐药性。目前,临床一般通过药物影响MDR-1的表达来消除肿瘤细胞对化疗的耐药性,增加肿瘤化疗的有效性。研究显示,健脾解毒方可降低肠癌患者外周血MDR1 mRNA和CK20 mRNA,调节P-gp[5]。本研究发现,健脾解毒方能有效提高大肠癌耐药细胞株对长春新碱的药物敏感性,而且药物敏感性的提高与药物作用时间及药物剂量呈正相关。同时发现健脾解毒方与PI3K抑制剂LY294002联合用药对提高耐药肿瘤细胞的药物敏感性具有协同效应。
有关MDR的发生机制中,研究最多的是P-gp介导的多药耐药。P-gp是由MDR-1基因编码的跨膜糖蛋白,分子量为170 kD,由1 280个氨基酸组成[8]。P-gp能与抗癌药物结合,将药物从胞内泵出胞外,随着抗癌药物在细胞内浓度的不断下降,药物的细胞毒作用逐渐减弱甚至消失,从而无法有效杀伤肿瘤细胞而引起 MDR[9]。
目前逆转恶性肿瘤耐药性的药物逆转剂主要有针对P-gp的逆转剂,共包括3代。第1代P-gp抑制剂包括钙离子拮抗剂、钙通道阻滞剂、免疫抑制剂、蛋白激酶C抑制剂、抗生素和表面活性剂等。第2代P-gp抑制剂主要有4种:右维拉帕米、右尼古地平、PSC833和 VX710。第 3代 P-gp抑制剂包括XR9576、Tariquidar、R101933 等[10];谷胱甘肽-S-转移酶GST介导的逆转剂,如丁硫氨酸亚砜胺、硝基咪唑类[3];针对MRP的逆转剂;针对肺耐药蛋白的逆转剂、DNA拓扑异构酶Ⅱ(TopoⅡ)有关的逆转剂;核酶逆转MDR、MDR反义寡核苷酸逆转、RNA干扰、肿瘤基因工程疫苗等基因治疗。
Akt是一种丝氨酸/苏氨酸蛋白激酶,它是磷脂酰肌醇3-激酶(PI3K)重要的下游直接效应分子,具有调控细胞的大小、生长、增殖、存活以及糖代谢等重要作用。Akt可在PI3K作用下磷酸化,形成p-Akt。p-Akt可通过cAMP反应元件结合蛋白上调凋亡抑制蛋白Bcl-2的表达从而抑制细胞调亡;还有研究提示,p-Akt能直接抑制caspase-9的活性,从而阻断其介导的caspase级联反应,抑制细胞凋亡。另外,p-Akt还能通过调控转录因子家族NF-κB和P53的作用影响细胞存活。
Akt是PI3K下游作用的靶蛋白,是PI3K/Akt信号转导通路的核心,可被很多生长因子激活,进而通过抑制凋亡和调节细胞增殖在肿瘤的发生以及耐药中起重要作用。Akt在P13K或缺氧微环境的刺激下发生磷酸化,激活的Akt从细胞质募集至胞膜或转位到胞核,使底物蛋白特定部位的丝氨酸、苏氨酸磷酸化。p-Akt通过抑制凋亡促进细胞的存活,在肿瘤的发生中起重要作用。
目前国内关于中药逆转MDR的体外实验已取得一定进展。本研究观察了健脾解毒方逆转大肠癌多药耐药基因中PI3K/Akt信号通路的动态变化,并观察阻断PI3K/Akt信号通路对健脾解毒方逆转大肠癌MDR基因的影响,从PI3K/Akt信号角度探讨该方逆转MDR的机制。结果显示,健脾解毒方对大肠癌MDR有逆转作用,在逆转大肠癌MDR基因的调控中,可以逆转大肠癌MDR-1的同时,伴随着p-Akt的变化。推测健脾解毒方逆转大肠癌MDR基因过程中,可能通过 PI3K/Akt信号通路调控MDR基因的表达,从而逆转肿瘤MDR,为中医健脾解毒治法治疗大肠癌提供了实验依据。
[1]Dubey Al,Min JW,Koo HJ,et al.Anticancer potency and multidrug-resistant studies of self-assembled arene-ruthenium metallarectangles[J].Chemistry,2013,19(35):11622-11628.
[2]Plisson F1,Huang XC,Zhang H,et al.Lamellarins as inhibitors of P-glycoprotein-mediated multidrug resistance in a human colon cancer cell line[J].Chem Asian J,2012,7(7):1616-1623.
[3]许建华,范忠泽.MDR1/P-gp与大肠癌耐药及中医药研究概况[J].安徽中医学院学报,2004,23(5):57-58.
[4]Eid SY,El-Readi MZ,Eldin EE,et al.Influence of combinations of digitonin with selected phenolics,terpenoids,and alkaloids on the expression and activity of P-glycoprotein in leukaemia and colon cancer cells[J].Phytomedicine,2013,21(1):47-61.
[5]Spengler G,Handzlik J,Ocsovszki I,et al.Modulation of multidrug efflux pump activity by new hydantoin derivatives on colon adenocarcinoma cells without inducing apoptosis[J].Anticancer Res,2011,31(10):3285-3288.
[6]F.M.奥斯伯[美].精编分子生物学实验指南[M].北京:科学出版社,2005:665-667.
[7]Jeon YH1,Bae SA,Lee YJ,et al.Evaluation of the reversal of multidrug resistance by MDR1 ribonucleic acid interference in a human colon cancer model using a Renilla luciferase reporter gene and coelenterazine[J].Mol Imaging,2010,9(6):343-350.
[8]Zhang YF,Li XH,Shi YQ,et al.CIAPIN1 confers multidrug resistance through up-regulation of MDR-1 and Bcl-L in LoVo/Adr cells and is independent of p53[J].Oncol Rep,2011,25(4):1091-1098.
[9]Schumacher U,Nehmann N,Adam E,et al.MDR-1-overexpression in HT 29 colon cancer cells grown in SCID mice[J].Acta Histochem,2012,114(6):594-602.
[10]Bai F1,Wang C,Lu Q,et al.Nanoparticle-mediated drug delivery to tumor neovasculature to combat P-gp expressing multidrug resistant cancer[J].Biomaterials,2013,34(26):6163-6174.

