骨桥蛋白及CD44v6在肺腺癌侵袭转移中的作用
王安雷,孙冰生,张真发
(天津市肿瘤防治重点实验室、天津市肺癌诊治中心、天津医科大学肿瘤医院,天津300060)
肺腺癌可分为浸润前病变、微浸润腺癌、浸润型腺癌、浸润型腺癌的变异型。原位肺腺癌(AIS)属浸润前病变,直径<3 cm的非黏液型细支气管肺泡癌定义为AIS,肿瘤细胞仅沿原有的肺泡结构生长(伏壁样生长),无间质、血管或胸膜浸润,可表现为乳头状或微小乳头状生长模式,而肺泡内肿瘤细胞缺如[1];伏壁样生长为主型腺癌(LPA)属浸润性腺癌,由AIS进展而来。骨桥蛋白(OPN)是一种分泌性钙结合磷酸化蛋白,通过与其受体整合素、CD44等结合来促进细胞的趋化、黏附和迁移。2012年6月~2013年9月,我们检测了 OPN及其受体CD44v6在肺腺癌细胞系中的表达情况,观察二者对肺腺癌侵袭能力的影响。
1 资料与方法
1.1 临床资料 选择2009年6月~2012年6月在天津医科大学肿瘤医院行手术治疗的原发性肺癌患者129例,男89例、女40例,年龄40~75岁、中位年龄60岁。病理诊断依据肺腺癌国际多学科分类标准[1],术前均未接受放疗或化疗治疗。其中AIS 36例,LPA 66例,癌旁组织(与原发病灶距离 >5 cm)27例。NCI-H358细胞来源于AIS,细胞购自上海复祥生物公司;A549细胞来源于侵袭性腺癌,由天津医科大学表观遗传调控与肿瘤发生实验室提供;PG-BE1细胞来源于肺巨细胞癌高转移亚型,购自上海拜力生物公司。由于OPN在PG-BE1细胞中高表达[2],因此以PG-BE1细胞培养基上清代替OPN作为趋化因子。三种细胞均用含胎牛血清10%的RPMI1640培养基,置于37℃、5%CO2细胞培养箱中培养。
1.2 方法
1.2.1 免疫组化检测 取手术切除组织制成石蜡标本,常规二甲苯脱蜡,梯度乙醇水化,高温高压抗原修复,3%H2O2阻断内源性过氧化物酶,正常山羊血清工作液封闭,滴加一抗、二抗,DAB显色,苏木精复染,梯度乙醇脱水,二甲苯透明,封片。OPN着色部位在细胞质,阳性细胞内呈弥漫性棕黄色;CD44v6着色部位在细胞膜,阳性细胞膜呈棕黄色。用评分法统计免疫组化染色结果,阳性细胞着色强度计分:不显色为0分,浅黄色为1分,棕黄色为2分;着色细胞百分数计分:着色细胞<10%为0分,≥10%且<40%为1分,≥40%且<70%为2分,≥70%为3分。将着色强度计分与着色细胞百分数计分的乘积作为总计分,0分者为阴性,≥1分为阳性。
1.2.2 Western blot检测 细胞培养72 h后,加入RIPA细胞裂解液,离心,10%SDS-PAGE分离细胞蛋白,转移至PVDF膜,用含5%脱脂奶粉的TBST缓冲液封闭2 h。分别加入 OPN、CD44v6、GAPDH的一抗,4℃过夜,TBST洗涤,加入二抗室温孵育2 h,TBST洗涤,加显色剂,X线胶片曝光成像。
1.2.3 RT-PCR检测 采用Trizol法提取细胞总RNA,逆转录合成cDNA。引物根据GenBank登录的人目的基因cDNA序列设计,由上海英潍捷基公司合成。OPN引物序列:上游引物:5'-TGGCCGAGGTGATAGTGTG-3',下游引物:5'-CGGGGATGGCCTTGTATG-3';CD44v6引物序列:上游引物:5'-CCAGGCAACTCCTAGTAGTACAAC-3',下游引物:5'-GGGAGTCTTCTCTGGGTGTTTG-3';GAPDH引物序列:上游引物:5'-GACCCCTTCATTGACCTCAAC-3',下游引物:5'-CTTCTCCATGGTGGTGAAGA-3'。以 GAPDH作为内参照进行分析。
1.2.4 Transwell小室试验 ①Transwell小室制备:将Matrigel用含1%胎牛血清的RPMI1640培养基按1∶3 稀释,每个 Transwell小室用50 μL Matrigel稀释液包被小室底部膜的上室面,37℃培养6 h。②制备细胞悬液:消化H358、A549细胞,PBS清洗,用含1%胎牛血清的RPMI1640培养基重悬,调整细胞浓度至1×105/L。③接种细胞:24孔板分4组,上室中分别加入100 μL含CD44v6抗体H358细胞悬液、不含CD44v6抗体H358细胞悬液、含CD44v6抗体A549细胞悬液及不含CD44v6抗体A549细胞悬液,下室分别加入10%FBS RPMI1640培养基、PG-BE1细胞培养基中加入OPN抗体、PG-BE1细胞培养基作为趋化因子。37℃培养24 h。④结果统计:将Transwell小室用PBS清洗,1%甲醛固定,用棉签擦去基质胶,结晶紫染色,PBS清洗。倒置显微镜下放大200倍计数。
1.2.5 统计学方法 采用SPSS18.0统计软件,数据的比较采用χ2检验,OPN与CD44v6的关系采用双变量相关性分析。P≤0.05为差异有统计学意义。
2 结果
2.1 OPN、CD44v6在肺癌及癌旁组织中的表达LPA、AIS及癌旁组织中OPN的表达阳性率分别为59.1%、27.8%、22.2%,CD44v6 分别为 84.8%、63.9%、22.2%,OPN、CD44v6 在 LPA 中的表达均明显高于AIS及癌旁组织(P均<0.05)。相关性分析显示,OPN与CD44v6表达呈正相关(r=0.62,P<0.05)。
2.2 OPN、CD44v6在肺腺癌细胞系中的表达OPN、CD44v6在 A549细胞中的表达均明显高于H358细胞(P <0.05)。见图1。
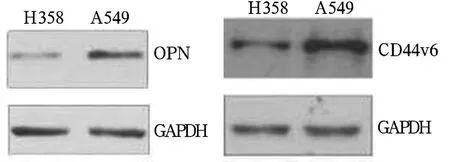
图1 OPN、CD44v6在A549细胞和H358细胞中的表达
2.3 OPN、CD44v6 mRNA在肺腺癌细胞系中的表达 以 GAPDH作内参,OPN、CD44v6 mRNA在H358细胞和A549细胞中的表达量比值为1∶5.7;CD44v6 mRNA在H358细胞和A549细胞中的表达量比值为 1∶8.2。OPN、CD44v6 mRNA 在 A549 细胞中的水平高于H358细胞(P均<0.05)。
2.4 Transwell试验结果 与对照组比较,以OPN作为下室趋化因子后,H358细胞穿过数增加了67%,A549细胞穿过数增加了250%,A549细胞的侵袭力高于H358细胞(P<0.05)。通过OPN抗体阻断OPN对两种细胞的趋化作用后,H358细胞穿过数下降约30%,A549细胞穿过数下降约64%;阻断CD44v6受体通道后,OPN对两种细胞的趋化作用明显减弱,H358细胞穿过数下降约20%,A549细胞穿过数下降约21%。
3 讨论
本研究显示,随着肺癌侵袭程度的增加,OPN的表达逐渐增高,提示OPN在肺腺癌进展中起重要作用,与 Chang等[3]的报道一致。A549细胞中的OPN蛋白及 mRNA水平明显高于 H358细胞。Zhang等[4]报道,OPN在肺癌组织和肺癌细胞系中均过度表达,特别在晚期转移肿瘤患者的恶性肿瘤细胞中过度表达,表明OPN可能与肿瘤细胞迁移和转移有关。Transwell试验提示,OPN对A549细胞的趋化作用高于H358细胞;通过OPN抗体阻断OPN对两种细胞的趋化作用后,A549细胞穿过数下降幅度高于H358细胞,提示A549细胞较H358细胞对OPN更敏感。杨艳娟等[5]对OPN在同类型肺癌组织表达的研究中发现,OPN的表达与肿瘤分化程度无关,而与临床分期有密切关系,认为OPN可作为肺癌转移的间接证据。Hu等[2]通过对非小细胞肺癌患者进行免疫组化测定发现,OPN在原发性非小细胞肺癌中普遍过度表达,认为OPN在肺癌发生和进展中具有重要作用。OPN参与了肿瘤发展的多个环节,有可能作为预测肺癌发生进展的潜能指标。OPN在其他肿瘤的发展转移中也具有重要意义,Chen等[6]研究发现,降低OPN的表达可以减少肝细胞癌的转移,以OPN作为靶向治疗可有效预防肝细胞癌转移。
CD44是一种被各种细胞包括肿瘤细胞广泛表达的细胞表面糖蛋白,作为细胞间的黏附分子参与细胞—基质、细胞—细胞之间的特异性黏附过程。在淋巴细胞归巢、血细胞生成、细胞移动及转移中起重要作用[7]。CD44v6是CD44的一种拼接变异体,CD44v6的表达可能改变肿瘤的构成和功能,有助于肿瘤细胞获得转移潜能。本研究显示,随着肿瘤的进展,CD44v6的表达依次递增,提示CD44v6表达与肺腺癌的发生进展具有密切关系;CD44v6蛋白及mRNA在A549细胞中的表达量高于H358细胞。杨艳娟等[5]研究发现,CD44v6表达水平与肺癌分化程度无明显关系,但与组织学类型、分期和淋巴转移有密切关系。CD44v6的异常表达与许多人类恶性肿瘤的发生、发展、侵袭转移及预后密切相关[8]。
本研究对OPN、CD44v6表达进行相关性分析,发现OPN与 CD44v6表达呈正相关。Elli等[9]报道,恶性淋巴瘤患儿血清中的OPN和CD44水平呈正相关,与肿瘤分期密切相关。Transwell试验提示,阻断CD44v6受体通道后,OPN对两种细胞的趋化作用明显减弱,提示CD44v6在OPN对肺腺癌的侵袭发展具有重要影响。Zohar等[10]认为,OPN 与CD44v6结合形成的复合体可能对加强细胞迁移过程中肿瘤细胞与基质的快速而短暂的接触起重要作用。Rao等[11]研究发现,CD44阳性的结肠癌细胞分泌更多的OPN,通过抗体阻断CD44后,OPN分泌量减少;OPN-CD44v6复合体与结肠癌患者生存呈负相关。Phillips等[12]发现,OPN与细胞表面受体CD44结合后,在肝癌增殖过程中起重要作用,OPN介导肿瘤细胞增殖能力依赖于CD44。Frey等[13]发现,OPN与MMP-9呈正相关,与EGFR信号通路有联系。CD44的表达使癌细胞容易发生细胞黏附,MMPs的表达又使癌细胞容易进入血管形成癌栓,并促进肿瘤的血管生成,而OPN对两者的表达有促进作用。其可能机制为:OPN含有RGD序列,并可通过RGD序列与CD44、CD44v6结合,激活MMPs,MMPs通过降解细胞外基质及基底膜的Ⅳ型胶原等成分,使癌细胞发生侵袭和转移,多因素共同促进肺腺癌的演进和转移。
综上所述,OPN、CD44v6表达与肺腺癌进展密切相关,OPN-CD44v6复合体对肺腺癌的侵袭能力具有重要作用,OPN可能作为评估肺腺癌进展及预测肿瘤转移潜能的指标。
[1]Travis WD,Brambilla E,Noguchi M,et al.International Associa-tion for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society:international multidisciplinary classification of lung adenocarcinoma[J].J Thorac Oncol,2011,6(2):244-285.
[2]Hu Z,Lin D,Yuan J,et al.Overexpression of osteopontin is associated with more aggressive phenotypes in human non-small cell lung cancer[J].Clin Cancer Res,2005,11(13):4646-4652.
[3]Chang YS,Kim HJ,Chang J,et al.Elevated circulating level of osteopontin is associated with advanced disease state of non-small cell lung cancer[J].J Lung Cancer,2007,57(3):373-380.
[4]Zhang J,Takahashi K,Takahashi F,et al.Differential osteopontin expression in lung cancer[J].Cancer Let,2001,171(2):215-222.
[5]杨艳娟,程德云,李熙霞,等.骨桥蛋白OPN和黏附分子CD44v6在肺癌中的表达[J].中国肺癌杂志,2007,10(2):98-101.
[6]Chen R,Xia Y,Xue T,et al.Down-regulation of osteopontin inhibits metastasis of hepatocellular carcinoma cells via a mechanism involving MMP-2 and uPA[J].Oncology Reports,2011,25(3):803-808.
[7]Gao C,Guo H,Downey L,et al.Osteopontin-dependent CD44v6 expression and cell adhesion in HepG2 cells[J].Carcinogenesis,2003,24(12):1871-1878.
[8]Hefler LA,Concin N,Mincham D,et al.The prognostic value of immunohistochemically detected CD44v3 and CD44v6 expression in patient swith surgically staged vulvar carcinoma:a multicenter study[J].Cancer,2002,94(1):125-130.
[9]Elli M,Dagdemir A,Bozkurt C,et al.Serum osteopontin and CD44 levels in lymphoreticular malignancies in children[J].Bratisl Lek Listy,2012,113(9):534-538.
[10]Zohar R,Suzuki N,Suzuki K,et al.Intracellular osteopontin is an integral component of the CD44-ERM complex involved in cell migration[J].J Cell Physiol,2000,184(1):118-130.
[11]Rao G,Wang H,Li B,et al.Reciprocal Interactions between tumor-associated macrophages and CD44-positive cancer cells via osteopontin/CD44 promote tumorigenicity in colorectal cancer[J].Clin Cancer Res,2013,19(4):785-797.
[12]Phillips RJ,Helbig KJ,Seth D,et al.Osteopontin increases hepatocellular carcinoma cell growth in a CD44 dependant manner[J].World J Gastroenterol,2012,18(26):3389-3399.
[13]Frey AB,Wali A,Pass H,et al.Osteopontin is linked to p65 and MMP-9 expression in pulmonary adenocarcinoma but not in malignant pleural mesothelioma[J].Histopathology,2007,50(6):720-726.

