盆腔肿瘤放疗对兔直肠组织放射性纤维化形成的作用及机制
陈海燕,杨 旭,王沛靓
(新疆医科大学第五附属医院,乌鲁木齐830011)
纤维化是机体组织受外界因素刺激后的一种修复过程,表现为细胞外基质的过度沉积[1]。放射性纤维化是恶性肿瘤患者临床放射治疗后常见并发症[2]。放疗是盆腔肿瘤主要的治疗手段,大剂量放射治疗可导致盆腔纤维化,包括直肠纤维化、输尿管纤维化,严重者会诱发淋巴管阻塞和输尿管梗阻[3]。研究发现,细胞因子在纤维化的形成过程中扮演重要角色,转化生长因子(TGF-β)是盆腔放射性纤维化的关键因子[4]。2013年3~7月,我们对新西兰大白兔给予放射线照射,探讨放射性纤维化的形成机制。
1 资料与方法
1.1 材料 清洁级雌性新西兰大白兔20只,体质量(2 000 ±200)g。TGF-β(mRNA)ISH DIG Kit购自天津颢洋生物制品科技有限责任公司;鼠抗兔Ⅲ型胶原单克隆抗体IgG购自美国Merck公司;NF-κB多克隆抗体、TGF-β多克隆抗体购自美国Santa Cruze公司;SP免疫组化试剂盒及浓缩型DAB试剂盒均购自日本株式会社同仁化学研究所。
1.2 方法
1.2.1 照射方法 将兔随机分成空白对照组、照射4周组、照射12周组和照射16周组,采用6%水合氯醛腹腔注射麻醉,固定四肢,首先确定X射线模拟机照射范围,照射视野为耻骨联合至耻骨联合上缘4 cm,腹白线左右2 cm,视野范围4 cm×4 cm。消毒腹部皮肤后,沿腹正中线切开,进入腹腔,给予6 MeV β射线单次大剂量照射,照射距离为100 cm,剂量为20 Gy,剂量率为400 cGy/min。照射结束后关腹,缝合。空白对照组操作过程同放射组,但不进行射线照射。术后室温、常规饲养,自术后第2天开始皮下注射雌二醇0.05 mg/d,持续4 d。于照射4周、12周和16周末分别处死对应组动物,空白对照组于实验完成时统一处死。
1.2.2 病理学检查 取兔的直肠和输尿管,10%甲醛固定,乙醇脱水,二甲苯透明,石蜡包埋,切5~8 μm厚的切片。石蜡切片经二甲苯脱蜡,乙醇脱水,苏木精染色,伊红复染。再经乙醇脱水,二甲苯透明,树胶封片,光学显微镜下观察HE染色情况。
另取石蜡切片行Azan染色,切片常规入水、水洗,放入37℃偶氮卡红液中放置4 h,冷却后蒸馏水清洗,用含1%苯胺的95%乙醇溶液分色,0.5%磷钨酸水溶液放置3~5 min,再放入苯胺蓝—橘黄G染液30 min,擦干后95%乙醇分色,乙醇梯度洗脱,二甲苯透明,中性树胶封片,光学显微镜下评价放射性直肠纤维化的程度。
1.2.3 TGF-β、NF-κB 表达检测 提取各组盆腔组织蛋白,采用蛋白印迹法检测TGF-β、NF-κB表达,采用双缩脲法测定直肠组织蛋白含量,制样(含50 μg蛋白),金属浴5 min,冷却后上样。制备8% ~10%的 SDS-PAGE凝胶,上样,电泳2~4 h,转移PVDF膜,5%脱脂牛奶封闭1 h,分别用 TGF-β和NF-κB一抗孵育,4℃过夜,清洗,二抗室温孵育1 h,清洗,ECL显色,暗室洗片,行定量分析。
1.2.4 统计学方法 采用 SPSS17.0统计软件,结果以±s表示,应用ANOVA检验多个均数间差异性,当组间存在显著性差异时用t检验,进行单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 病理学观察 HE染色结果显示,空白对照组直肠组织细胞排列整理,无炎性细胞浸润;照射4周组可见少量炎性细胞浸润和充血水肿;照射12周组可见大量炎性细胞浸润,充血、水肿明显,细胞肿胀、坏死、脱落,黏膜组织结构紊乱,结缔组织呈纤维化改变;照射16周组可见巨噬细胞及中性粒细胞浸润和典型的外结缔组织纤维化改变。见图1。
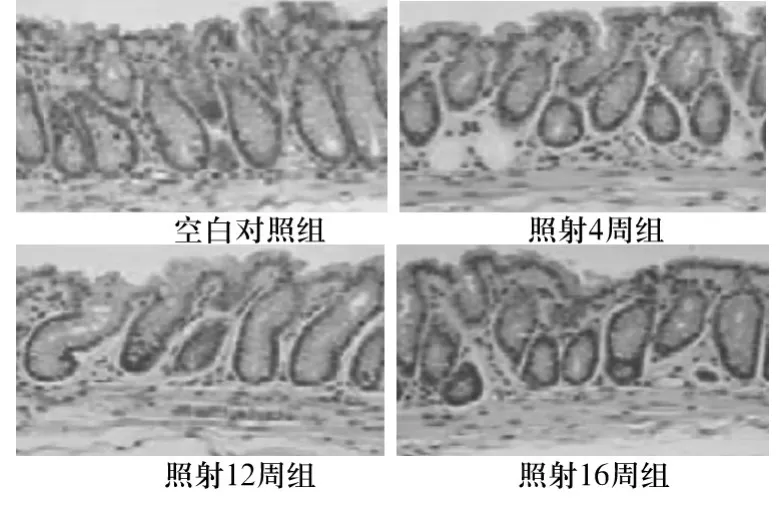
图1 各组直肠组织HE染色结果
Azan染色结果显示,空白对照组直肠组织中未见纤维化表达,照射4周组直肠组织中见少量蓝色纤维化表达,照射12、16周组直肠组织中见大量纤维化表达。见图2。
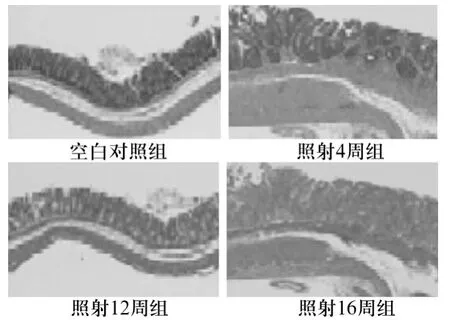
图2 各组直肠组织Azan染色结果
2.2 直肠组织细胞因子变化 各组直肠组织中的TGF-β和 NF-κB蛋白表达见图 3。直肠组织中TGF-β蛋白及核内NF-κB蛋白表达均随照射时间的延长而增加。见图3。
3 讨论
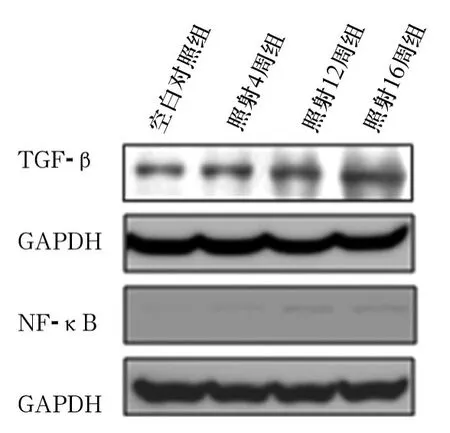
图3 直肠组织细胞因子变化
放射性纤维化是恶性肿瘤患者临床放射治疗后常见并发症。本研究采用射线大剂量照射新西兰大白兔后,检测直肠组织病理学改变,空白对照组直肠组织中细胞排列整理,无炎性细胞浸润,照射4~16周后可见大量炎性细胞浸润、充血水肿明显,细胞肿胀坏死,脱落,黏膜组织结构紊乱,结缔组织呈纤维化改变。Azan染色空白对照组直肠组织中未见纤维化表达,照射第4~16周后见蓝色纤维化表达,可见直肠组织中大量纤维化形成。
纤维化是机体组织受外界因素刺激后的一种修复过程,放射治疗中常出现放射性纤维化,主要表现为细胞外基质的大量沉积以及成纤维细胞的过度繁殖。研究表明,纤维化的形成与发展是一个动态过程,存在不断重建和成纤维细胞被长期激活等特点[5]。在慢性纤维化形成及发展的过程中,成纤维细胞的激活是关键。在纤维化形成期,始终伴随着炎性细胞浸润、大量巨噬细胞和内皮细胞聚集在新生毛细血管,同时并存着大量成纤维细胞,而这些成纤维细胞被激活后多成为细胞骨架蛋白,进而参与伤口的收缩。研究表明,TGF-β是盆腔放射性纤维化的关键因子,其表达程度与纤维化进程呈正相关[6~9]。TGF-β 具有多种生物学特性,主要包括:诱发一系列细胞内快速反应,如诱导细胞凋亡或改变细胞增殖情况等[10~12];对细胞生长发挥负调节作用,如内皮细胞、上皮细胞、造血干细胞等;通过影响对细胞周期变化起调控作用的蛋白激酶的活性,抑制细胞增殖。TGF-β具有抑制细胞生长和增殖、诱导细胞凋亡的作用,因此通过影响TGF-β信号通路可能抑制肿瘤细胞的生长。
本研究显示,直肠组织中TGF-β蛋白表达随照射时间的延长而增加,表明放射线刺激后,直肠组织中TGF-β蛋白表达增多,从而促进纤维化的进程,病理形态学检查也进一步验证纤维化的形成。检测直肠组织中NF-κB蛋白变化,可见核内NF-κB蛋白表达也随照射时间的延长而增加,提示TGF-β蛋白的表达可能会影响下游信号通路,从而促进NF-κB蛋白的核转录。
综上所述,TGF-β是放射性纤维化形成的关键因素,放射治疗增加TGF-β蛋白表达,可能与促进NF-κB蛋白的核转录有关。以TGF-β为靶点分析放射性纤维化的进展和治疗,为临床治疗提供了新的思路。
[1]Nierhoff J,Chávez Ortiz AA,Herrmann E,et al.The efficiency of acoustic radiation force impulse imaging for the staging of liver fibrosis:a meta-analysis[J].Eur Radiol,2013,23(11):3040-3053.
[2]殷尉伯,谷铣之.肿瘤放射治疗学[M].3版.北京:中国协和医科大学出版社,2003:52-56.
[3]Hamama S,Gilbert-Sirieix M,Vozenin MC,et al.Radiation-induced enteropathy:molecular basis of pentoxifylline-vitamin E antifibrotic effect involved TGF-β1 cascade inhibition[J].Radiother Oncol,2012,105(3):305-312.
[4]Horton JA,Li F,Chung EJ,et al.Quercetin inhibits radiation-induced skin fibrosis[J].Radiat Res,2013,180(2):205-215.
[5]Vera R,Trombetta M,Mukhopadhyay ND,et al.Long-term cosmesis and toxicity following 3-dimensional conformal radiation therapy in the delivery of accelerated partial breast irradiation[J].Pract Radiat Oncol,2014,4(3):147-152.
[6]Zhuang H,Yuan Z,Chang JY,et al.Radiation pneumonitis in patients with non-small-cell lung cancer treated with erlotinib concurrent with thoracic radiotherapy[J].J Thorac Oncol,2014,9(6):882-885.
[7]Ishimaru M,Yusuke N,Tsukimoto M,et al.Purinergic signaling via P2Y receptors up-mediates IL-6 production by liver macrophages/Kupffer cells[J].J Toxicol Sci,2014,39(3):413-423.
[8]Satheeshkumar PS,Mohan MP,Jacob J.Restricted mouth opening and trismus in oral oncology[J].Oral Surg Oral Med Oral Pathol Oral Radiol,2014,117(6):709-715.
[9]Thompson R,Giuliani M,Yap ML,et al.Stereotactic body radiotherapy in patients with previous pneumonectomy:safety and efficacy[J].J Thorac Oncol,2014,9(6):843-847.
[10]Gao F,Fish BL,Szabo A,et al.Enhanced survival from radiation pneumonitis by combined irradiation to the skin[J].Int J Radiat Biol,2014,14(8):1-42.
[11]Agrawal S.Late effects of cancer treatment in breast cancer survivors[J].South Asian J Cancer,2014,3(2):112-115.
[12]Ishida K,Hirose T,Yokouchi J,et al.Phase II study of concurrent chemoradiotherapy with carboplatin and vinorelbine for locally advanced non-small-cell lung cancer[J].Mol Clin Oncol,2014,2(3):405-410.

