红曲霉固态发酵产生淀粉酶培养基的优化
刘 波,曾丽萍,邬应龙,*
(四川农业大学食品学院,四川 雅安 625014)
红曲霉固态发酵产生淀粉酶培养基的优化
刘 波1,曾丽萍2,邬应龙1,*
(四川农业大学食品学院,四川 雅安 625014)
研究碳源、氮源、无机盐对红曲霉M2固态发酵产生淀粉酶的酶活性影响。在单因素试验的基础上,采用响应面试验设计对红曲霉固态发酵产生淀粉酶的培养基进行优化,并建立乳糖、(NH4)2SO4、K2HPO4变化的二次回归方程,探讨各因素对生淀粉酶酶活力的影响。在固态发酵基础培养基中,最终确定适宜的培养基条件为:乳糖添加量为8.18%、(NH4)2SO4添加量为6.36%、K2HPO4添加量为0.91%;在该条件下可得到红曲霉M2产生淀粉酶的最大酶活力,预测值为680.29 U/g,对实验结果进行验证,得到生淀粉酶酶活力为662.21 U/g。
红曲霉;固态发酵;生淀粉酶;Box-Behnken试验设计
生淀粉酶是指能对不经过蒸煮糊化的生淀粉颗粒表现出强水解活性的酶类。由于生淀粉酶能将未经蒸煮糊化的生淀粉直接转化成葡萄糖等可发酵性糖供微生物生长与代谢,其比传统的高温蒸煮糖化节约25%~30%的能耗[1-2]。基于减少能耗和有效利用天然资源的需要,生淀粉的生物能转化过程引起了广大科研人员的关注,并对能降解生淀粉的酶类进行了研究[3-9]。大量研究[10-14]表明,许多真菌和细菌都能够产生生淀粉酶,并且通过发酵条件等方法的优化,其产酶能力可大大增强。如蔡宇杰等[15]用遗传算法与神经网络相耦联的方法对生淀粉发酵培养基进行了优化,使生淀粉的活力得到较大的提高。刘军等[16]则采用了黑曲霉、米曲霉、宇佐美曲霉和少根根霉,并进行混株发酵,从而使分解生淀粉能力得到显著提高。与此同时,研究人员对生淀粉酶的研究主要集中在液态发酵[9,12,17]而对固态发酵的研究较少。本研究在对生淀粉产生菌的最佳碳源、氮源和无机盐的种类和数量需要进行系统研究的基础上,应用响应面法(response surface methodology,RSM)[18-22]对其固态发酵培养基组成进行筛选和优化,旨在提高该菌株的产酶量。
1 材料与方法
1.1 材料与试剂
红曲霉M2 四川农业大学功能性实验室保藏。
麸皮 雅安市雨城区农贸市场购买;NaNO3、MgSO4、K2HPO4、葡萄糖、乳糖等均为国产分析纯;PDA培养基(斜面):土豆300.0 g/L、葡萄糖20.0 g/L、琼脂20.0 g/L;种子培养基:土豆300.0 g/L、葡萄糖20.0 g/L;固态发酵基础培养基:麸皮10.0 g、蒸馏水12.0 mL。
1.2 仪器与设备
BT-124S型电子天平 北京赛多利仪器系统有限公司;DHP-420电热恒温培养箱 重庆四达实验仪器有限公司顺达仪器厂;HHS-9S型恒温水浴锅 上海光地仪器设备有限公司;JOUANBR4i型冷冻离心机 美国Thermo公司;UV-2102型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 孢子悬液的制备
取培养好的斜面,用无菌生理盐水洗脱孢子后转移至装有玻璃珠的无菌三角瓶中,充分摇动使孢子散开,用带脱脂棉的无菌漏斗过滤除去菌丝得到孢子悬液,将孢子浓度调整到106个/mL。
1.3.2 固态发酵培养
将1 mL孢子悬液接种到固态发酵基础培养基中,在32 ℃条件下,恒温培养6 d测定其酶活力。
1.3.3 粗酶液的制备
粗酶液的制备:取培养后的固态发酵培养物,先称质量,然后加蒸馏水100 mL,在40 ℃水浴中浸提1 h,4层纱布过滤,3 000 r/min离心15 min。
1.3.4 指标测定
生淀粉酶活力的测定:参考孙海彦等[12]的方法。先取2.0 mL 2.5 g/100 mL的生玉米淀粉悬浮液,然后加入2.0 mL 0.1 mol/L的柠檬酸-柠檬酸钠缓冲液(pH 5.0),40 ℃预热10 min,然后再加入1.0 mL粗酶液。40 ℃水浴反应30 min后,加入0.5 mL 4 g/100 mL NaOH溶液终止反应,反应液用3 000 r/min离心10 min,取上清液用DNS法[23]测葡萄糖量。空白实验为先加0.5 mL 4 g/100 mL NaOH溶液,再加入酶液,用以消除酶液和生玉米淀粉中游离糖的影响。
生淀粉酶活力单位的定义:在该测定条件下,1 h释放1 μmol葡萄糖的酶量定义为一个酶活力单位。
1.3.5 培养基成分的筛选
1.3.5.1 碳源对产酶的影响
在固态发酵基础培养基中,分别添加质量分数1%的玉米粉、可溶性淀粉、蔗糖、葡萄糖和乳糖,于恒温培养箱中32 ℃培养6 d后测定酶活力。根据酶活力的大小确定最佳的碳源种类。
1.3.5.2 氮源对产酶的影响
在固态发酵基础培养基中,分别添加1%的蛋白胨、牛肉膏、尿素、NaNO3和(NH4)2SO4,于恒温培养箱中32 ℃培养6 d后测定酶活力。根据酶活性的大小确定最佳的氮源种类。
1.3.5.3 无机盐对产酶的影响
在固态发酵基础培养基中,分别添加0.1%的K2HPO4、KH2PO4、MgSO4·7H2O、CuSO4·5H2O和CaCl2,于恒温培养箱中32 ℃培养6 d后测定酶活力。根据酶活性的大小确定最佳的无机盐种类。
1.3.6 培养基各成分添加量的单因素试验
1.3.6.1 碳源添加量对产酶的影响
根据碳源的筛选结果,选择酶活性最高的作为最适碳源。在固态发酵基础培养基中,分别添加1%、2%、4%、6%、8%、10%、15%、20%。然后于恒温培养箱中32 ℃培养6 d后测定酶活力。根据酶活力的大小确定最佳的碳源添加量。
1.3.6.2 氮源添加量对产酶的影响
根据氮源的筛选结果,选择酶活性最高的作为最适氮源。在固态发酵基础培养基中,分别添加1%、2%、4%、6%、8%、10%。然后于恒温培养箱中32 ℃培养6 d后测定酶活力。根据酶活力的大小确定最佳的氮源添加量。
1.3.6.3 无机盐添加量对产酶的影响
根据无机盐的筛选结果,选择酶活性最高的作为最适无机盐。在固态发酵基础培养基中,分别添加0.1%、0.2%、0.4%、0.6%、0.8%、1.0%、1.5%、2.0%。然后于恒温培养箱中32 ℃培养6 d后测定酶活力。根据酶活力的大小确定最佳的无机盐添加量。
1.3.7 响应面试验优化设计
根据单因素的试验结果,选用乳糖、(NH4)2SO4、K2HPO4为考察因素,采用Box-Behnken中心组合原理设计三因素三水平的响应曲面法试验。
2 结果与分析
2.1 培养基成分的筛选
2.1.1 碳源的筛选
碳源作为真菌培养基的基本成分之一,能够为真菌的生长代谢提供能量。同时它也是菌体细胞组成的原料,也是菌体生长发育必需的能源物质。某些碳源是酶的诱导物,选择适宜的碳源有利于定向促进某些酶的合成。不同碳源对生淀粉酶酶活的影响如图1所示,红曲霉可以利用不同的碳源,但碳源类型对生淀粉酶酶活性的高低影响较小。其中以乳糖为碳源时,生淀粉酶酶活性要高于其他几种碳源。因此,选用乳糖作为红曲霉固态发酵培养基的最佳碳源。
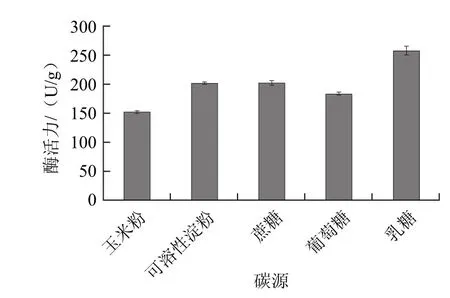
图1 碳源对生淀粉酶酶活性的影响Fig.1 Effect of carbon source on the activity of raw-starch-digesting amylase
2.1.2 氮源的筛选
氮的主要功能是提供细胞原生质和其他结构物质中的氮素,是微生物细胞需要量仅次于碳的元素。它是真菌培养基的基本成分之一,用于合成蛋白质、核酸等含氮类代谢物。不同氮源对生淀粉酶酶活性的影响如图2所示。红曲霉能很好的利用有机氮源蛋白胨和无机氮源(NH4)2SO4。两种有机氮源中,蛋白胨的效果明显好于牛肉膏。在3种无机氮源中,以(NH4)2SO4的效果最好。由于考虑到成本问题,故选择以(NH4)2SO4作为红曲霉固态发酵培养基的最佳氮源。

图2 氮源对生淀粉酶酶活性的影响Fig.2 Effect of nitrogen source on the activity of raw-starch-digesting amylase
2.1.3 无机盐的筛选
除了上述的碳源和氮源外,微生物通常还需要一定量的无机盐来调节其生长代谢,比如磷是核酸和蛋白质的重要组成成分,能够影响微生物的生长;而镁作为许多重要酶的激活剂则能够影响基质氧化和蛋白质合成。不同无机盐对生淀粉酶酶活性的影响如图3所示,添加K2HPO4的生淀粉酶酶活性最高,说明K2HPO4对红曲霉产生淀粉酶优于其他几种无机盐。因此,选择在固体培养基中添加K2HPO4。

图3 无机盐对生淀粉酶酶活性的影响Fig.3 Effect of mineral salt on the activity of raw-starch-digesting amylase
2.2 培养基各成分添加量的单因素试验结果
2.2.1 乳糖添加量对生淀粉酶酶活性的影响
根据碳源的筛选结果,红曲霉固态发酵选用乳糖作为最佳碳源。由图4可知,随着乳糖添加量的增加,生淀粉酶酶活性逐渐升高;当乳糖的添加量达到8%时,酶活性达到最大;而当乳糖添加量继续增加时,生淀粉酶酶活性反而下降,这表明过大的添加量并不利于酶活性的增大。故在本实验的考察范围内乳糖的最佳添加量为8%。

图4 乳糖的不同添加量对生淀粉酶酶活性的影响Fig.4 Effect of lactose level in the medium on the activity of rawstarch-digesting amylase
2.2.2 (NH4)2SO4添加量对生淀粉酶酶活性的影响

图5 (NH4)2SO4不同添加量对生淀粉酶酶活性的影响Fig.5 Effect of ammonium sulphate level in the medium on the activity of raw-starch-digesting amylase
由图5可知,(NH4)2SO4添加量在1%~6%的范围内,生淀粉酶酶活性随着添加量的增加而增大,但当(NH4)2SO4的添加量超过6%时,生淀粉酶酶活性随着(NH4)2SO4的增加而减小。这表明过多的添加量并不利于酶活性的升高,只有适宜的添加范围内才有利于红曲霉产生淀粉酶。故在本实验的考察范围内(NH4)2SO4的添加量选择6%。
2.2.3 K2HPO4添加量对生淀粉酶酶活性的影响

图6 K 6 K2HPOHPO4的不同添加量对生淀粉酶酶活性的影响Fig.6 Effect of dipotassium hydrogen phosphate level in the medium on the activity of raw-starch-digesting amylase
由图6可知,K2HPO4添加量在0.1%~0.8%范围内,生淀粉酶的酶活性随着添加量的增加而增大,但当K2HPO4添加量超过1.0%时,生淀粉酶酶活性随着K2HPO4添加量的增加而减小。这表明过大的添加量并不利于红曲霉产生淀粉酶。只有适宜的添加量条件下才有利于红曲霉产生淀粉酶。故在本实验考察范围内K2HPO4的最佳添加量为0.8%。
2.3 响应面试验设计优化结果
2.3.1 模型的建立及显著性检验
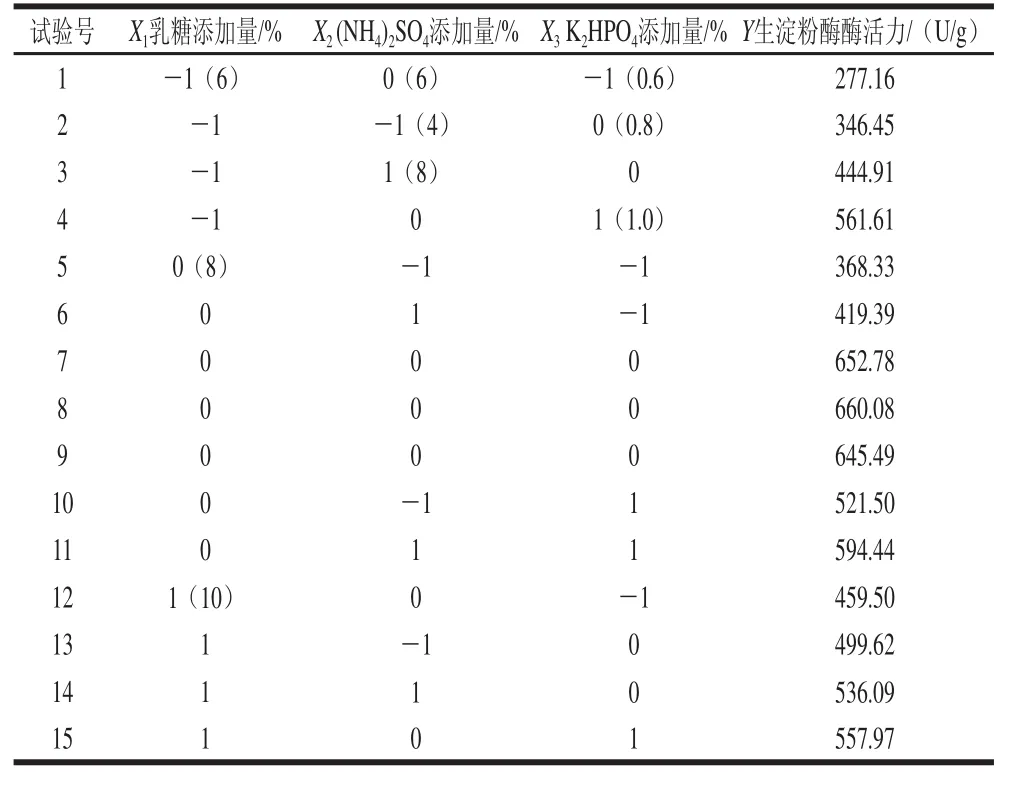
表1 响应面分析试验结果Table 1 Experimental design and results for response surface analysis
利用Design Expert v7.0.0(Stat-Ease,Inc. minneapolis, MN,USA)软件进行统计分析。根据表1的试验结果,对表中数据进行多元回归拟合,得到红曲霉固态发酵产生生淀粉酶酶活力(Y)对乳糖(X1)、(NH4)2SO4(X2)、K2HPO4(X3)的多项回归方程为:

对试验结果进行方差分析,结果如表2所示。

表2 生淀粉酶酶活性多项式回归模型方差分析Table 2 Analysis of variance (ANOVA) for the fitted quadratic polynomial model for raw-starch-digesting amylase
由表2可知,建立的回归模型显著(P<0.05),说明方程拟合度较好;失拟项P=0.150 3>0.05,说明失拟项不显著,残差由随机误差引起,模型选择正确;复相关系数R2=0.994 5,表明预测值和实测值之间具有很高的相关性;调整性决定系数,表明方程模型可信度较高,能够较好地描述实验结果。
2.3.2 响应面优化及分析

图7 乳糖和(NH4)2SOSO4添加量对生淀粉酶酶活性影响的响应面及等高线图Fig.7 Response surface and contour plots for the effect of lactose and ammonium sulphate on the activity of raw-starch-digesting amylase
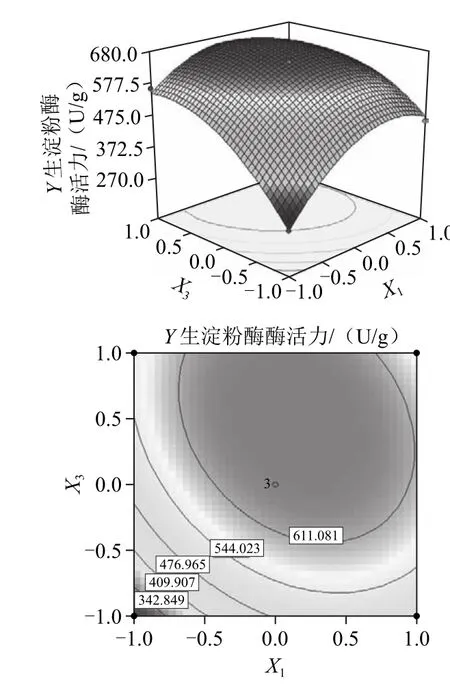
图8 乳糖和K2HPO4添加量对生淀粉酶酶活性影响的响应面及等高线图Fig.8 Response surface and contour plots for the effect of lactose and dipotassium hydrogen phosphate on the activity of raw-starch-digesting amylase

图9 ((NH4)2SO4和KK2HPO4添加量对生淀粉酶酶活性影响的响应面及等高线图Fig.9 Response surface and contour plots for the effect of ammonium sulphate and dipotassium hydrogen phosphate on the activity of rawstarch-digesting amylase
由图7~9可知,它们分别反应了X1、X2、X3这3个因素的两两交互作用对响应值的影响。通过Design Expert软件,进行分析计算,可得到红曲霉M2固态发酵产生淀粉酶的最佳培养基配方为:乳糖添加量为8.14%、(NH4)2SO4添加量为6.41%、K2HPO4添加量为0.91%,在此条件下生淀粉酶酶活力预测值可达680.29 U/g。结合实际操作的方便和方差分析结果,最终确定培养基配方为:乳糖为8.18%、(NH4)2SO4为6.36%、K2HPO4为0.91%。即在22.0 g固态发酵基础培养基中,乳糖添加量为1.80 g、(NH4)2SO4添加量为1.40 g、K2HPO4添加量为0.2 g。
2.3.3 模型的验证
为了验证红曲霉M2固态发酵产生淀粉酶的精确性,对该模型进行验证实验。按照此最终培养基参数进行3次重复实验,可得生淀粉酶酶活力平均值为662.21 U/g,实验值与预测值(680.29 U/g)相差较小。表明此模型是可行有效的,并具有一定的实践参考价值。
3 结论与讨论
通过培养基的筛选,确定了红曲霉M2固态发酵产生淀粉酶的最佳培养基配方:碳源为乳糖,氮源为(NH4)2SO4,无机盐为K2HPO4。在单因素试验结果的基础上,采用Box-Behnken试验设计,对红曲霉产生淀粉酶培养基进行了优化,通过响应面法对试验数据进行优化与评价,得到影响生淀粉酶酶活力的二次多项式回归模型,并对该模型进行显著性检验。最终得到优化培养基组成为:乳糖添加量为8.18%、(NH4)2SO4添加量为6.36%、K2HPO4添加量为0.91%;在此条件下可得到生淀粉酶的最高酶活,预测值为680.29 U/g,对实验结果进行验证,可得生淀粉酶酶活力平均值为662.21 U/g,与理论预测值基本一致证明该模型合理可靠。研究人员通过采用不同方法来提高菌种产生淀粉酶的活力。如罗军侠[24]以Aspergillus fumigalus MS-09为研究对象,对其产耐酸生淀粉糖化酶的培养基条件进行了筛选。在优化条件下,其酶活力可达27.59 U/mL。朱文优等[2]以米曲霉y18为出发菌株,通过2次诱变,获得了产生淀粉酶活力较高的菌株y18-U-36-D-40,其酶活力达到434.5 U/mL。孙海彦等[12]通过摇瓶发酵,研究了培养基成分对Penicillium sp.X-1液态发酵产生淀粉酶的影响,在最优条件下酶活力达到239 U/mL。刘连成等[25]通过正交试验优化得出菌株产酶的最佳发酵培养基,结果表明以玉米淀粉为碳源,蛋白胨和酵母膏为复合氮源时生淀粉酶活力可达194.9 U/mL,是优化前的1.1倍。苏小军等[14]以黑曲霉 AF-1为研究对象,对其固态发酵产酶条件进行了优化,得出培养基豆粕粉含量、麸皮添加量和温度的最佳值分别为11.46%、17.41 g和26.26 ℃,优化后的酶活力为204 U/mL。就上述所测得的酶活力相差较大除了菌种不同的原因外,更多可能是测定方法及酶活力定义不统一所致。目前红曲霉固态发酵产生淀粉酶的研究未见详细报道。本研究中固态发酵具有成本低廉、工艺简单、零污染等优点,具有较好的工业化生产潜力。
[1] 朱文优, 王新惠. 产生淀粉酶真菌的分离筛选及初步鉴定[J]. 酿酒科技, 2009(2): 21-22.
[2] 朱文优, 周守叙. 米曲霉高产生淀粉酶菌株的诱变选育[J]. 中国酿造, 2010, 29(6): 57-58.
[3] PAN Ming, ZHOU Yongjin, ZHANG Qiang, et al. Screening a rawstarch-digesting glucoamylase strain and study on enzymology properties[J]. Journal of Sichuan University of Science and Engineering: Natural Sicence Edition, 2006, 19(6): 66-68.
[4] MAMO G, GESSESSE A. Production of raw-starch digesting amyloglucosidase by Aspergillus sp. GP-21 in solid state fermentation[J]. Journal of Industrial Microbiology and Biotechnology, 1999, 22: 622-626.
[5] XU Dongliu, YAN Xu. A novel raw starch digesting α-amylase froma newly isolated Bacillus sp.YX-1: purifi cation and characterization[J]. Bioresource Technology, 2008, 99: 4315-4320.
[6] SUN Haiyan, ZHAO Pingjuan, PENG Ming. Application of maltitol toimprove production of raw starch digesting glucoamylase by Aspergillus niger F-08[J]. World Journal of Microbiology and Biotechnology, 2008, 24: 2613-2618.
[7] GOYAL N, GUPTA J K, SONI S K. A novel raw starch digesting ther-mostable α-amylase from Bacillus sp. I-3 and its use in the direct hydrolysis of raw potato starch[J]. Enzyme and Microbial Technology, 2005, 37: 723-734.
[8] 曾丽娟, 杨键, 陈英, 等. 生淀粉酶生产菌株Paeni bacillus sp.的筛选和酶的纯化及酶学性质[J]. 食品与生物技术学报, 2007, 26(3): 106-109.
[9] 诸葛斌, 姚惠源, 诸葛健. 生淀粉糖化酶产生菌Rhizopus OR-1UVN培养基优化的研究[J]. 食品与发酵工业, 2002, 28(7): 29-30.
[10] OMENU A M, AKPAN I, BANKOLE M O, et al. Hydrolysis of law tuber starches by amylase of Aspergillus nigerAM07 isolated from the soil[J]. African Journal of Biotechnology, 2005, 4(1): 19-25.
[11] EZEJI T C, BAHL H. Production of raw-starch-hydrolysing α-amylase from newly isolated Geobacillus thermodenitrifi cans HRO10[J]. World Journal of Microbiology and Biotechnology, 2007, 23: 1311-1315.
[12] 孙海彦, 张伟国. Penicillium sp. X-1液态发酵生产生淀粉酶的优化[J].食品与生物技术学报, 2007, 26(3): 106-109.
[13] MARLIDA Y, SAARI N, HASSAN Z, et al. Improvement in rawsago starch degrading enzyme production from Acremonium sp. endophytic fungus using carbon and nitrogensources[J]. Enzyme and Microbial Technology, 2000, 27: 511-515.
[14] 苏小军, 熊兴耀, 谭兴和, 等. 黑曲霉AF-1固态发酵生产生淀粉酶的条件优化[J]. 湖南农业大学学报, 2009, 35(2): 208-212.
[15] 蔡宇杰, 诸葛斌, 张锡红, 等. 黑曲霉AF-1遗传算法与神经网络耦联法优化生淀粉酶发酵培养基[J]. 无锡轻工大学学报, 2001, 20(4): 421-423.
[16] 刘军, 朱文优. 产生淀粉酶系菌株的筛选及其混株发酵粗酶研究[J].酿酒科技, 2006(12): 51-53.
[17] 李彧娜. 微孢根霉华根霉变种CICIM F0088生淀粉酶系的研究[D].无锡: 江南大学, 2010.
[18] 曹小红, 蔡萍, 李凡, 等. 利用响应面法优化Bacillus natto TK-1产脂肽发酵培养基[J]. 中国生物工程杂志, 2007, 27(4): 59-65.
[19] 徐子钧, 李剑, 梁凤来, 等. 利用SAS软件优化L-乳酸发酵培养基[J].微生物学通报, 2004, 31(3): 85-87.
[20] 王晓青, 曾洪梅, 石义萍. 农用抗生素2-16高产菌株选育及发酵优化组合研究[J]. 微生物学通报, 2005, 32(6): 7-11.
[21] 高鹏飞, 李妍, 赵文静, 等. 益生菌Lactobacillus casei Zhang增殖培养基的优化[J]. 微生物学通报, 2008, 35(4): 623-628.
[22] SUN Ying, WANG Zhengfu, WU Jihong, et al. Optimising enzymatic macerationin pretreatment of carrot juice concentrate by response surface methodology[J]. International Journal of Food Science and Technology, 2006, 41(9): 1082-1089.
[23] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical and Bioanalytical Chemistry, 1959, 31: 426-427.
[24] 罗军侠. 耐酸生淀粉糖化酶的初步研究[D]. 无锡: 江南大学, 2008.
[25] 刘连成, 陆正清. 生淀粉糖化酶产生菌营养条件的初步优化[J]. 酿酒科技, 2009(6): 43-46.
Optimization of Medium Components for the Production of Raw-Starch-Digesting Amylase by Monascus M2 in Solid State Fermentation
LIU Bo1, ZENG Li-ping2, WU Ying-long1,*
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
The activity of raw-starch-digesting amylase produced by Monascus M2 in solid state fermentation was investigated with respect to three medium components including carbon source, nitrogen source and inorganic salt. Response surface methodology was used to optimize three different levels of lactose, (NH4)2SO4and K2HPO4by setting up a quadratic regression model. The optimized basic solid medium contained 8.18% lactose, 6.36% (NH4)2SO4and 0.91% K2HPO4. The resulting maximum predicted activity of raw-starch-digesting amylase was 680.29 U/g, compared to 662.21 U/g observed in validation experiments.
Monascus; solid-state fermentation; raw-starch-digesting amylase; Box-Behnken experiment design
TS231
A
1002-6630(2014)07-0181-06
10.7506/spkx1002-6630-201407036
2013-07-10
刘波(1987—),男,硕士研究生,研究方向为功能性食品。E-mail:scmslb0425@163.com
*通信作者:邬应龙(1963—),男,教授,博士,研究方向为功能性食品。E-mail:wuyinglong99@163.com

