干燥条件对青花椒色泽的影响
张 艺,张甫生,宋莹莹,陈光静,吴金松,罗东升,阚建全*
(西南大学食品科学学院,重庆市农产品加工与贮藏重点实验室,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
干燥条件对青花椒色泽的影响
张 艺,张甫生,宋莹莹,陈光静,吴金松,罗东升,阚建全*
(西南大学食品科学学院,重庆市农产品加工与贮藏重点实验室,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
为了解不同的干燥条件与青花椒果皮表面油胞的完整性对鲜青花椒干燥后色泽的影响,以鲜青花椒为原料,研究破油胞组、未破油胞组、阴干组这3种干燥条件对青花椒色泽和叶绿素降解情况的影响。结果表明:不同的干燥条件对干燥后青花椒的色泽均有一定程度的影响,破油胞组干青花椒变色最为严重,阴干组干青花椒变色次之,未破油胞组干青花椒青绿色泽最好;不同干燥条件下,叶绿素的降解产物不完全相同;脱镁叶绿酸等褐色叶绿素降解产物的产生可能是破油胞组与阴干组干青花椒变色的原因之一;干燥过程中,青花椒的色泽参数值与叶绿素a、b含量的变化呈极显著(P<0.01)正相关关系。
青花椒;色泽;干燥;叶绿素降解
花椒,又名蜀椒、川椒等,是芸香科落叶灌木或小乔木的成熟果皮,主要包括青花椒(Zmnthoxylum schinifolium Sieb.et Zucc.)和红花椒(Zanthoxylum bungeanum Maxim.),是中国传统的香料,有“中国八大调料”之称[1]。青花椒简称青椒,因其果实成熟后仍呈青绿色而得名。青花椒麻味纯正浓烈,气味清香,深受消费者喜爱,广泛用于食品的烹调和加工之中,现已形成重庆江津、四川金阳等著名的青花椒生产基地[2-3]。
由于青花椒的生产具有季节性,因此干青花椒是青花椒产业中最主要的初级产品,正常的干青花椒呈翠绿色,其色泽是干青花椒最重要的质量指标之一[4]。目前青花椒主要的干制方式仍然是自然晾晒。采收后的鲜青花椒在太阳能的自然干燥过程中,很容易变成黑色而失去青绿色,就是在最佳的自然干燥条件下和鲜青花椒的油胞保持完整时,青花椒的变色率也在20%以上;如遇天气不好(阴湿)和鲜青花椒的油胞在采收和转运时破损较大时,青花椒的变色率将达到80%以上。青绿色的干青花椒与变色的干青花椒,市场售价相差2~5倍,种植农户仅这一环节的损失就很大。解决这一环节的变色问题,已迫在眉捷。但目前国内外关于青花椒的研究主要集中在香气成分分析[5-6]、活性物质(如酰胺类物质[7-8]和生物碱[9-10])等方面,关于青花椒自然干燥时色泽变化的报道几乎没有。本研究为在尽量接近青花椒自然干燥的情况下,通过对在各种干燥条件下青花椒色泽变化和叶绿素降解情况的研究,旨在为寻求一种青花椒的最佳干燥条件提供实验数据。
1 材料与方法
1.1 材料与试剂
鲜青花椒,采摘于重庆市江津区先锋镇青花椒生产基地。
叶绿素及其衍生物标准品 实验室自制[11];丙酮(色谱纯) 成都科龙化工试剂厂;正己烷、甲醇、N,N-二甲基甲酰胺(N,N-dimethyl formamide,DMF)、四丁基溴化铵、乙酸铵(均为分析纯) 成都科龙化工试剂厂。
1.2 仪器与设备
LC-20A分析型液相色谱仪 日本岛津公司;UltroScan PRO测色仪 美国Hunter Lab公司;MAP-500D电子天平 上海一恒科学仪器有限公司;101-3-S电热恒温鼓风干燥箱 重庆慧达实验仪器有限公司;FSH-Ⅱ型匀浆机 江苏环宇科学仪器厂;RE52-98旋转蒸发仪 上海亚荣生化仪器厂;DF8517超低温冰箱韩国Ilshin公司。
1.3 方法
1.3.1 样品处理
实验模仿夏季自然干燥条件,夏季晴天正午地面温度在45 ℃左右,如遇连续阴雨天气,室内温度约为25 ℃。取鲜青花椒分别放置在45 ℃(当时室外晒制的平均温度,鼓风干燥)与25 ℃(当时室内8 d的平均温度,相应的相对湿度变化范围为55%~75%,平均相对湿度为60%,室内阴干)的温度下干燥,干燥时间分别为12 h和144 h(两种温度下的干燥时间是由青花椒干燥结束时水分含量是否达到成品干青花椒水分含量确定的),45 ℃条件下干燥的样品每隔2 h取一次样,25 ℃条件下干燥的样品每隔24 h取一次样,取得的样品立即用UltroScan PRO测色仪测定其颜色,其余样品用于测定叶绿素及其降解衍生物的含量与种类。由于阴干组是在室内自然阴干的,其相对湿度有一定的波动,因此为避免由环境变化所引起的差异,本实验共处理3个批次的样品,每一批次处理方法相同,25 ℃与相对湿度为60%分别为3个批次处理时间内的平均温度和平均相对湿度。
在45 ℃条件下干燥的青花椒设定了鲜青花椒破油胞组与不破油胞组,即把鲜青花椒表面油胞的完整性也纳入考察条件之一。破坏油胞处理:每50 g新鲜青花椒分装于500 mL锥形瓶中于振荡器上200 r/min振荡60 s,以获得破坏油胞的样品。即设定3组实验:破油胞组(鲜青花椒经破油胞处理后放置在45 ℃条件下干燥)、未破油胞组(鲜青花椒直接放置在45 ℃条件下干燥)、阴干组(鲜青花椒放置在室内阴干,室内平均温度为25 ℃)。
1.3.2 青花椒色泽的测定方法
采用色度仪-电子眼检测(Hunter Lab),观察面积0.18 mm,选用RSIN-包括镜面反射模式,滤光片位置:微量的。采用国际CIE Lab色度空间表示颜色,仪器校正完成后开始测量样品花椒的L*、a*、b*值,L*为亮度,在0~100之间,0表示绝对黑色,100表示绝对白色;a*为红绿轴(-a*代表绿,+a*代表红,a*值变化范围为-100~+100);b*为蓝黄轴(-b*代表蓝,+b*代表黄,b*值变化范围为-100~+100)[12-13]。每个样品测量20颗青花椒,每颗测1次。测量完成后由CIE Lab模式转换为CIE LCh模式即可得到所测颜色的C值和h值,分别代表所测颜色的彩度和色相。总色差’E*的计算以新鲜青花椒的L*、a*、b*值作为标准对照,根据国际ASTM E308-99标准,相应的计算公式为:

1.3.3 叶绿素及其降解衍生物含量的测定
参考Fraser[14]、Arkus[15]等的方法。将制备好的叶绿素a、叶绿素b、脱植基叶绿素a、脱植基叶绿素b和脱镁叶绿酸a用80%丙酮配制成不同浓度的溶液,用高效液相色谱仪进行测定,绘制的标准曲线见表1,对于不常见且不易制备的叶绿素衍生物均采用与其具有相似吸收光谱的物质的标准曲线进行定量。

表1 叶绿素及其降解衍生物的标准曲线Table 1 Standard curves of chlorophylls and their derivatives
样品前处理的方法:参考Roca等[16]的方法。称取青花椒样品5.0 g,加入到用MgCO3饱和过的50 mL DMF溶液中,匀浆后过滤,滤渣再用50 mL DMF提取,过滤。合并、收集滤液于分液漏斗中,加入正己烷(50 mL×3)用以除去油脂和部分类胡萝卜素,叶绿素类色素保留在DMF相中。将富含叶绿素的DMF溶液低压旋转蒸发(低于30 ℃)去掉DMF溶剂后,残余物溶于5 mL丙酮中,此样品溶液过0.45 øm有机滤膜后用于高效液相色谱分析。
液相色谱分析条件:色谱柱为GL Sciences Column(ODS-SP,4.6 mm×250 mm,5 øm);流动相A相组成体积比为1∶1∶8的离子对-水-甲醇(离子对为含有四丁基溴化铵(0.05 mol/L)和醋酸铵(1.0 mol/L)的水溶液),B相组成体积比为1∶1的甲醇-丙酮;洗脱程序为:B相在35 min内由0%线性增加到100%,并维持100% B相15 min,在下次进样之前需用A相平衡柱子10 min;0~30 min的流速为1 mL/min,30~50 min的流速为0.6 mL/min;进样量为10 øL;脱植基叶绿素类色素的检测波长为432 nm,脱镁叶绿酸类色素检测波长为409 nm,叶绿素和脱镁叶绿素类色素采用荧光检测器进行检测,其激发波长为440 nm,发射波长为660 nm。
1.4 数据分析
所有实验重复3次,实验数据处理和分析在Excel(2003)中进行。所有结果均为3批次处理样品,数值为±s。
2 结果与分析
2.1 在干燥过程中鲜青花椒色泽的变化研究
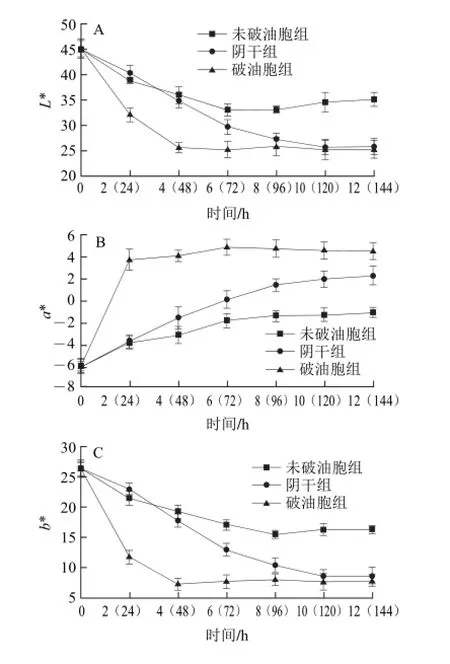

图1 青花椒干燥过程中色泽参数的变化(x±s,n=3)Fig.1 Variations in color parameters during drying of green prickleyashes (x ±s, n = 3)
由图1可知,在不同干燥条件下青花椒的亮度值L*、黄蓝值b*、彩度值C、色相值h均随干燥时间的延长而逐渐减小,红绿值a*则随干燥时间的延长而逐渐增大,说明任意一种干燥条件均对青花椒的色泽有一定的影响。红绿值a*是评价青花椒干燥后是否仍为绿色的一个重要指标,只有未破油胞青花椒在干燥结束后其a*值仍为负值(-1.15±0.04),说明干燥结束后只有未破油胞青花椒的色泽仍为绿色。

表2 青花椒干燥过程中色泽变化的感官评价(x±s,n =3)Table 2 Sensory evaluation of the color changes during drying of green prickleyashes (x ±s, n = 3)
由表2可知,青花椒干燥前均为青绿色,而干燥结束后只有未破油胞组的青花椒为绿色,而阴干组与破油胞组青花椒分别为黄褐色和黑褐色。
总色差’E*是指未干燥鲜青花椒与干燥后青花椒色泽变化差异的指标,’E*值越大表示色泽差异越大[17]。未破油胞青花椒在45 ℃干燥6 h后其’E*值基本保持不变,且干燥结束时其’E*值也最小,说明未破油胞青花椒的色泽变化主要发生在干燥前期且干燥前后色泽变化最小;破油胞青花椒在45 ℃干燥2 h后其’E*值就达到了21.85±1.47,干燥结束时其’E*值与未破油胞组相比差异极显著(P<0.01),说明破油胞青花椒干燥时变色迅速且干燥后变色严重;阴干青花椒的’E*值在整个干燥过程中逐渐增加,干燥结束时其’E*值与破油胞组差异不显著(P>0.05),说明阴干青花椒是缓慢变色直至干燥结束时变色也很严重。

表3 青花椒干燥过程中色泽参数值与叶绿素主要成分变化的相关性Table 3 Correlation between color parameters and chlorophyll contents during drying of green prickleyashes
由表3可知,任意一种干燥条件下青花椒各色泽参数之间均存在密切的相关性,且任一干燥条件下的L*、a*、b*、C、h、’E*值两两之间的相关性均为极显著(P<0.01)。
2.2 青花椒干燥前后叶绿素及其衍生物含量和种类的变化
由表4可知,新鲜青花椒中主要的叶绿素是叶绿素a和叶绿素b(占色素总量的97.93%);未破油胞组干青花椒仍以叶绿素a和叶绿素b(占色素总量的91.75%)为主,说明未破油胞组干青花椒叶绿素降解少;破油胞组干青花椒中绝大多数为脱镁叶绿酸a、焦脱镁叶绿酸a和脱镁叶绿素a(共占总色素含量的50.10%),而其叶绿素a、b仅占色素总量的35.91%;分析其原因可能是因为破油胞处理增加了酶与底物之间的接触机会,使叶绿素短时间内发生酶降解,而酶降解途径的下游降解反应(生成脱镁叶绿酸a之后)受到一定程度的抑制,从而造成了脱镁叶绿酸a、焦脱镁叶绿酸a和脱镁叶绿素a等叶绿素降解产物的积累[18]。阴干组干青花椒中虽仍以叶绿素a、b为主(共占有总色素含量的74.58%),但与未破油胞组干青花椒相比,其叶绿素已发生较大程度的降解,且降解产物与破油胞组干青花椒相似。说明破油胞组和阴干组干青花椒颜色为黑褐色有可能是由于生成了脱镁叶绿酸a、焦脱镁叶绿酸a和脱镁叶绿素a等褐色叶绿素降解衍生物所致[19-20]。

表4 新鲜青花椒和干青花椒中叶绿素及其衍生物的含量对比Table 4 Comparison of contents of chlorophylls and their derivatives in fresh and dried green prickleyashes
2.3 叶绿素a、叶绿素b含量与青花椒色泽变化的关系

图2 青花椒干燥过程中叶绿素a和叶绿素b含量的变化Fig.2 Variations in chlorophyll a and chlorophyll b contents during drying of green prickleyashes
表3相关性分析表明干燥过程中青花椒色泽参数L*、a*、b*、C、h值的变化与叶绿素a、叶绿素b的变化呈极显著相关关系(P<0.01),推测青花椒色泽的变化也可能与其叶绿素a、b含量的变化有关,图2为青花椒干燥过程中叶绿素a、叶绿素b含量的变化情况。3种干燥条件下叶绿素a、叶绿素b的含量均随干燥时间的延长而逐渐降低。干燥结束后,未破油胞组干青花椒中叶绿素a、b含量高于破油胞组干青花椒,两者差异均达极显著水平(P<0.01),说明青花椒果皮油胞的完整性对叶绿素a、b降解的影响极显著,可能是因为破油胞处理引起了细胞结构的破坏,使得原本相互分离的酶与底物能接触进而发生反应[21-22],加速了叶绿素a、b的降解;未破油胞组干青花椒与阴干组干青花椒相比,干燥结束时其叶绿素a含量差异不显著,而叶绿素b含量差异显著(P<0.05),说明这两组实验中干青花椒色泽的差异并不是由叶绿素a含量的减少所引起的,而其与叶绿素b含量的关系还有待进一步的研究。
3 结 论
通过对破油胞组、未破油胞组、阴干组这3种干燥条件对青花椒色泽和叶绿素降解情况影响的研究结果表明:油胞的破裂会导致青花椒严重变色,使干燥后的青花椒呈黑褐色,且其叶绿素降解产生了大量不常见的叶绿素降解衍生物;而温度对青花椒色泽的影响略低于油胞的完整性,阴干干燥后的青花椒虽也变色严重,呈黄褐色,但其叶绿素降解产生的不常见叶绿素衍生物的量较少;而其中脱镁叶绿素a等褐色叶绿素降解产物的产生可能是破油胞组与阴干组干青花椒变色的原因之一。因此青花椒在采摘、运输以及干燥过程中应特别注意保护其表面油胞不受破坏,同时遇阴雨天气时青花椒应尽量集中在较高温度下人工干燥,虽然在一定程度上提高了成本,但缩短了干燥时间且有利于青花椒的护色。
[1] 黄德民, 赵国华, 陈宗道, 等. 我国花椒的饮食文化探源[J]. 中国调味品, 2006(1): 75-81.
[2] 张华, 叶萌. 青花椒的分类地位及成分研究现状[J]. 北方园艺, 2010(14): 199-203.
[3] 姚佳, 蒲彪. 青花椒的研究进展[J]. 中国调味品, 2010, 30(6): 35-39.
[4] 余晓琴. 花椒品质评价方法及其应用研究[D]. 重庆: 西南大学, 2010.
[5] WEI Shigang, HANG Huihui, WANG Yeqiang, et al. Ultrasonic nebulization extraction-heating gas flow transfer-headspace singledrop microextraction of essential oil from pericarp of Zanthoxylum bungeanum Maxim[J]. Chromatography A, 2011, 1218(79): 4599-4605.
[6] CHARNG-CHERNG C, JENG-LEUN M, CHUNG-MAY W. Characteristics of the steam-distilled oil and carbon dioxide extract of Zanthoxylum simulans fruits[J]. Journal of Agricultural and Food Chemistry, 2011, 44(4): 1096-1099.
[7] TSUTOMU H, KAZUTOSHI I, TOMO-OMI O, et al. Aliphatic acid amides of the fruits of Zanthoxylum piperitum[J]. Phytochemistry, 2004, 65(18): 2599-2604.
[8] QUANBO X, DAWEN S, HIROFUMI Y, et al. Alkyamids from pericarps of Zanthoxylum bungeanum[J]. Phytochemistry, 1997, 46(6): 1123-1126.
[9] TARUS P K, COOMBES P H, CROUCH N R, et al. Benzo[c] phenanthridine alkaloids from stem bark of the forest knobwood, Zanthoxylum davyi(Rutaceae)[J]. South African Journal of Botany, 2006, 72(4): 555-558.
[10] AHMAD M U, RAHMAN M A, HUQ E, et al. Alkaloids of Zanthoxylum budrunga[J]. Fitoterapia, 2003, 74(1): 191-193.
[11] CHEN Kewei, ZHANG Fusheng, KAN Jiqnquan. Characterization of chlorophyll breakdown in green prickleyashes (Zanthoxylum schinifolium Zucc.) during slow drying [J]. European Food Research and Technology, 2012, 234(6): 1023-1031.
[12] NURIA C A, VILBETT B, PILAR B, et al. Microstructure affects the rate of chemical, physical and color changes during storage of dried apple discs[J]. Journal of Food Engineering, 2008, 85(2): 222-231.
[13] AYSUM M, SEVIM K, MEDENI M. Effect of concentration and drying processes on color change of grape juice and leather (pestil)[J]. Journal of Food Engineering, 2002, 54(1): 75-80.
[14] FRASER M S, FRANKL G. Detection of chlorophyll derivatives in soybean oil by HPLC[J]. Journal of the American Oil Chemists’Society, 1985, 62(1): 113-121.
[15] ARKUS K A J, CAHOON E B, JEZ J M. Mechanistic analysis of wheat chlorophyllase[J]. Archives Biochemistry and Biophysics, 2005, 438(2): 146-155.
[16] ROCA M, JAMES C, PRUZINSKA A. Analysis of the chlorophyll catabolism pathway in leaves of an introgression senescence mutant of Lolium temulentum[J]. Phytochemistry, 2004, 65(9): 1231-1238.
[17] 韩燕, 吴厚久, 窦华亭. 鲜橙汁冷藏期间色泽变化研究[J]. 食品科学, 2010, 31(2): 269-272.
[18] HORNERO-MÉNDEZ D, GANDUL-ROJAS B, MÍNGUEZMOSQUERA M I. Routine and sensitive SPE-HPLC method for quantitative determination of pheophytin a and pyropheophytin a in olive oils[J]. Food Research International, 2005, 38(8): 1067-1072.
[19] VERGARA-DOMÍNGUEZ H, GANDUL-ROJAS B, ROCA M. Formation of oxidised chlorophyll catabolites in olives[J]. Journal of Food Composition and Analysis, 2011, 24(6): 851-857.
[20] ULRICH E, BERNHARD G, STEFAN H. Recent advances in chlorophyll biosynthesis and breakdown in higher plants[J].Plant Molecular Biology, 2004, 56(1): 1-14.
[21] BIBHUTI B M, SATYENDRA G, ARUN S. Browning of fresh-cut eggplant: impact of cutting and storage[J]. Postharvest Biology and Technology, 2012, 67: 44-51.
[22] GEMMA O O, ALEJANDRA ROJAS-GRAU M, LAURA A G, et al. Recent approaches using chemical treatments to preserve quality of fresh-cut fruit: a review[J]. Postharvest Biology and Technology, 2010, 57(3): 139-148.
Effects of Different Drying Conditions on Color Change of Green Prickleyashes (Zanthoxylum schinifolium Zucc.)
ZHANG Yi, ZHANG Fu-sheng, SONG Ying-ying, CHEN Guang-jing, WU Jin-song, LUO Dong-sheng, KAN Jian-quan*
(Chongqing Key Laboratory of Product Processing and Storage, Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservation (Chongqing), Ministry of Agriculture, College of Food Science, Southwest University, Chongqing 400715, China)
In this study, fresh green prickleyashes were employed as experimental materials. Investigations were carried out to explore the effect of different drying conditions (oil vacuoles were damaged or intact after drying at 45 ℃; drying at 25 ℃in the shade) and the integrity of oil vacuoles on the color of green prickleyashes during drying process. The results showed that all the drying conditions had some effects on the color of green prickleyashes. Samples with damaged oil vacuoles showed the severest browning, followed by those dried in the shade, and the integral oil vacuoles could help protect the color to some degree. The black-brown color of dried green prickleyashes with damaged oil vacuoles and those dried in the shade may attributed to the abundant generation of pheophorbide a and pyropheophorbide a. The color of dried green prickleyashes was highly significantly positively correlated with the contents of Chl a and Chl b (P < 0.01).
green prickleyash; color; dry; chlorophyll breakdown
TS201.2
A
1002-6630(2014)05-0023-05
10.7506/spkx1002-6630-201405005
2013-02-26
国家自然科学基金面上项目(31071599);重庆市科委攻关计划项目(CSTC,2010AC1009)
张艺(1989—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:yiyiin163@163.com
*通信作者:阚建全(1965—),男,教授,博士,研究方向为食品化学与营养学、食品生物技术和食品质量与安全。
E-mail:ganjq1965@163.com

